周文惠,包红霞,王俊豪,黄远玲,王文惠,郝海红,2,3,4,5*
(1.华中农业大学, 农业微生物资源发掘与利用全国重点实验室,武汉 430070;2.动物育种与健康养殖前沿 科学中心,武汉 430070;3.华中农业大学,农业农村部畜禽产品质量安全风险评估实验室,武汉 430070; 4.华中农业大学-深圳营养与健康研究院,深圳 518000;5.石河子大学动物科技学院,石河子 832000)
产气荚膜梭菌(Clostridiumperfringens,CP)是革兰阳性厌氧条件致病菌,感染可引起多种畜禽疾病,包括鸡坏死性肠炎、羊气性坏疽等[1-2]。产气荚膜梭菌作为一种食源性人畜共患病原菌,引起多种肠道疾病,对人类健康和公共卫生造成了严重的威胁。目前,抗生素在治疗产气荚膜梭菌感染中仍发挥极大的作用,然而,由于抗生素的滥用与不合理使用等多种因素,导致产气荚膜梭菌耐药性增强[3-4]。中药作为中国传统文化的瑰宝和新药研究领域的重点研究对象,以其不易诱导产生耐药性、成本低、残留少、毒副作用小等优点成为当前研究热点,对多种疾病的治疗也有一定作用[5-6]。中药八大碗“参苓术草、芎归地芍”中的草即为甘草,是常用且重要的中药材,其应用范围广泛,有“十方九草”之说。甘草查尔酮A(licorice chalcone A, LCA)是从甘草中分离出来的一种新型类黄酮类物质,在甘草中的含量远远高于其他成分,具有抗癌、抑菌、抗炎、抗氧化、降血糖、保肝、抗寄生虫、减少肥胖等多种药理活性[7-13],其中抑菌作用是被显着低估的一种重要的药理作用[14-17],研究表明,LCA对产气荚膜梭菌具有明显抑制作用[18],因此,本试验以LCA为代表药物,探究其与多种抗生素联用对产气荚膜梭菌的抑菌作用,为抗生素与中药单体联用抗产气荚膜梭菌的应用提供新的思路。
1 材料与方法
1.1 试验材料
小檗碱标准品(纯度大于98%)、LCA标准品(纯度大于98%)、四环素(tetracycline,TCN)标准品(纯度大于95%)购自上海源叶生物科技有限公司;克林霉素(clindamycin,CLDM)标准品(纯度大于87.2%)购自中国药品生物制品检定所;替米考星(tilmicosin,TMS)标准品(纯度95.3%)购自中国兽医药品监察所。
药敏板(动物源细菌耐药性检测板-魏氏梭菌1#、2#、3#)购自一诺康(天津)科技发展有限公司。
1.2 方法
1.2.1 细菌培养 A型产气荚膜梭菌标准菌株(CVCC2030)由华中农业大学国家兽药残留基准试验室提供。将甘油冻存菌液划线于强化布氏琼脂培养皿,于37 ℃厌氧条件培养18~24 h,挑取单个菌落接种于FTG培养基于上述相同条件下培养8~12 h,划线接种于强化布氏琼脂培养皿18~24 h,刮取菌落用无菌PBS调麦氏比浊0.5(此时活菌数约为1×108CFU·mL-1),制成细菌悬液。
1.2.2 药敏试验 参照“1.2.1”的方法配制菌液;采用微量肉汤稀释法[18],检测CLDM、TMS、TCN等20种抗生素和LCA、小檗碱(berberine, BBR)2种中药单体对产气荚膜梭菌标准菌株CVCC2030的敏感性,测量其单独作用于产气荚膜梭菌的MIC值。采用棋盘法对该20种抗生素和2种中药单体进行联合药敏试验,测量其联合作用时的FIC值。计算FIC指数,FIC指数=甲药联合使用时的FIC/甲药单独使用时的MIC+乙药联合使用时的FIC/乙药单独使用时的MIC。当FIC指数≤0.5时,表示有协同作用;当0.5
1.2.3 杀菌曲线的绘制 细菌活化后挑取单菌落接种于100 mL FTG肉汤培养基中,37 ℃ 过夜厌氧培养。使用FTG培养基将过夜培养的菌液稀释100倍,分为10组,每组3个平行,各组药物浓度见表1,于37 ℃条件下厌氧培养。分别于之后的24 h内每隔2 h从每管内取样100 μL菌液,稀释涂布于强化布氏培养皿,培养24 h后分别计数,绘制不同药物种类和浓度作用下产气荚膜梭菌的杀菌曲线[18-21]。
1.2.4 溶血试验 将羊血用PBS清洗后取1 mL沉淀用PBS稀释为2%体积的红细胞悬液,将稀释好的红细胞悬液置于4 ℃条件下保存。将过夜培养后的菌液用无菌PBS稀释至0.5 MCF(麦氏浊度单位),设置11组,A组为无药阳性对照,B组为PBS无菌阴性对照,试验组加入菌液和不同浓度的药物(表2),37 ℃温水孵育30 min,加入2 mL红细胞悬液,再次温水孵育30 min后取出,10 000 r·min-1
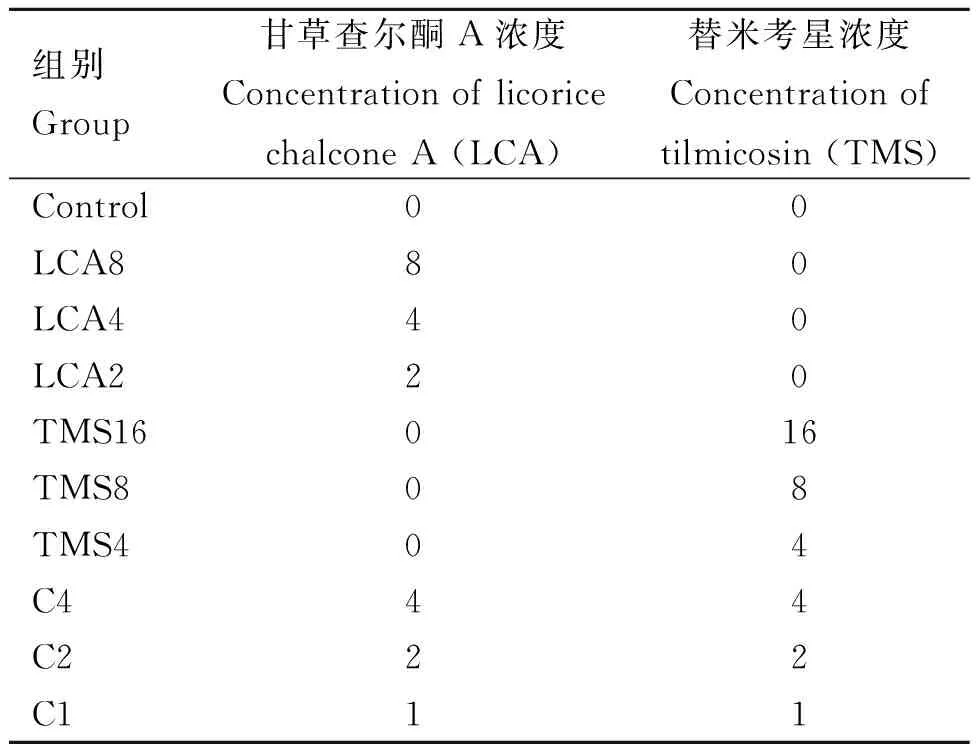
表1 杀菌曲线分组设置Table 1 Sterilization curve grouping settings μg·mL-1
离心2 min,取上清液测量其OD532 nm。根据公式计算其溶血定量,溶血定量(%)=(样品OD532 nm-阴性OD532 nm)/(阳性OD532 nm-阴性OD532 nm)×100%,设定无药A组为完全溶血,溶血定量100%,无菌B组为完全不溶血,溶血定量为0%。
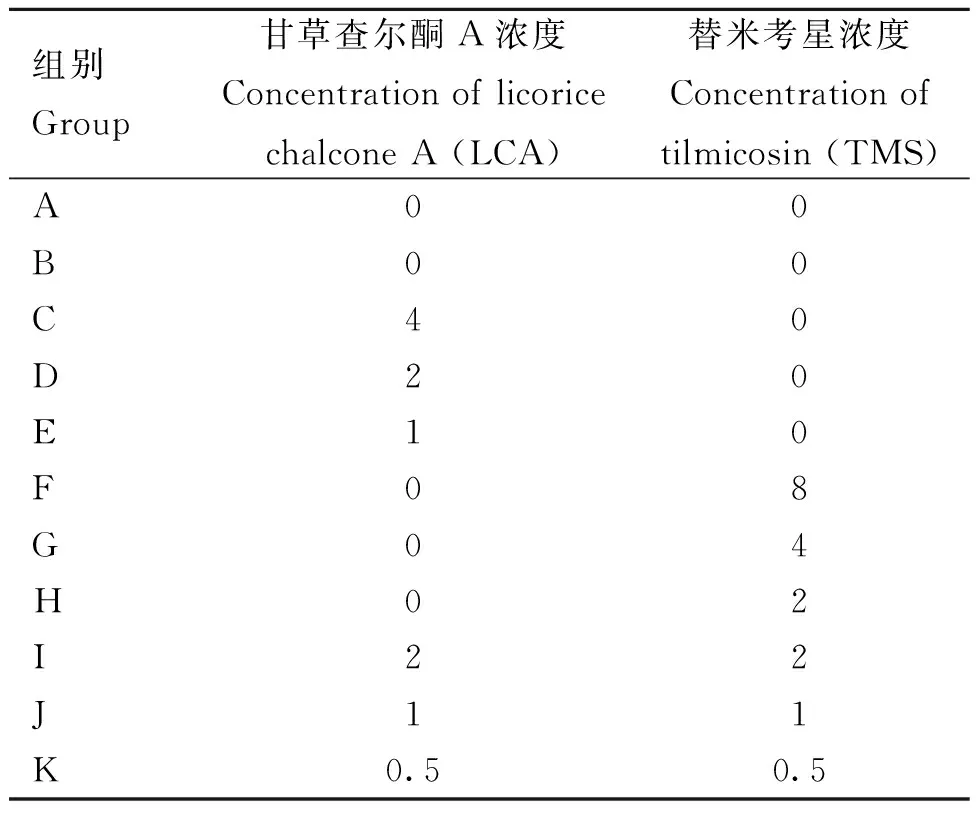
表2 溶血试验分组设置Table 2 Hemolysis test grouping settings μg·mL-1
1.2.5 细菌的迁移力——滑动试验 在BHI琼脂培养基中加入不同浓度的LCA和TMS,混匀后制备含药培养皿,用打孔器均匀打孔。按“1.2.1”方法配制菌液至1×108CFU·mL-1,将5 μL菌液滴入所制备的含药培养皿中,37 ℃厌氧培养72 h,观察其在平板上形成的菌苔大小与形状。比较其迁移距离在药物影响下的变化[22-25]。
1.2.6 气性坏疽模型的建立 气性坏疽模型使用25只SPF级6~8周龄BALB/c 雄鼠进行试验。将小鼠分为5组,其中4组分别为1×109、108、107、106CFU·mL-14种不同浓度的菌液,一组为PBS阴性对照,取0.1 mL右后肢肌肉注射感染小鼠,一段时间后处死,解剖观察其感染程度并进行分离鉴定,确定最佳菌液浓度[18]。
1.2.7 产气荚膜梭菌感染的治疗试验 将70 只6~8周龄的BALB/c小鼠分为14个组,每组5只。每只小鼠右后肢肌肉注射0.1 mL 1×108CFU·mL-1菌液,次日开始对小鼠进行灌胃给药,A组和B组分别为阴性和阳性对照组,治疗时给0.2 mL 50%体积浓度的DMSO,其他组为试验组,分别给予不同浓度和种类的药物,连续给药6 d[26-28],每天观察小鼠的外观和精神状态,详细记录不同组小鼠在治疗过程中的死亡情况及死亡时间,及时剖杀死亡小鼠,观察其病理变化并拍照记录,第7天全部处死、观察病理变化。
1.2.8 细菌分离鉴定 取病变组织样品,分离纯化细菌后进行PCR鉴定。PCR引物:cpa.F:5′-GTTGATAGCGCAGGACATGTTAAG-3′;cpa.R:5′-CATGTAGTCATCTGTTCCAGCATC-3′。采用25 μL PCR反应体系:TaqDNA聚合酶12.5 μL,cpa上、下游引物各1 μL,菌液2 μL,ddH2O 8.5 μL,设立阴性与阳性对照。PCR反应条件:94 ℃预变性 5 min;94 ℃ 15 s,55 ℃ 15 s,72 ℃ 30 s,共30个循环;72 ℃ 10 min。扩增产物长度约为402 bp。
1.2.9 组织切片与HE染色观察 无菌取各组小鼠感染的腿部肌肉组织,置于4%甲醛溶液中固定24 h,送至百仟度生物公司切片分析。
1.3 数据分析
2 结 果
2.1 药敏试验
药敏试验结果如表3、4所示,在20种抗生素中,共有红霉素等6种抗生素与LCA有相加作用,吉他霉素等4种抗生素与LCA有协同作用;吉他霉素等4种抗生素与BBR有相加作用,喹烯酮等3种抗生素与BBR有协同作用。
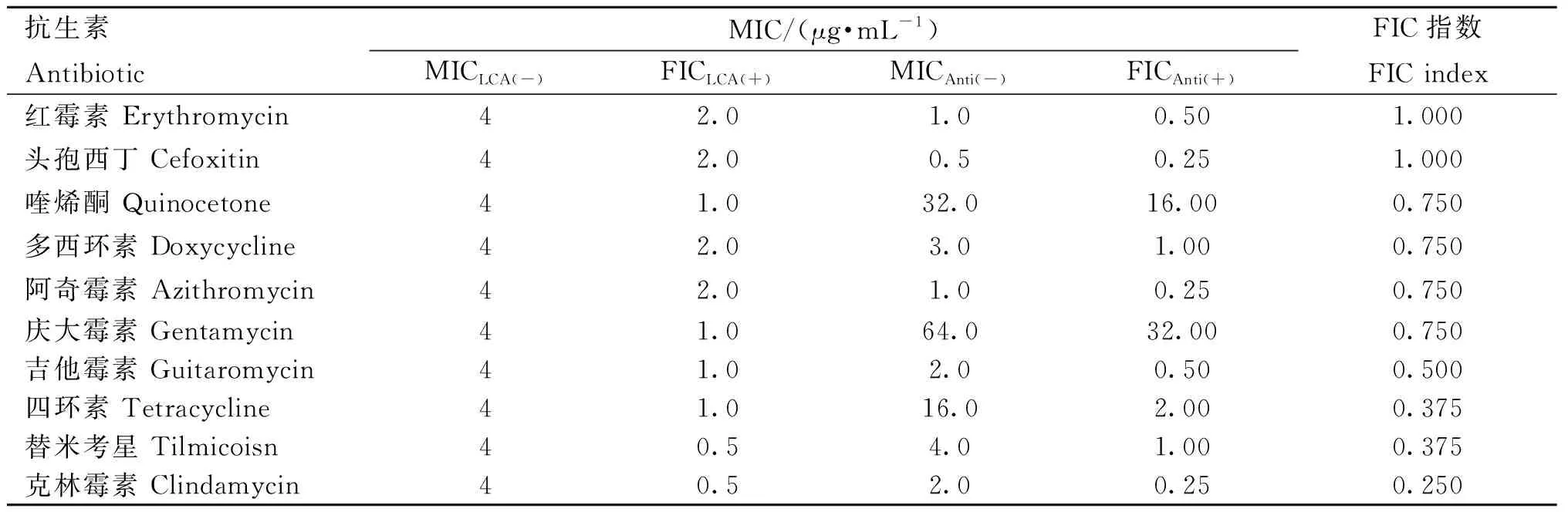
表3 甘草查尔酮A(LCA)药敏试验和联合药敏结果Table 3 Licorice chalcone A(LCA) drug sensitivity test and combined drug sensitivity results
根据试验结果显示,LCA与多种抗生素联用的协同作用普遍优于小檗碱;在与LCA作用的抗生素中,TCN、TMS、CLDM FIC指数最低,与LCA协同作用最好。
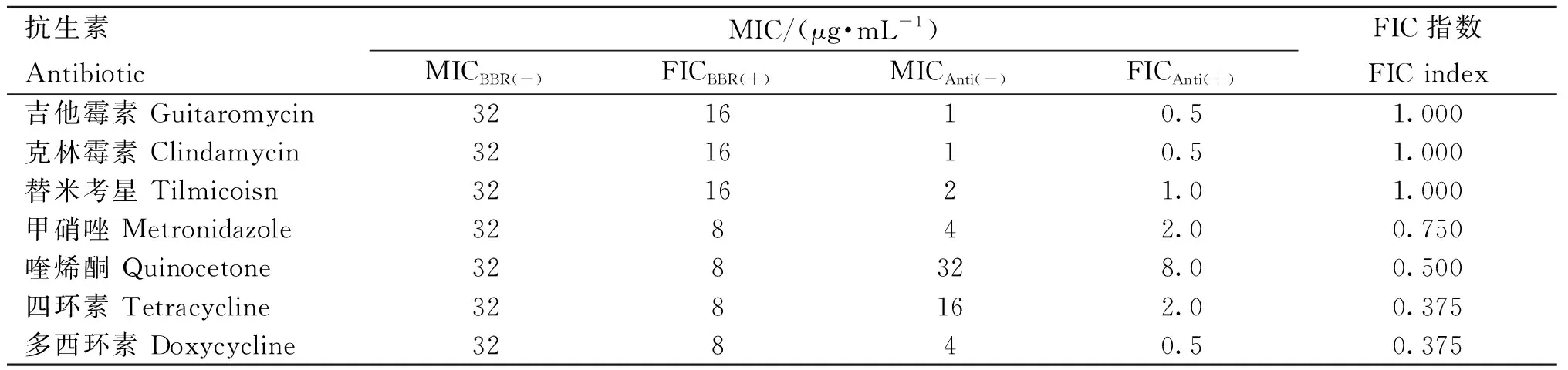
表4 小檗碱(BBR)药敏试验和联合药敏结果Table 4 Berberine (BBR) drug sensitivity test and combined drug sensitivity results
2.2 杀菌曲线
每隔2 h取体系中菌液涂板计数,以时间为横坐标,体系中菌落数的负对数为纵坐标,绘制杀菌曲线,如图1~3所示。
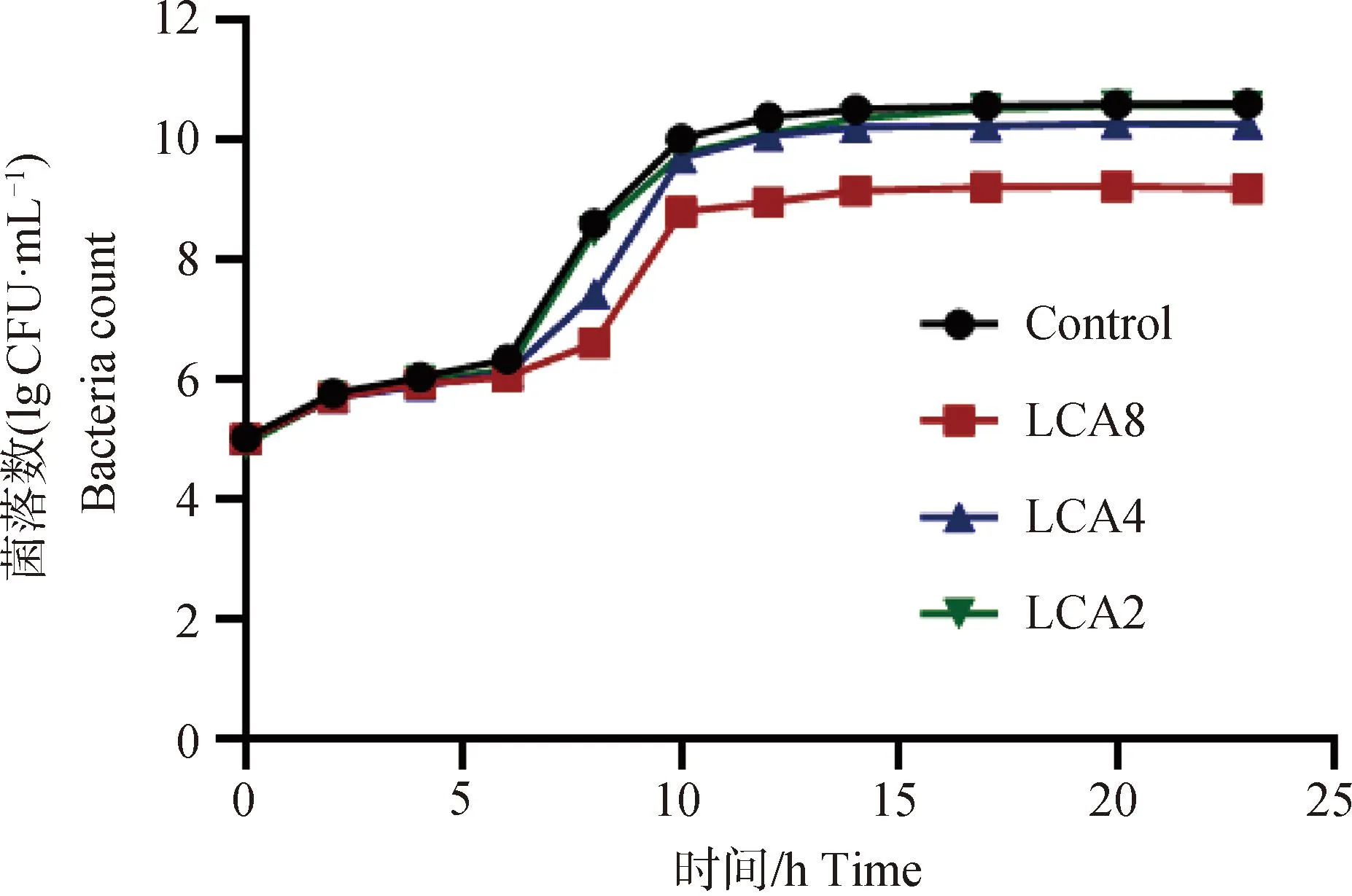
图1 甘草查尔酮A作用下产气荚膜梭菌CVCC2030的杀菌曲线Fig.1 Bactericidal profile of Clostridium perfringens CVCC2030 under the action of licorice chalcone A
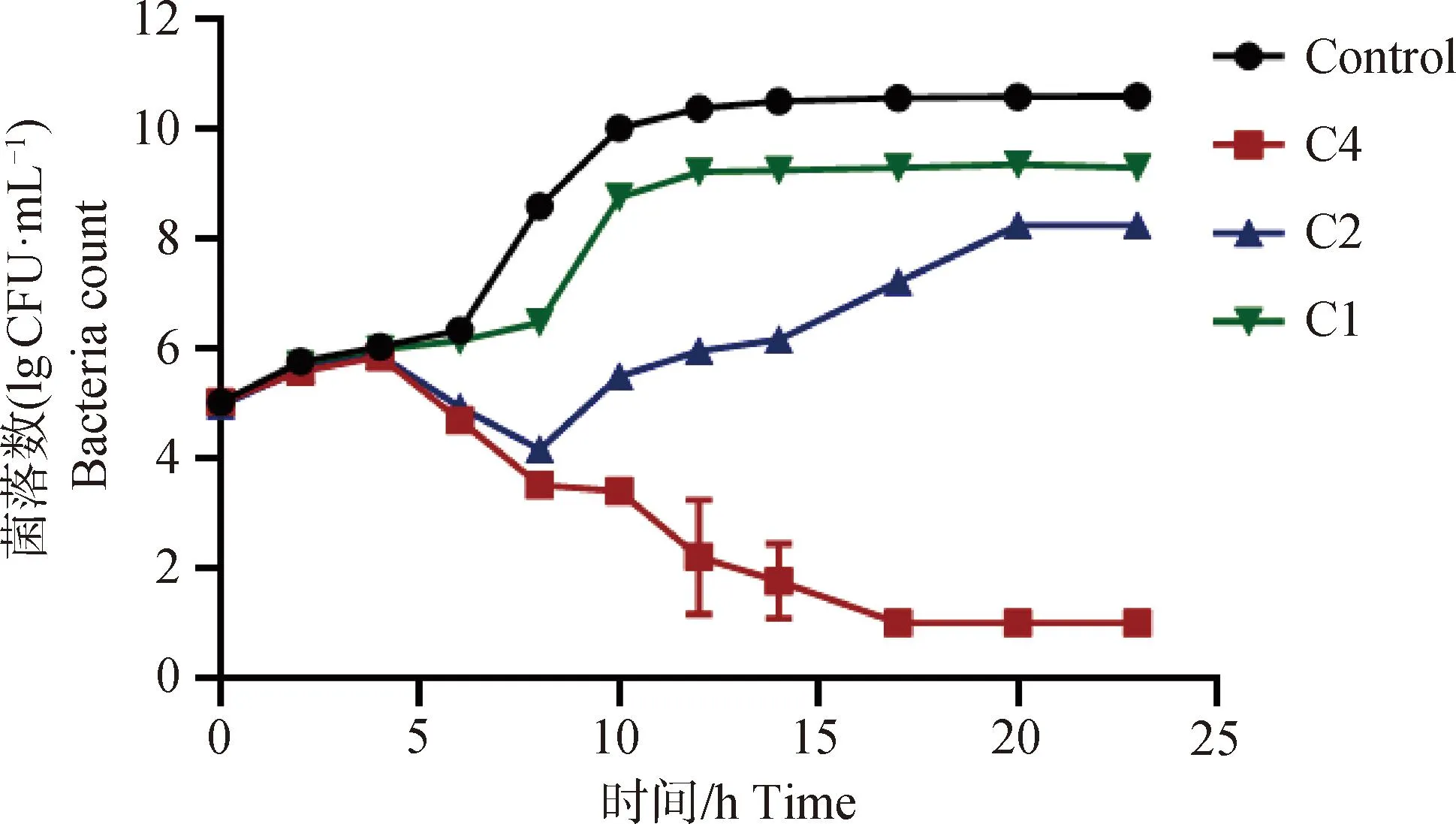
图3 LCA与TMS联合作用下产气荚膜梭菌CVCC2030的杀菌曲线Fig.3 Bactericidal profile of Clostridium perfringens CVCC2030 under the action of licorice chalcone A and tilmicosin
由图1、2可以看出,LCA对细菌生长的抑制作用不明显,TMS对产气荚膜梭菌的抑制作用较强,生长情况显着受到抑制,细菌活性明显下降,2×MIC浓度的TMS可在14 h内将细菌杀灭至检测线(10 CFU·mL-1)以下,4×MIC浓度的TMS可在12 h内将细菌杀灭至检测线以下,且后期无恢复生长,浓度越高,杀菌速度越快,所需时间越短,表明体外条件下TMS对产气荚膜梭菌CVCC2030的杀菌效果呈现浓度依赖性。
与图3结果对比,在相同浓度下LCA和TMS单独使用对产气荚膜梭菌生长仅起到抑制作用,不能完全杀灭,但联合作用时细菌生长停止,几乎全部死亡。低于MIC浓度的药物联合作用时,对细菌的生长有一定的抑制作用,但8 h后恢复生长。
2.3 溶血试验
根据溶血试验结果(表5)显示,LCA与TMS对产气荚膜梭菌的溶血效果均有抑制作用,细菌溶血性显着降低,联合作用处理后抑制作用更显着,I组与D组和H组相比,溶血定量显着降低,协同效果作用明显。且不同浓度的药物作用于细菌后其溶血定量有明显的浓度梯度,其溶血抑制作用存在浓度依赖性,高浓度药物对细菌的溶血抑制作用较强。
2.4 滑动试验
如图4所示,LCA和TMS对产气荚膜梭菌的生长都有抑制作用,然而在本次研究结果中却发现低剂量的LCA单独使用时与空白对照组相比,菌苔平均直径略有增大,高浓度时无肉眼可见的菌苔生长;TMS单独使用时对细菌迁移的抑制作用随浓度升高而增强,对产气荚膜梭菌的运动性无增强作用;当LCA与TMS联合使用时,菌苔直径显着增大,但菌苔内细菌密度有一定的降低。
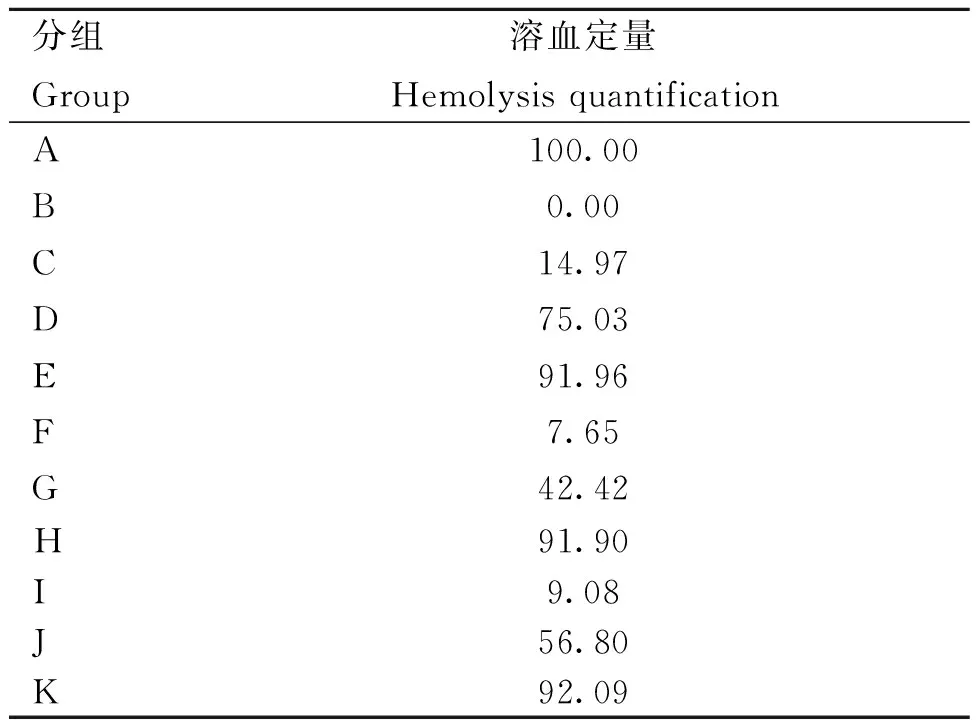
表5 溶血试验结果Table 5 Hemolysis test results %
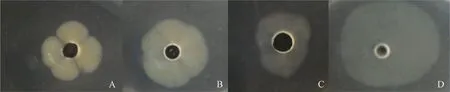
A为空白对照组;B所用含药培养基为LCA 1 μg·mL-1 ;C所用含药培养基为TMS 1 μg·mL-1;D所用含药培养基为LCA 0.5 μg·mL-1+TMS 0.5 μg·mL-1 A. The blank control; B. The drug-containing medium used is LCA 1 μg·mL-1; C. The drug-containing medium used is tilmicosin 1 μg·mL-1; D. The drug-containing medium used is LCA 0.5 μg·mL-1+tilmicosin 0.5 μg·mL-1图4 滑动试验中菌苔大小及形状Fig.4 Size and shape of the fungal moss in the sliding test
2.5 小鼠气性坏疽模型的建立
根据感染情况,选择使用1×108CFU·mL-1菌液进行肌注,成功建立小鼠腿部气性坏疽模型。
2.6 鼠源产气荚膜梭菌的分离鉴定
PCR结果如图5,成功分离鼠源产气荚膜梭菌16株。
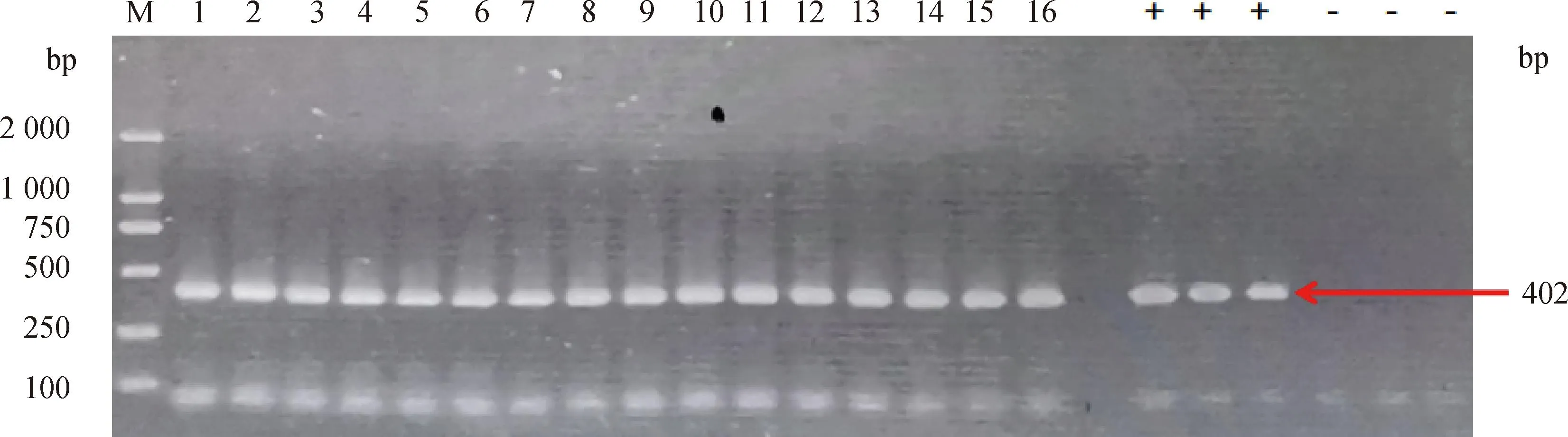
M. DL2000 DNA相对分子质量标准;1~16. 样本;+. 阳性对照;-. 阴性对照 M. Marker 2000;1-16. Sample to be tested;+. Positive control;-. Negative control图5 16株鼠源产气荚膜梭菌的PCR鉴定结果Fig.5 PCR identification of 16 strains of Clostridium perfringens of murine origin
2.7 产气荚膜梭菌感染治疗试验
小鼠腿部肌肉大体观察和HE染色切片结果如图6、7。
感染1 h后,阴性对照组小鼠精神良好、皮毛光亮、行动灵敏;阳性对照组和试验组均表现出右后肢行动不便、跛行、精神萎靡等症状。试验组中高剂量LCA组全部死亡,高浓度TCN组死亡率达80%,见表6。
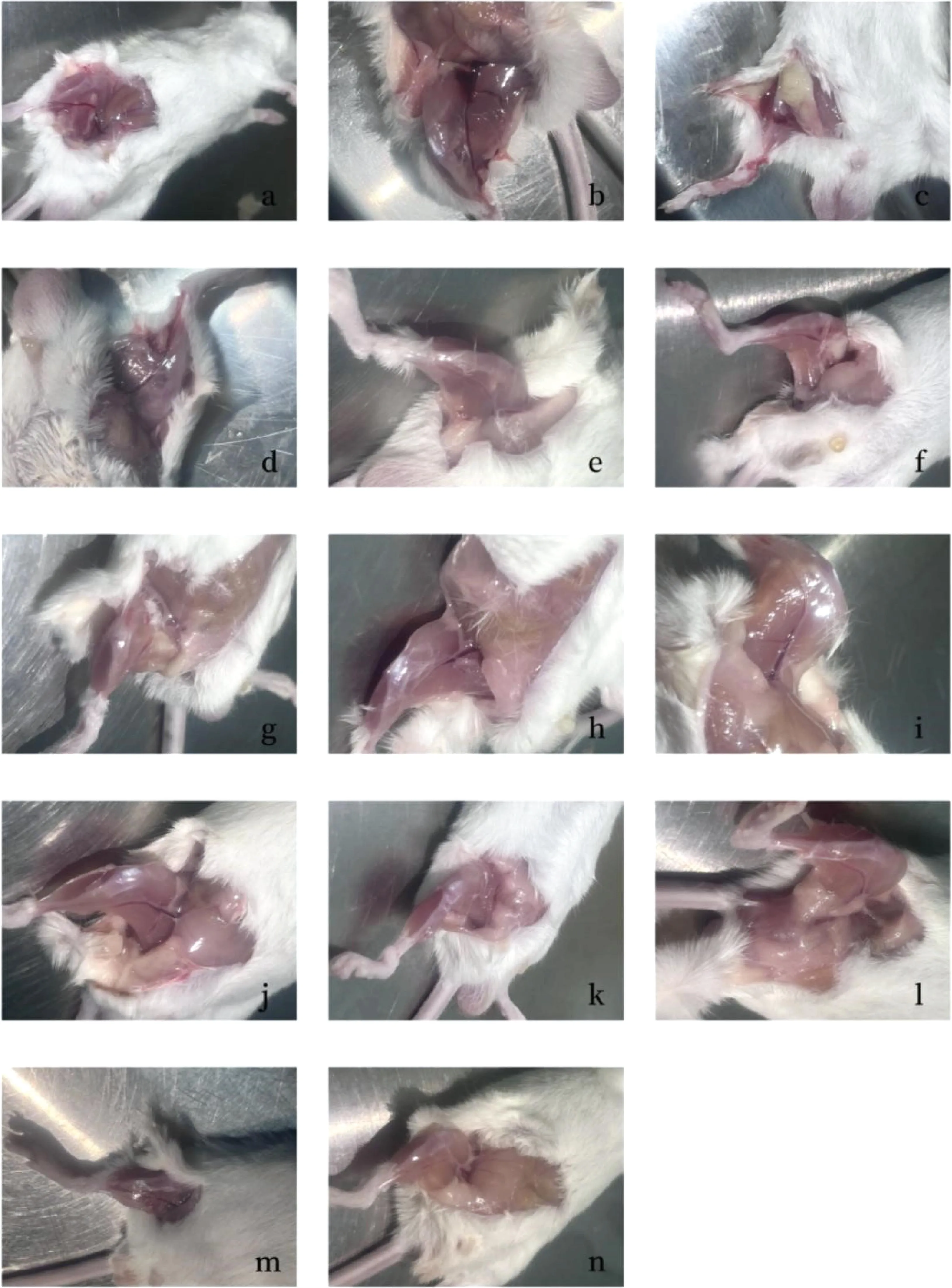
a.阴性对照组;b、c.阳性对照组;d.TCN 20 mg·mL-1组;e.TCN 80 mg·mL-1组;f.LCA 20 mg·mL-1 TCN 40 mg·mL-1组;g.TMS 10 mg·mL-1组; h.TMS 50 mg·mL-1组; i.LCA 20 mg·mL-1 TMS 10 mg·mL-1组; j.CLDM 5 mg·mL-1组; k.CLDM 10 mg·mL-1组; l.CLDM 50 mg·mL-1组;m.LCA 20 mg·mL-1组;n.LCA 20 mg·mL-1CLDM 40 mg·mL-1组 a. Negative control group; b and c. Positive control groups; d. Tetracycline 20 mg·mL-1 group; e. Tetracycline 80 mg·mL-1 group; f. Licorice chalcone A 20 mg·mL-1 tetracycline 40 mg·mL-1 group; g. Tilmicosin 10 mg·mL-1 group; h. Tilmicosin 50 mg·mL-1 group; i. Licorice chalcone A 20 mg·mL-1 tilmicosin 10 mg·mL-1 group; j. Clindamycin 5 mg·mL-1 group; k. Clindamycin 10 mg·mL-1 group; l. Clindamycin 50 mg·mL-1 group; m. Licorice chalcone A 20 mg·mL-1 group; n. Licorice chalcone A 20 mg·mL-1 clindamycin 40 mg·mL-1 group图6 病理组织观察结果Fig.6 Pathological tissue observation results
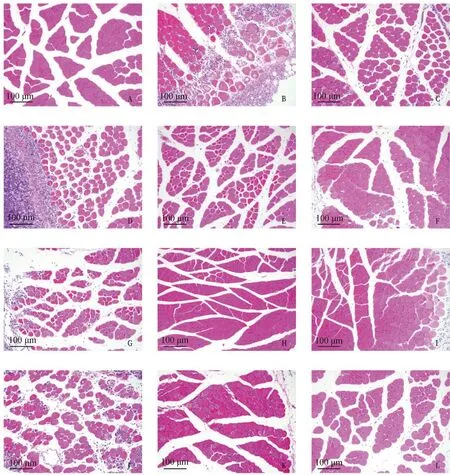
A.阴性对照,未进行感染处理;B.阳性对照,感染后未进行治疗;C.LCA 20 mg·mL-1;D. CLDM 5 mg·mL-1;E. CLDM 10 mg·mL-1;F. CLDM 50 mg·mL-1;G. TCN 20 mg·mL-1;H. TCN 80 mg·mL-1;I. TCN 20 mg·mL-1+LCA 20 mg·mL-1;J. TMS 10 mg·mL-1;K. TMS 50 mg·mL-1;L. TMS 10 mg·mL-1+LCA 20 mg·mL-1 A. Negative control, no attack treatment; B. Positive control, no treatment after attack; C. Licorice chalcone A 20 mg·mL-1; D. Clindamycin 5 mg·mL-1; E. Clindamycin 10 mg·mL-1; F. Clindamycin 50 mg·mL-1; G. Tetracycline 20 mg·mL-1; H. Tetracycline 80 mg·mL-1; I. Tetracycline 20 mg·mL-1+Licorice chalcone A 20 mg·mL-1; J. Tilmicosin 10 mg·mL-1; K. Tilmicosin 50 mg·mL-1; L. Tilmicosin 10 mg·mL-1+Licorice chalcone A 20 mg·mL-1图7 小鼠右后肢肌肉HE染色结果(200×)Fig.7 HE staining results of right hind limb muscles of mice (200×)
给药治疗后发现,LCA单独使用时效果不显着,高浓度LCA致死率高达100%,50 mg·mL-1CLDM抑菌效果较好,但体内情况下CLDM与LCA协同后效果未见显着增强;LCA与TMS和TCN体内协同作用较明显,抗生素与LCA联用后抑菌效果明显优于两种抗生素单独使用,高浓度TCN毒性较强,致死率高,TMS组低浓度组未见死亡,高浓度组致死率低,安全性高,综合效果优于TCN。
剖检时发现阳性对照组和各试验组右后肢均呈现不同程度的肿胀,部分小鼠右后肢毛发脱落,皮肤可见充气水泡样肿大,触感坚实,剖开后见小鼠腿部肌肉组织颜色较深,有不同程度的出血和脓肿块,如图6中b、c所示,阴性对照组小鼠腿部肌肉呈肉粉色,无出血和脓肿,如图6a所示。与阳性对照组相比,各试验组的肿胀程度可见不同程度的减轻,但与阴性对照组相比仍有一定改善。

表6 感染及治疗前后小鼠病理变化及死亡率Table 6 Pathological changes and mortality of mice before and after the attack and treatment
随机选择部分小鼠病变组织进行切片,如图7,阴性组中多核肌细胞的细胞核位于细胞边缘,横切肌细胞为形态不规则的多边形,相邻细胞排列紧密,细胞之间界限清晰,肌束之间间隙大小均匀,组织内未见坏死、炎症、出血、水肿等明显病理性改变,组织形态结构正常;阳性对照组视野中可见肌肉组织局部肌细胞坏死,组织形态遭到破坏,坏死肌纤维被增生的纤维结缔组织取代,伴有大量炎性细胞浸润。LCA高剂量组全部死亡,低剂量组视野中可见肌细胞结缔组织增生,细胞之间间隙显着增大,组织排列疏松,伴有炎性细胞弥散性浸润,但肌细胞坏死较阳性组少,组织形态仍可见。
低剂量CLDM组视野中肌肉组织局部仍可见肌细胞大面积坏死和纤维结缔组织增生,伴有大量炎性细胞浸润;高剂量CLDM组肌束间结缔组织轻度增生,肌束间隙轻度增大,炎性细胞少量弥漫性浸润,抑菌效果显着。CLDM与LCA联用组与单独使用时相比效果未见显着增强。
TCN单独作用时低剂量组效果不明显,肌细胞坏死明显,但与LCA联用后组织仅有少量炎性细胞弥散性浸润,但肌纤维形态结构较完整,细胞未见坏死、出血等病理变化,可见TCN与LCA联用能够显着提升治疗效果;高剂量组镜下细胞排列紧密,少见有炎性细胞和结缔组织增生,治疗效果显着,但致死率较高,达80%。
TMS低剂量组镜下视野中肌肉组织内部分肌细胞坏死,肌束形态结构破坏,由大量结缔组织增生取代,肌束间隙有大量炎性细胞弥散性浸润;同浓度TMS与LCA联用后,肌细胞形态结构相对完整,组织细胞排列轻度疏松,炎性细胞浸润减少,协同作用显着,TMS高剂量组肌细胞轻度溶解,肌细胞胞质淡染,结缔组织增生和炎性细胞浸润不明显。
3 讨 论
随着畜牧业的蓬勃发展,细菌感染导致的畜禽疾病日益严重,且由于人们对抗生素的滥用和误用,在实际生产中抗生素滥用现象十分普遍,导致细菌耐药性日益频发,尤其是“超级细菌”的产生为人们敲响了警钟。“减抗”“禁抗”已成为当前流行的大趋势,抗生素替代品的研发迫在眉睫。
多项研究表明,LCA有一定的抑菌活性[29-34],但有关抗菌机制的研究仍不清楚。Haraguchi等[34]的研究表明,不同于其他查尔酮,LCA和甘草查尔酮C(LCC)在其B环中各有一个异戊二烯链,能够为分子渗透到细胞膜中提供足够的疏水性。此外,LCA和LCC都是细菌NADH氧化酶的有效抑制剂,这些特性为其抗菌作用提供了基础。
LCA对多种细菌都有不同程度的抑制作用。陈环环[29]、吴玉霞[35]通过棋盘法证实LCA与头孢噻呋钠联合使用对大肠杆菌具有协同抑菌作用,与头孢噻肟联合具有协同和相加作用,与氨苄西林、阿莫西林、阿米卡星具有相加作用,得出结论,LCA与β-内酰胺类和氨基糖苷类联用的抑菌效果较好,与喹诺酮类联用协同效果不明显。
LCA通过破坏金黄色葡萄球菌的细胞壁来抑制其生长,刘一宁[36]通过气道滴注金葡菌建立小鼠的肺损伤模型,发现LCA可以降低感染小鼠肺部的载菌量。吴玉霞[35]通过扫描电镜观察LCA作用后对耐甲氧西林金黄色葡萄球菌(MRSA)以及标准菌的形态得出,LCA对MRSA抗菌活性明显优于标准菌。Qiu 等[37]研究认为,LCA可能通过抑制Agr双组分系统,从而显着降低了甲氧西林敏感金黄色葡萄球菌分泌的SEA和SEB毒素,从而达到抑菌作用。
郭晋祥等[31]研究表明,LCA通过抑制生物被膜的形成从而实现对铜绿假单胞菌的抑制作用,且LCA对小鼠体内铜绿假单胞菌感染有一定的治疗作用,减少小鼠皮肤表面脓肿的形成。LCA对肠球菌的抑菌活性也是通过影响生物膜的形成实现的,Liu等[33]研究表明,LCA可以通过调控MarR家族、TetR家族和MerR家族转录调控因子,抑制粪肠球菌生物膜的形成,从而发挥抗菌的作用。
本试验测定了LCA和小檗碱两种中药单体与红霉素等20种抗生素对产气荚膜梭菌的MIC,并分别进行联合药敏试验。结果发现,大环内酯类和四环素类抗生素与小檗碱和LCA联合抑菌增效作用明显,LCA对产气荚膜梭菌的MIC值为4 μg·mL-1,有良好的抑菌活性,而小檗碱对产气荚膜梭菌的MIC值为32 μg·mL-1,甘草查尔酮A具有更大的开发潜力。
杀菌曲线显示,LCA和TMS对产气荚膜梭菌的生长抑制作用较为显着,对产气荚膜梭菌的溶血性也有浓度依赖性的抑制作用,联合作用处理后效果明显,推测LCA和TMS可能会影响产气荚膜梭菌α毒素的产生,细菌的磷脂酶活性被抑制,从而影响其溶血性。
小鼠气性坏疽的治疗试验结果显示,CLDM对产气荚膜梭菌的抑菌作用在体内和体外都有较好的表现,但体内试验显示其与LCA协同作用后效果未见显着提升,TCN和TMS与LCA协同作用表现较好。CLDM作为一种被广泛应用于厌氧菌感染的抗生素类药物[38],对产气荚膜梭菌的抑制效果极为显着,虽然本试验中未与LCA表现出显着的协同作用,但其单独作用时的效果也值得关注。目前四环素类抗生素耐药广泛[39-40],出现了越来越多的耐药菌株,且TCN的毒性较强,残留引起极大危害[41],因此TMS的应用前景更加广泛,治疗产气荚膜梭菌感染在临床生产上的开发潜力更大,是一种值得关注的研究新方向,有待进一步发掘。
4 结 论
在治疗产气荚膜梭菌感染时,替米考星与甘草查尔酮A联合作用,可以降低药物使用量并提高治疗效果。



