康方圆,刘镇滔,吴奎显,倪 晗,钟 凯,李和平,杨国宇,韩立强*
(1.河南农业大学动物医学院 农业部动物生化与营养重点实验室,郑州 450046;2.河南牧业经济学院 河南省动物生长发育重点实验室,郑州 450046)
乳脂肪在乳中是以脂肪球的形式存在,研究发现脂肪球的粒径范围从200 nm到15 μm不等[1],并且脂肪球粒径能够影响乳品的营养价值和产品的下游加工[2]。乳脂肪球的粒径主要受到乳腺上皮细胞内脂滴大小的影响[3],因此,研究奶牛乳腺上皮细胞脂滴大小的调控对于阐明奶牛乳腺对脂肪球粒径的调控机制至关重要。
脂滴(lipid droplet,LD)是中性脂质的储存细胞器,它由一个中性的脂质核心组成,主要含有甘油三酯(triglyceride,TAG)和胆固醇酯(cholesteryl ester,CE),外面包裹着单层磷脂和各种相关蛋白[4]。在不同的细胞类型和代谢状态下,LD大小差异很大,受到多个复杂生物过程的调节,包括TAG合成、LD融合和自噬介导的LD降解等[5]。LD的合成和分解对于维持细胞能量和脂质稳态很重要。
自噬(autophagy)是一种细胞器的分解代谢途径,对细胞中受损或功能障碍的成分、蛋白和细胞器等通过溶酶体降解[6]。自噬是一个动态的、多步骤的过程,涉及自噬体的形成、自噬体与溶酶体融合形成、自噬溶酶体的降解[7]。近年来,一种被称为脂噬(lipophagy)的选择性自噬作为脂滴的分解和代谢途径受到了关注。大量自噬发生在对营养饥饿的反应中,而选择性自噬则针对特定货物进行降解。脂自噬是一种靶向脂滴的选择性自噬,调节脂质储存异常[8],例如在营养缺乏的情况下,游离脂肪酸在脂解酶的作用下从LD释放出来,并用作能量底物[9]。与此同时,饥饿还会引起一个细胞反应——诱导自噬,LDs可以与自噬小体结合,使其中的游离脂肪酸释放,这些脂肪酸还可以作为线粒体β型氧化的燃料[10]。脂噬被认为是一种选择性降解细胞脂滴的自噬途径,在模式动物的研究中发现,抑制脂自噬会增加脂滴的体积和数量[11],在小鼠中诱导脂自噬会减少脂滴的体积[12],然而脂噬对奶牛乳腺上皮细胞中的脂滴作用目前还未见报道。因此,本试验通过建立饥饿诱导乳腺上皮细胞脂滴自噬的模型,观察自噬对脂滴大小和数量的作用,为阐明奶牛乳腺上皮细胞脂滴的调控机制打下基础。
1 材料与方法
1.1 试验材料
奶牛原代乳腺上皮细胞(BMECs)为本实验室冻存保存;亚油酸(linoleic acid)和Alexa FluorTM488 goat anti-rabbit lgG(H+L)购自thermo scientific公司;高糖培养基(DMEM)和磷酸盐缓冲液(PBS)购自HyClone公司;优级胎牛血清购自四季青公司;牛胰岛素与氢化可的松购自Sigma公司;牛催乳素购自ProsPec公司;胰蛋白酶和DPBS购自Gibco公司;多聚甲醛固定液购自Servicebio公司;异丙醇购自MACRON公司;饱和油红O购自北京索莱宝公司;苏木素染液购自鼎国公司;全蛋白提取试剂盒和蛋白定量试剂盒购自康为世纪;10% PAGE凝胶快速制备试剂盒购自百奥曼;Omni-ECLTM超灵敏化学发光检测试剂盒购自雅酶公司;β-actin(66009-1-lg)、LC3B单克隆抗体(ab48394)购自abcam公司;P62/SQSTM1多克隆抗体(18420-1-AP)、HRP偶联的羊抗兔IgG抗体和HRP偶联的羊抗鼠IgG抗体购自Proteintech公司;抗荧光淬灭封片液购自碧云天公司;细胞爬片和24孔板购自NEST。
1.2 细胞培养
按照Han等[13]的方法分离和培养BMECs。从4~5岁的泌乳奶牛身上获取150 mg的乳腺组织,并立即运至实验室。用DPBS洗涤样品,并用镊子将样品转移到细胞培养皿中,温度37 ℃、5% CO2和95%空气。6 h后,加入5 mL基础培养基培养。随后,用0.25%胰蛋白酶富集上皮细胞,加入新鲜培养基培养贴壁细胞。同样方法连续纯化BMECs,取1×106个细胞·mL-1悬浮于冻存培养基中冻存。从-80 ℃冰箱取出冻存的细胞,在37 ℃水浴锅中快速融化,1 100 r·min-1离心4.5 min,弃上清,加入泌乳培养基[14]重悬细胞,在5% CO2和37 ℃培养箱中培养,待细胞密度达90%且生长状态良好时,用胰蛋白酶消化,加入等量的10% FBS中和,37 ℃、750 r·min-1离心4 min,使细胞悬浮,为后续试验提供细胞基础。
1.3 检测饥饿诱导脂噬后脂滴大小和数量
收集细胞瓶中处于对数期的细胞,用胰酶消化后加入1 mL培养基制成细胞悬液,计数,调整细胞浓度为5×105个·mL-1,在24孔板中以每孔500 μL接种。将24孔板置于37 ℃、5% CO2培养箱中继续培养;显微镜下观察细胞,待细胞融合度达到80%时,加入100 μmoL·L-1的LA亚油酸作用24 h后,将处理后的细胞换至无血清的DMEM培养基分别饥饿诱导0、6、12、24、48 h,取出细胞板,用PBS洗涤3次,用4%多聚甲醛固定液固定20~30 min,丢弃固定液,用PBS洗涤3次。加入60%异丙醇5 min,弃掉,然后加入新配制的油红O工作液(油红O∶水,3∶2)20~30 min,丢弃染色液,PBS洗涤2~5次,直到没有多余的染料溶液。加入苏木精染色液,细胞核重新染色1~2 min,丢弃染色液,洗涤2~5次,取出细胞爬片,置于载玻片上。密封后,在光学显微镜油透镜下拍照观察脂肪滴。每组选取3张染色细胞爬片,每张爬片选取3张图片,每张图片随机选取60个LD,使用Cell Sens软件测量直径。每幅图像测量完成后,将图像保存,并将测量结果输出到Excel表格中,用于后续分析脂滴的平均大小和分布比例。每张染色拍照的细胞选择3张图片,每张图片随机选择3个细胞,统计细胞周围脂滴的数量,计算细胞内脂滴的平均数量[15]。
1.4 饥饿诱导下脂滴蛋白表达的检测
饥饿诱导细胞不同时间后,收集细胞,使用康为世纪全蛋白提取试剂盒和蛋白定量试剂盒提取全蛋白,具体操作见说明书。定量完成后,SDS-PAGE凝胶电泳,随后使用PVDF膜湿转操作,室温封闭2 h,过夜4 ℃孵育特异性一抗β-actin、LC3和P62(1∶500稀释),回收一抗,洗膜5 min,5次,之后于室温孵育二抗1.5 h(1∶5000稀释),回收二抗,洗膜5 min,5次,最后用化学发光显色仪检测。
1.5 饥饿诱导下脂滴和自噬蛋白共定位
收集饥饿诱导24 h细胞,弃掉培养基,PBS清洗一遍,加500 μL多聚甲醛固定细胞,室温30 min后弃去,PBS清洗;加入500 μL,0.1% Tritonx-100通透细胞,10 min后弃去,PBS洗3遍;10% FBS(PBS配置)封闭1 h,夹出爬片,正面朝上,放于干净缠于封口膜的24孔板盖子上,室温孵育一抗;1 h后PBS清洗3遍,避光孵育二抗;1 h后PBS洗3遍,超纯水清洗3遍;Nile Red 脂滴染色15 min,PBS洗3遍;用DAPI染核,10 min后,PBS清洗3遍,超纯水清洗3遍;加入封片剂10 μL·片-1,过夜拍片。
1.6 透射电镜观察脂滴自噬
细胞饥饿处理24 h后,收集细胞样品,倒掉所有培养基,加入1 mL新鲜的培养基,放入CO2培养箱,37 ℃,5 min;用细胞刮一次到底刮下来,收集到2 mL圆底EP管内,先加入100 μL固定液(2.5%戊二醛),预固定;2000 r·min-1,吸净上清液,沿壁加入2 mL固定液。接下来按如下顺序操作:2.5%戊二醛(4 h)→PBS漂洗(10 min×4次,每次需要吹打、离心800 r·min-1×3 min)→1%锇酸(2 h)→PBS漂洗(10 min×4次,每次需要吹打、离心800 r·min-1×3 min)→50%乙醇(10 min吹打、离心800 r·min-1×3 min)→70%乙醇10 min吹打、离心800 r·min-1×3 min)→80%乙醇(10 min吹打、离心800 r·min-1×3 min)→95%乙醇(10 min吹打、离心800 r·min-1×3 min)→100%乙醇(10 min×2次,每次吹打、离心800 r·min-1×3 min)→100%丙酮(10 min×2次,每次需要吹打、离心800 r·min-1×3 min)→环氧树脂812:丙酮(1∶1,2 h;2∶1,2 h)→环氧树脂812(过夜)→聚合37 ℃,2 h→45 ℃,12 h→60 ℃,24 h→半薄切片定位、超薄切片→饱和醋酸双氧铀水溶液染色(20 min)→水洗→烘干→柠檬酸铅溶液染色(5 min)→水洗→烘干→电镜观察拍照。
1.7 数据统计
使用SPSS 21统计分析数据,结果表示为“平均数±标准差”,Prism软件作图,所有数据至少3个重复,采用单因素方差分析和T检验进行显着性分析,P<0.05被认为有显着差异。
2 结 果
2.1 饥饿诱导脂噬对脂滴大小和数量的影响
饥饿诱导后通过油红O对细胞脂滴染色(图1A),并对脂滴直径测量,统计分析,发现饥饿处理24 h后,脂滴的平均直径从1.57 μm增加到2.12 μm(图1B),每个细胞脂滴的平均数量显着减少,从39减少到24(图1C),经统计分析大脂滴的比例从4.82%增加到16.29%,小脂滴的比例从18.33%减少至5.37%(P<0.05,图2)。
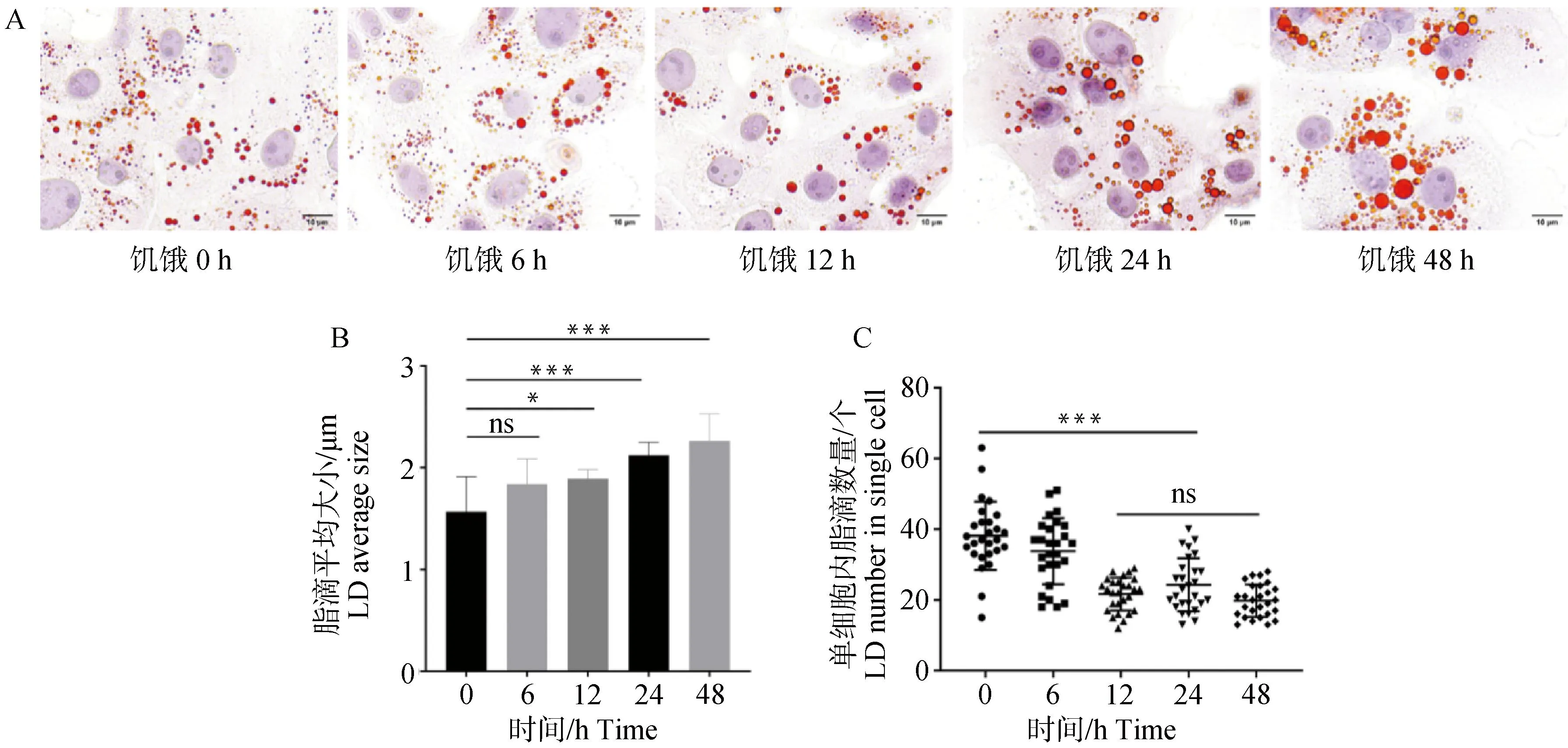
A.油红O染脂滴;B.脂滴的平均尺寸;C.每个细胞脂滴的平均数量。* P<0.05,** P<0.01,*** P<0.001,**** P<0.000 1,下同A. Oil Red O stained lipid droplets; B. Average size of lipid droplets; C. Average number of lipid droplets per cell. *. P<0.05, **. P<0.01, ***. P<0.001, ****, P<0.000 1, the same as below
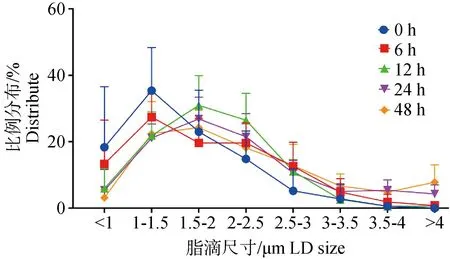
图2 不同饥饿时间对脂滴分布比例的影响Fig.2 Effect of different starvation times on the proportion of lipid droplet distribution
2.2 LD和LC3蛋白的共定位
饥饿24 h后通过免疫荧光染色发现,自噬蛋白LC3定位在脂滴上,脂滴与LC3点状共定位显着增强,这一结果表明饥饿诱导下乳腺上皮细胞自噬被激活(图3)。
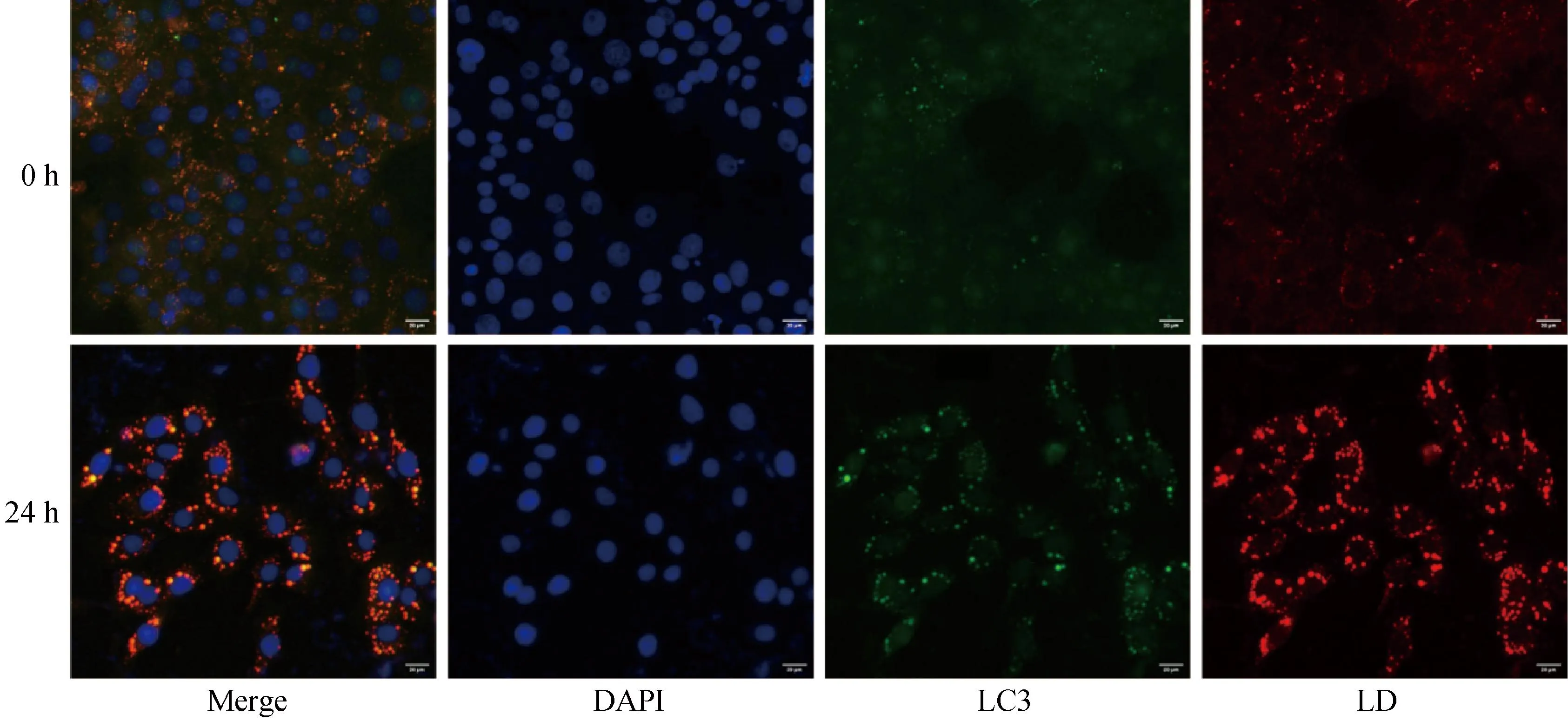
红色为脂滴,蓝色为细胞核,绿色为LC3。标尺=20 μmLipid droplets are shown in red, nuclei in blue, and LC3 in green. Bar=20 μm
2.3 透射电镜观察脂滴自噬
通过透射电镜观察,饥饿0 h时,细胞核周围有着尺寸大小不一的脂滴,很少有自噬体的存在,在饥饿处理24 h后,可以观察到细胞核周围存在较多的自噬溶酶体,并且自噬溶酶体包裹着脂滴,表明细胞发生脂噬(图4)。
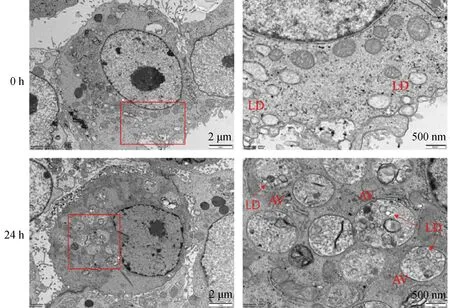
LD. 脂滴;AV. 自噬溶酶体。右列图是左列图方框内的局部放大LD. Lipid droplets; AV. Autolysosome. The image on the right is a partial enlargement of the square in image on the left
2.4 饥饿诱导对自噬蛋白表达的影响
在饥饿0、6、12、24和48 h后,Western blot检测自噬蛋白LC3和P62蛋白的表达,发现饥饿24 h后,LC3Ⅱ/LC3Ⅰ的比值显着增加,与0 h相比,饥饿24 h时LC3Ⅱ/LC3Ⅰ比值显着增加1倍,P62蛋白表达下调26%(图5)。
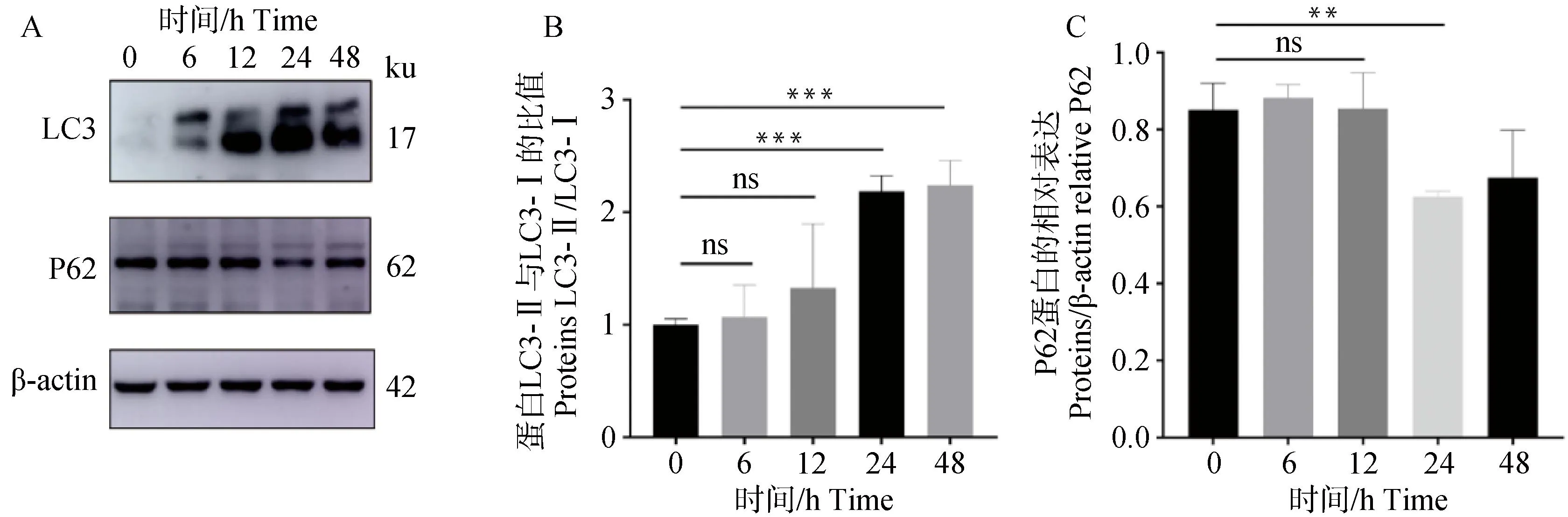
图5 不同饥饿时间对自噬相关蛋白表达的影响(n=3)Fig.5 Effect of different starvation times on the expression of autophagy-related proteins (n=3)
3 讨 论
在体外培养的乳腺上皮细胞中,无血清培养的环境下,脂滴生成数量很少。本团队前期试验发现,加入亚油酸刺激后,随着LA浓度的增加会刺激脂滴蓄积,综合细胞活力和脂滴蓄积的结果(数据未显示),本研究选择100 μmol·L-1的LA刺激细胞引起脂滴蓄积。
自噬的作用是降解细胞内的细胞器、细胞质和蛋白质[16]。在哺乳动物系统中,用于识别自噬的关键生物学标记是构成自噬体膜的微管相关蛋白1A/1B轻链 3 (LC3)。在自噬过程中,胞质LC3-Ⅰ与磷脂酰乙醇胺偶联形成LC3-Ⅱ,然后LC3-Ⅱ被并入自噬体膜,另一个广泛使用的自噬流标志物是自噬受体sequestosome 1 (p62/SQSTM1 ),它在物理结构上将自噬货物与自噬膜连接起来[17]。研究发现,饥饿处理会诱导细胞自噬,在饥饿动物的肝切片中,脂滴上LC3阳性的表达增加[18]。本试验通过免疫荧光发现自噬蛋白LC3B定位在了脂滴上,表明在饥饿诱导下,脂滴发生了自噬。脂噬作为一种选择性自噬,主要针对脂滴自噬[19]。本试验通过透射电镜观察,饥饿24 h后细胞内形成自噬溶酶体,并且自噬溶酶体中包裹有脂滴,这一结果表明饥饿诱导的自噬属于脂噬。
饥饿处理奶牛乳腺上皮细胞后,蛋白免疫印迹发现,随着饥饿诱导时间的增加,自噬蛋白LC3-Ⅱ 显着增加,P62蛋白降解。进一步油红O染色发现,饥饿处理后大脂滴比例显着增多,小脂滴比例显着减少,脂滴平均大小显着增加,脂滴数量显着减少,表明饥饿诱导的脂噬影响了奶牛乳腺上皮细胞中脂滴的大小和数量。其他研究也发现,脂噬广泛参与了储存在LD中的脂质的动员[20]。对自噬缺陷肝组织的油红O染色显示,与对照小鼠相比,脂滴的数量和大小显着增加[21]。其他报道表明,自噬也可以通过在营养有限的条件下促进LD的合成来上游作用于脂肪分解[22]。有研究发现,与线粒体自噬相类似,LD的脂噬是由一种基于大小的机制启动的,该机制依赖于LD达到一定的适度直径[23-24]。脂噬对脂滴大小选择性的具体机制还不清楚,可能与LD单层本身具有独特的生物物理特性有关[25-27]。
乳脂肪是牛乳中的主要成分,在牛乳中主要以乳脂肪球的形式存在,脂滴是合成乳脂肪球的前体,本研究在体外乳腺细胞中发现脂噬对脂滴大小具有调控作用,那么脂噬是否能够在体影响奶牛乳腺组织合成乳脂肪还有待进一步研究。
4 结 论
本研究发现,经饥饿处理后奶牛乳腺上皮细胞发生脂噬,引起脂滴平均直径显着增加,为深入研究奶牛乳腺上皮细胞脂滴大小调控机制提供了理论基础。



