李芃绪,李世景,孙 骏,项 维,赵苗苗,侯天牧,李华明,广 敏,陈瑞格,徐梦然,吴晓敏,姜合祥,雷连成,,张付贤*
(1.长江大学动物科学技术学院,荆州 434023;2.吉林大学动物医学学院,长春 130062)
猪链球菌(Streptococcussuis,SS)是一种重要的革兰阳性人畜共患病原菌,在世界各地广泛分布,可通过侵入黏膜和伤口等途径感染牛、马、狗和鱼等多种动物和人[1-2]。基于不同的荚膜多糖抗原,SS目前主要被分为29个血清型;感染猪的SS血清型主要是1~9型、1/2型和14型,亚洲主要流行血清型2、3和4等,血清型9主要在欧洲流行[3-6]。多序列位点分型(multilocus sequence typing,MLST)也常被用于猪链球菌的分类依据,目前已超过1 000个STs 被鉴定[7]。在已报道的猪链球菌感染病例中,猪链球菌2型(Streptococcussuisserotype 2,SS2)是临床分离比例最高、也被认为是毒力最强的血清型。SS2在感染人和猪时具有感染率高、发病急、感染宿主可导致不可逆转的后遗症等特点,其在严重危害我国养猪业发展的同时,也给公共卫生安全带来了潜在的巨大威胁[4-5]。
SS2通常定植在被感染猪的呼吸道、扁桃体等部位,通过口鼻感染、接触传播,引起败血症、心内膜炎,关节炎和脑膜炎等病症,严重的可引发脑膜炎、败血症甚至致死[8-9];近年来从临床上人和猪感染SS2病例中,脑膜炎型猪链球菌病的比例有明显上升趋势[10-11]。但是临床的病例,鲜见对猪源致脑膜炎SS2进行MLST分子分型鉴定,以及致病性和耐药性系统性研究的报道。本研究从湖北某养殖场患呼吸道病猪的脑组织中分离到一株SS2,命名为PX0923。通过MLST对其进行分型鉴定,结合致病性、生物被膜形成能力和抗生素、中药敏感性分析系统性研究分离菌株的生物学特性,为进一步探究SS2的致脑膜炎机理和临床上SS2感染的防控、精确诊断和有效治疗提供理论依据。
1 材料与方法
1.1 试剂和中药药材
牛脑心浸出液(BHI)培养基、琼脂粉等购自国药基团化学试剂有限公司;胰酪胨大豆羊血琼脂购自青岛高科技工业园海博生物技术有限公司;细菌基因组提取试剂盒,病毒基因组提取试剂盒购自天根生化科技(北京)有限公司;DL2000 DNA Marker购自北京聚合美生物科技有限公司;革兰氏染色剂购自北京索莱宝生物科技有限公司;Taq酶购自上海碧云天生物技术有限公司;抗生素药敏片均购自杭州微生物试剂有限公司;实验所使用相关引物均由生工生物工程(上海)股份有限公司合成。
33种中草药:羌活、苏子、板蓝根、罗汉果、桑皮、桔梗、丁香、金银花、胖大海、天竹黄、川贝母、连翘、鱼腥草、半夏、鹤藤、秦皮、朱砂、大青叶、黄连、炒僵蚕、黄芩、槟榔、蒲公英、灸白附子、五倍子、荆芥、款冬花、薄荷、乌梅、熟大黄、三七、菊花和全蝎,以上中药均购自南京同仁堂大药房。
1.2 病例描述
2021年12月至2022年2月,湖北某生猪养殖场,部分仔猪出现精神沉郁、气喘、呼吸困难肌肉抽搐和后肢震颤、滑动等临床表现。剖检病死猪,可见胸腔和腹腔积液,肺脏充血水肿,脾脏出血,脑膜明显充血、出血。使用抗生素庆大霉素和卡那霉素的治疗效果不理想,反复用药后病情不稳定。
1.3 病原检测
无菌条件下解剖病死猪,采集病猪的肺、肝、脑和脾等病变组织(约200 mg)于RNase free的1.5 mL EP管中研磨加无菌PBS匀浆,使用细菌与病毒基因提取试剂盒提取样品的基因组。合成的猪常见呼吸道疾病病原:猪圆环病毒2型(PCV2)、副猪嗜血杆菌(HPS)、多杀性巴氏杆菌(Pm)和胸膜肺炎放线杆菌(APP)的特异性引物[12-13]以及用于扩增猪链球菌gdh基因和recN基因的特异性引物[14](表1),使用反转录试剂盒反转录病毒RNA,以细菌和病毒DNA以及反转录产物作为病原检测模板,采用20 μL PCR扩增反应体系: DNA模板1 μL,上下游引物(10 μmol·L-1)各0.5 μL,2×Taq PCR Master Mix酶 10 μL,ddH2O 8 μL。PCR的扩增条件:95 ℃预变性5 min;95 ℃变性30 s,退火1 min,72 ℃延伸30 s,循环数34;72 ℃终延伸10 min。扩增产物经1.5% 琼脂糖凝胶电泳,120 V电泳30 min。

表1 PCR鉴定猪常见病原的引物序列
1.4 细菌分离和鉴定
取病猪的脑组织划线接种于含5% 胎牛血清的BHI固体培养基中,于37 ℃恒温培养箱中培养18 h。根据病原检测结果按细菌形态挑选可疑菌落再次PCR鉴定,按照鉴定结果挑取可疑菌落纯化3代,观察其菌落形态。取纯化3代后的疑似猪链球菌菌落涂板并进行革兰染色,在光学显微镜下观察其形态特征。收集纯化后的疑似猪链球菌菌液,无菌PBS清洗3次后,弃液,使用2.5%戊二醛重悬并于4 ℃冰箱中固定过夜,ddH2O清洗3次后冷冻干燥,在扫描电镜下观察其形态。
1.5 病原菌的16S rRNA基因测序以及系统进化树的构建
根据病原检测以及形态学观察结果取纯化三代后的疑似猪链球菌菌落,以细菌16S rRNA基因通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′与1492R:5′-TACGCTACCTTGTTACGACTT-3′进行PCR扩增。采用50 μL反应体系:DNA模板1 μL;2×Taq PCR Master Mix酶25 μL,上、下游引物(10 μmol·L-1)各1 μL,ddH2O 22 μL。扩增条件:95 ℃预变性5 min;95 ℃变性30 s,50 ℃退火1 min,72 ℃延伸30 s,循环数34;72 ℃终延伸10 min。PCR产物经1.5% 琼脂糖凝胶电泳后,目的条带切胶回收送武汉生物工程有限公司测序。测序结果使用NCBI BLAST网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对分析。选取与分离菌株同源性强且为猪链球菌属的其他菌株16S rRNA基因序列,通过Mega.11软件的MUSCLE功能对多重序列进行对齐排列,并使用邻接法(Neighbor-Joining)构建分离菌株基于16S rRNA基因的系统进化树,Bootstrap 1 000次检查进化树可信度,在ITOL网站(https://itol.embl.de/)构建系统进化树。
1.6 病原菌的血清型鉴定
合成针对谷氨酸脱氢酶基因(glutamic acid dehydrogenase,gdh)的引物(表2),根据PCR产物大小鉴别猪链球菌的血清型[15-16]:如果条带为575 bp,表明分离菌株是2型或1/2型;条带为440 bp,表明分离菌株为1型或14型;条带为250 bp,表明为7型;条带为390 bp,表明分离菌株为9型。鉴于普通PCR无法区分血清2型和血清1/2型,也无法区分1型和14型,采用基于聚合酶链式反应限制性片段长度多态性(PCR-restriction fragment length polymorphism, RCR-RFLP)的cpsK基因多态性检测方法进行鉴别[17];合成SS2荚膜抗原基因簇cpsK的特异性引物(表2),以提取的分离菌株的基因组为模板进行PCR,扩增产物以限制性核酸内切酶BstNⅠ进行酶切,酶切产物经1.5% 琼脂糖凝胶电泳。判定标准:如果酶切后仅出现大小为486 bp的一条带,则表明分离菌株血清型为1/2型或1型;如果酶切产物出现大小为347 bp与139 bp的两条带,则表明分离菌株的血清型为2型或14型;综合上述两种方法判定分离菌株的血清型。

表2 PCR鉴定分离株血清型引物的序列
1.7 Multilocus sequence typing (MLST)分析
检索MLST数据库网站(https://pubmLst.org/organisms/streptococcus-suis)合成用于扩增猪链球菌的7个管家基因aroA、cpn60-L、dpr、gki、mutS、recA和thrA的引物[18],PCR反应产物进行测序,将测序结果上传至MLST数据库中查找等位基因的编号,进而确定分离菌株的 ST 型别,并利用PHYLOViZ Online网站(https://online.phyloviz.net/index)对猪链球菌的ST 型进行分组和聚类,绘制MLST最小生成树。
1.8 致病性试验
1.8.1 毒力基因检测 合成猪链球菌的8种毒力基因:细胞外蛋白因子(extracellular protein factor,EPF),溶菌酶释放蛋白(muramidase-released protein,MRP),溶血素(suilyin,SLY),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),表面膜蛋白(fibronectin binding proteins,FBPS),orf2,sao和89K的特异性引物[19-20],以及与猪链球菌2型的毒力相关基因簇nmt的引物nadR、pnuC、nutT[21](表3),以提取的分离株的DNA为模板,PCR扩增产物经1.5% 琼脂糖凝胶电泳。
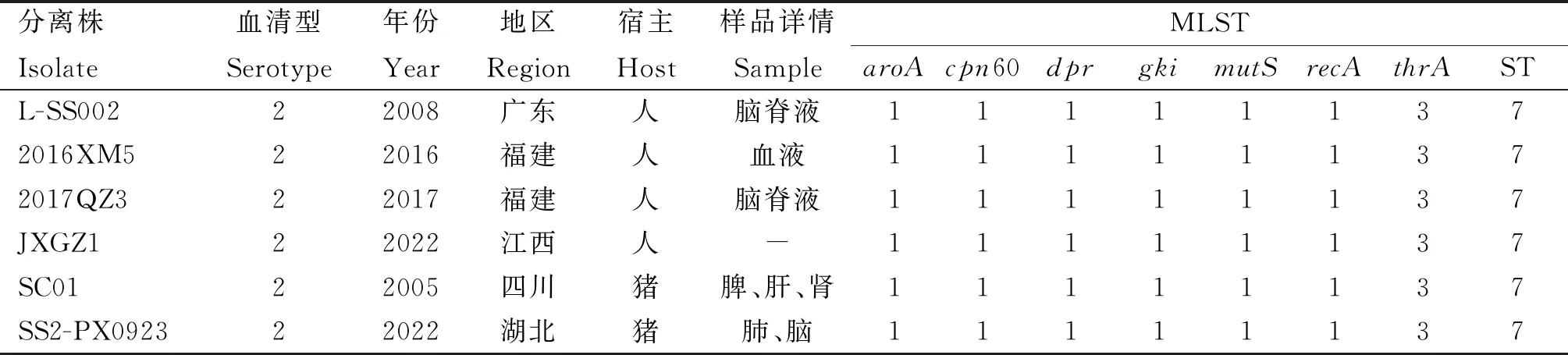
表3 ST7型猪链球菌的部分信息
1.8.2 溶血性试验 取分离株纯培养物,用接种环划线接种于胰酪胨大豆羊血琼脂平板上,37 ℃孵育48 h后观察平板的溶血情况,分析分离株产生溶血素的能力。
1.8.3 小鼠感染试验 健康SPF昆明系雄性小鼠60只,体重25 g±1.8 g,购自湖北宜昌三峡大学实验动物中心;暂养3 d,检测确认无特定病原后用于人工感染试验。挑取分离菌株培养至对数生长期(OD600 nm=0.6,5 h),进行梯度稀释和活菌计数后,4 000 r·min-1离心10 min收集菌体,用无菌PBS重复洗涤3次,最后以无菌PBS重悬调整至攻毒浓度:4.3×1010、4.3×109、4.3×108、4.3×107、4.3×106CFU·mL-1。将小鼠随机分为6组,每只腹腔注射0.5 mL菌液,对照组腹腔注射同体积无菌PBS。攻毒后连续观察7 d,记录显着的临床症状和死亡情况,根据改良寇氏法统计分离菌株的 LD50[22]。解剖死亡小鼠,采集死亡小鼠的病变组织,进行致病菌的分离和鉴定;无菌条件下采集死亡小鼠的心、肝、脾、肺、肾和脑,匀浆后以平板法统计组织细菌载量;固定具有典型病变的脑、肺、肝组织,制成石蜡切片后镜检观察。
1.9 耐药性试验
1.9.1 生物被膜形成能力测定 采用刚果红琼脂培养基法分析分离菌株是否有形成生物被膜的能力[23]。以大肠杆菌O157作为质检菌,检测刚果红琼脂实验的有效性;取10 μL对数生长期的菌液,均匀滴在刚果红琼脂上,37 ℃恒温培养24 h后观察菌落形态。如果菌落形态呈锯齿状或光滑的白色则表明菌株缺乏胞外多糖基质和纤维蛋白的生成,没有生成生物被膜的能力;如果菌落形态为红色或黑色、干燥且边缘卷曲则说明菌株形成胞外多糖基质和纤维蛋白较多,具有生成生物被膜的能力。同时以结晶紫染色法来定量测定分离菌株形成生物被膜的能力。取200 μL对数期的菌液加入96孔细菌培养板,37 ℃恒温培养48 h后弃去培养基,加入200 μL 4%多聚甲醛固定15 min,清洗风干后加入200 μL 0.1%结晶紫室温染色10 min,经无水乙醇脱色后使用酶标仪测定每孔的OD570 nm值。依据ODc的值(ODc的值为对照组OD570 nm的平均值)判定分离菌株生物被膜形成能力:OD≤ODc,为无成膜能力;ODc
1.9.2 耐药基因检测 合成针对各种抗生素耐药基因的引物[24-29]:四环素的tetC、tetM、tetA基因,氟喹诺酮的grvA、grvB基因,红霉素的ermF、ereD基因,氨基糖苷类的aadA1、aadB基因,磺胺类的sul1、sul2基因,β-内酰胺类的bla-IMP、bla-TEM、bla-SHV、bla-CTX、bla-OXA、bla-DHA、β-KPC、β-HDM基因,林可霉素的1nuH基因,PCR的方法来筛查分离株耐药基因携带情况。
1.9.3 抗生素敏感性试验 采用Kirb-Bauer(K-B)纸片扩散法分析分离菌株对不同抗生素的敏感性。在以金黄色葡萄球菌ATCC25923验证药敏片的有效性后,取分离纯化后菌株的纯培养物均匀涂布在BHI琼脂平板上,将抗生素药敏片分别贴在培养基标记处,于37 ℃恒温培养箱中培养24 h。测量形成抑菌圈的直径,药敏试验重复3次,根据抑菌圈直径大小判断分离菌株对药物的敏感程度。
1.9.4 中药抑菌和最小抑菌浓度(minimal inhibit concentration,MIC)的测定 分别称取中草药,以煎煮法制备终浓度为1 g·mL-1的中药药液,经121 ℃、灭菌20 min,4 ℃保存备用。将空白药敏纸片浸泡在中药药液中,待浸透后风干备用。取对数生长期的分离菌株涂布平板,将含中药的纸片均匀贴在平板上,并以含抗生素的药敏片作为对照;37 ℃ 静置培养 24 h,分别测量抑菌圈直径;试验重复3次,计算平均值,评估分离菌株对中药药液的敏感性;以96孔板微量稀释法测定待测中草药对分离菌株的MIC[30]。
2 结 果
2.1 病原的分离和鉴定
病猪组织的病原筛查PCR结果显示,病料中胸膜肺炎放线杆菌、多杀巴氏杆菌、猪圆环病毒2型、副猪嗜血杆菌均为阴性,猪链球菌的gdh基因和recN基因的检测均呈阳性反应,且条带大小与阳性模板所扩增出的条带大小一致(图1A),判定该猪场病猪疑似由猪链球菌感染引起。革兰染色结果表明,分离菌株为革兰阳性菌,多为成对或成链状排列的菌体(图1B);在平板上可见灰白色边缘整齐的圆形菌落(图1C);扫描电镜下,分离菌株似卵圆形或短杆状,呈链状平行延伸(图1D);分离菌株的形态及生长特性与《伯杰氏细菌鉴定手册》中猪链球菌的特性相符。将16S rRNA引物所扩增出的1 500 bp左右大小的条带进行测序,基因序列进行同源序列比对分析结果如图1E所示,在系统进化树中分离株与三株猪链球菌(115737.1、038918.1和117504.1)汇成一支,亲缘关系最近;与2型猪链球菌S735(GenBank No.:NR 036918.1)相似性达到99%以上,基因序列的相似性最高;结合分离菌株的形态、生理生化结果,确定分离菌株为猪链球菌,命名为PX0923。
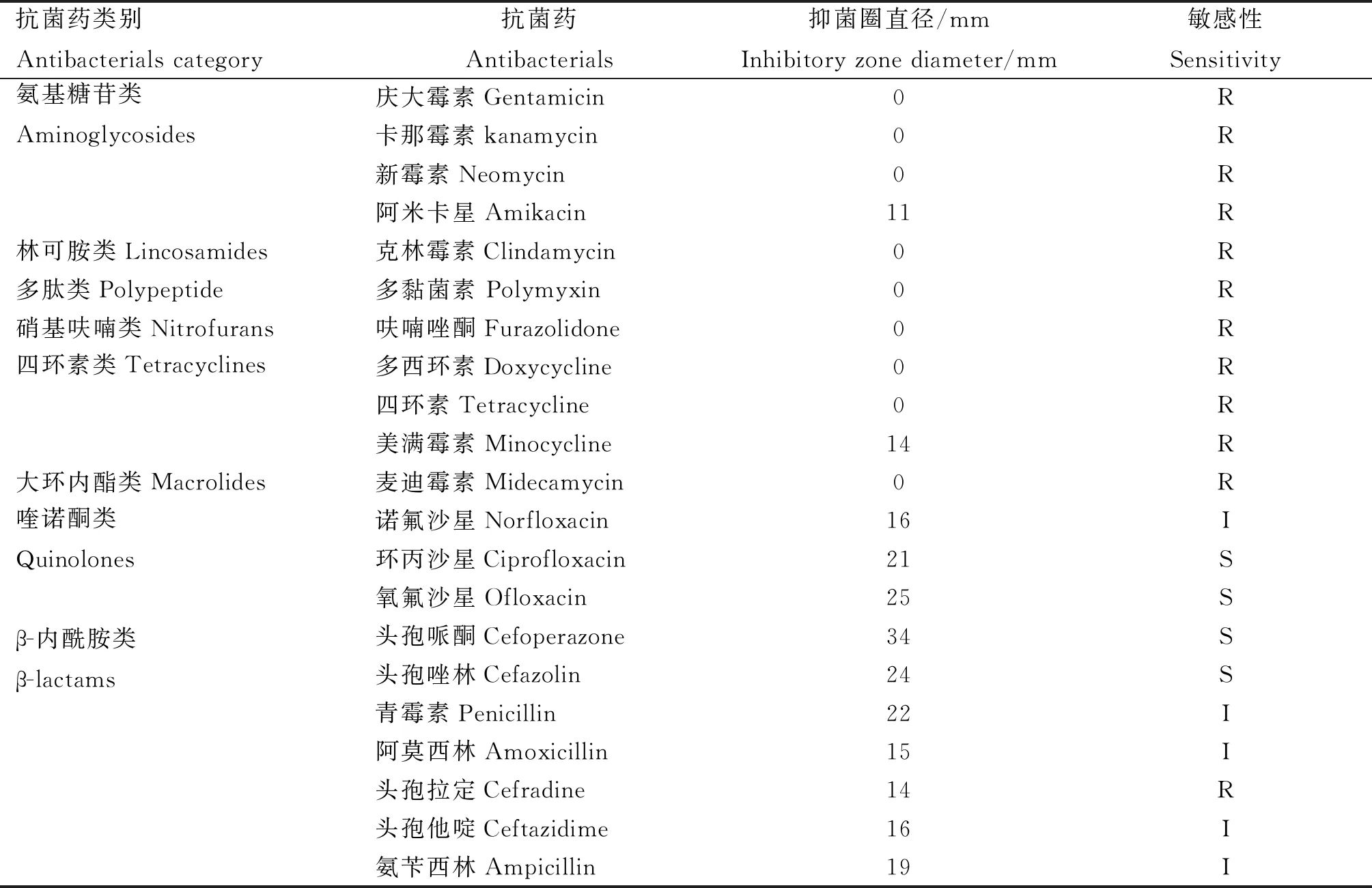
表4 分离菌株的药敏试验结果
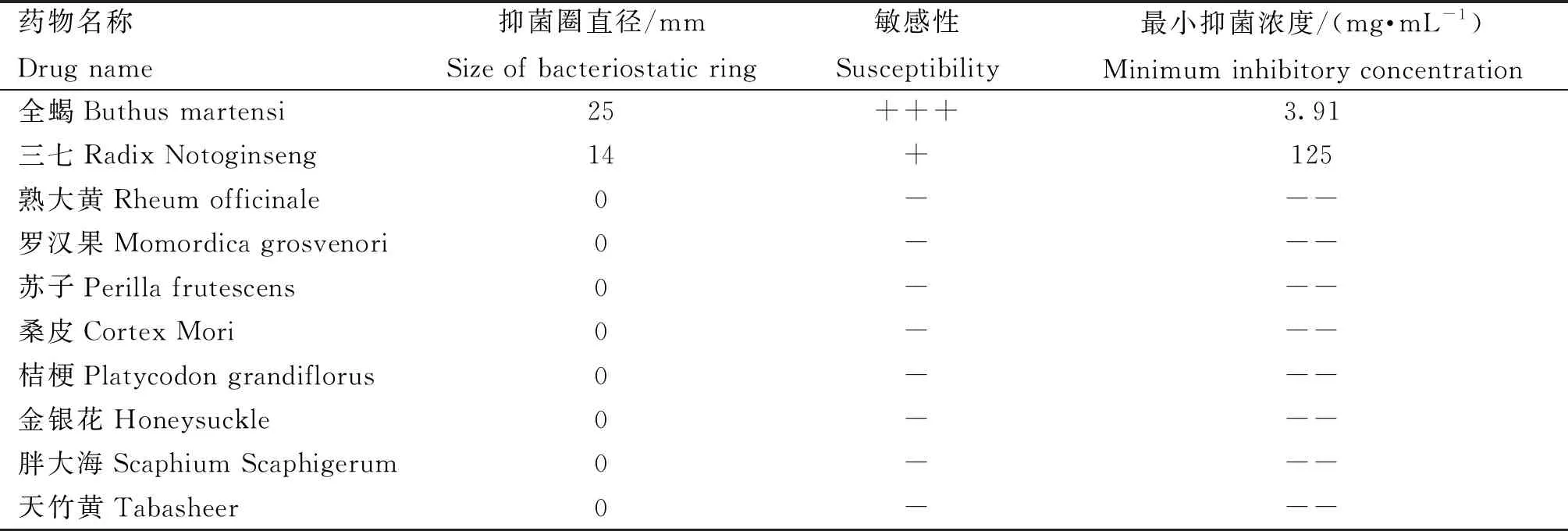
表5 中药抑菌结果
2.2 猪链球菌的血清学鉴定
血清型鉴定的PCR结果如图2A所示,以PX0923基因组为模板,gdh的引物扩增出575 bp左右的条带,表明分离菌株PX0923为猪链球菌血清2或1/2型,排除14型;cpsK的特异性引物扩增出486 bp的条带,酶切后电泳呈现出大小为347 bp与139 bp的两条带(图2B),表明分离菌株的血清型为2型或14型;综合上述两种血清型鉴定结果,判定猪链球菌PX0923的血清型为2型。
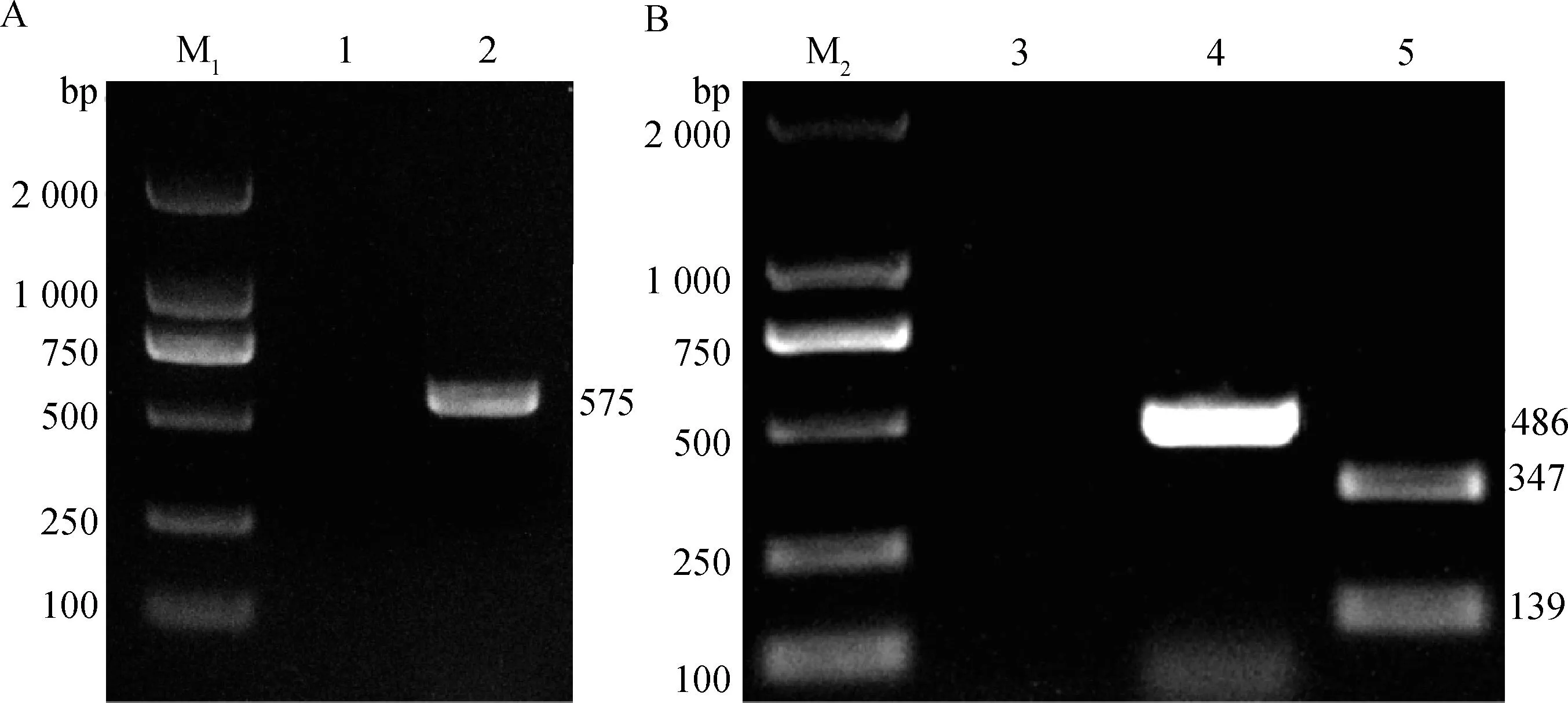
A. gdh基因扩增结果(M1. DL2000 DNA相对分子质量标准;1. gdh基因阴性对照;2. 分离菌株);B. PCR-RFLP结果(M2. DL2000 DNA相对分子质量标准;3. cpsK基因阴性对照;4. PCR结果;5. BstNⅠ酶切结果)A. gdh gene amplification results (M1. DL2000 DNA marker; 1. gdh gene negative control; 2. Isolated strain); B. PCR-RFLP results (M2. DL2000 DNA marker; 3. cpsK gene negative control; 4. PCR result; 5. Digestion result by BstNⅠ)
2.3 MLST分型
对分离株PX0923的管家基因(aroA、cpn60-L、dpr、gki、mutS、recA、thrA)进行测序, 结果上传至MLST网站,7个等位基因的编号分别为1、1、1、1、1、1、3,确定PX0923属于ST7型猪链球菌。数据库中ST7型猪链球菌株主要分布在中国,宿主为人和猪(表3)。在MLST数据库中下载186个菌株信息包括166种ST型别,使用 PHYLOViZ 软件对猪链球菌进行分组聚类分析,结果如图3 所示,ST7型与ST1型猪链球菌(ID:3150)汇聚为一支,二者具有较近的亲缘关系。
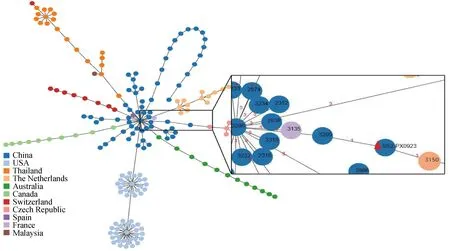
图3 MLST分析Fig.3 MLST analysis
2.4 致病性分析
2.4.1 毒力基因检测结果 根据各对毒力基因引物的扩增结果显示,分离株PX0923携带有7种毒力基因:epf、mrp、sly、gapdh、fbps、orf2和sao,其毒力基因型为:epf+/mrp+/sly+/gapdh+/fbps+/orf2+/sao+/89K-(图4A);与此同时,PX0923的nadR、pnuC和nutT基因均扩增出相应条带,表明PX0923同时携带有猪链球菌2型特有的nmt毒力基因簇,进一步确定分离株PX0923为猪链球菌2型,且PX0923可能具有一定的致病性。
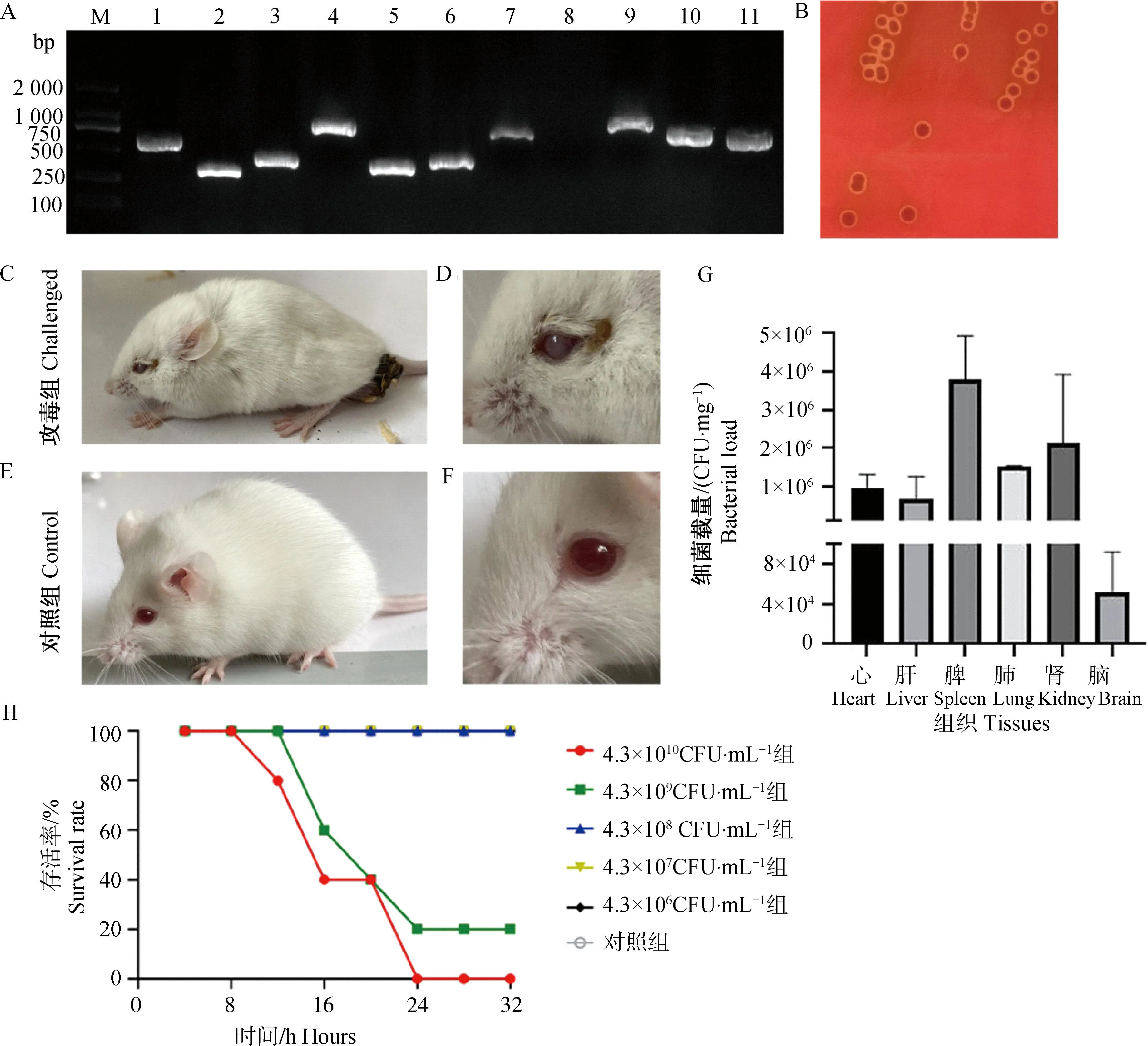
A. 分离株毒力基因与毒力基因簇的筛查结果(M. DL2000 DNA相对分子质量标准;1. epf;2 mrp;3. sly;4. orf;5. gapdh;6. fbps;7. sao;8.89K;9. nadR;10. pnuC;11. nutT);B. 血平板溶血试验结果;C. 攻毒组小鼠状态;D. 攻毒组小鼠眼部;E. 对照组小鼠状态;F. 对照组小鼠眼部;G. 组织细菌载量;H. 存活曲线A. Screening results of virulence genes and virulence gene cluster of isolates (M. DL2000 DNA marker; 1, epf; 2. mrp; 3. sly; 4. orf; 5. gapdh; 6. fbps; 7. sao; 8. 89K; 9. nadR; 10. pnuC; 11. NutT); B. Blood plate hemolysis test results; C. The status of mice in the challenged group; D. Eyelids of mice in the challenged group; E. The status of mice in the control group; F. The eyelids of control group mice; G. Tissue bacterial load; H. Survival curve
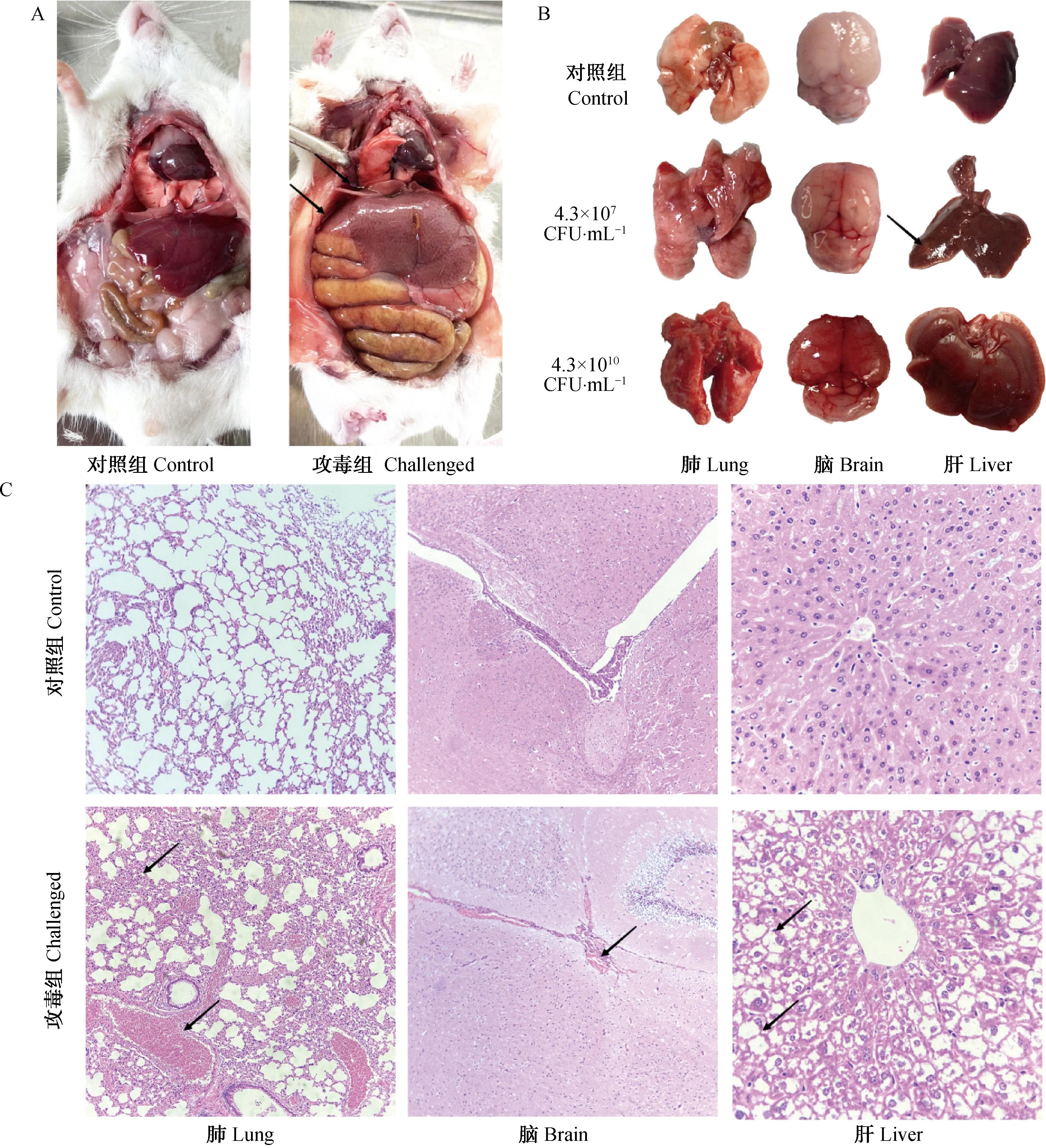
A. 对照组与攻毒组(4.3×1010CFU·mL-1)腹腔与胸腔观察;B. 对照组、低剂量组(4.3×107CFU·mL-1)和高剂量组(4.3×1010CFU·mL-1)肺、脑和肝观察;C. 对照组与攻毒组(4.3×1010CFU·mL-1)肺(100×)、脑(100×)和肝(400×)组织切片观察A. Control group and drug attack group (4.3×1010CFU·mL-1) observation of abdominal and thoracic cavities; B. Observation of the lung, brain, and liver in the control group, low-dose group (4.3×107CFU·mL-1), and high-dose group (4.3×1010CFU·mL-1); C. Observation of lung (100×), brain (100×), and liver (400×) tissue sections in the control group and the attack group (4.3×1010CFU·mL-1)
2.4.2 溶血性试验结果 分离株PX0923在绵羊血平板上37 ℃培养48 h后,在菌落周围形成直径0.5 ~1 mm、草绿色的圆形溶血环(图4B),该区域红细胞未完全溶解,呈现出α型溶血的典型特点,表明分离菌株PX0923在绵羊血平板上具有α溶血活性。
2.4.3 回归试验结果 攻毒12 h后,4.3×1010CFU·mL-1攻毒组小鼠出现明显的精神沉郁、被毛凌乱,肛门处出现粪便黏着(图4C),眼睑有黏性分泌物(图4D);攻毒24 h后,对照组小鼠精神状态正常,未出现死亡(图4E、F);4.3×1010CFU·mL-1攻毒组小鼠全部死亡,4.3×109CFU·mL-1攻毒组共计死亡小鼠8只;其他攻毒组小鼠出现轻微的临床症状,未见小鼠死亡(图4H);经统计,分离株PX0923的LD50为1.08×109CFU·小鼠-1。从死亡小鼠的肝、脾、肺、肾和脑组织中分离出致病菌,经鉴定为攻毒菌株PX0923,对照组中未发现攻毒菌株;死亡小鼠心、肝、脾、肺、肾和脑的组织菌载量分别为9.35×105、6.48×105、3.81×106、1.53×106、2.14×106和5.28×104CFU·mg-1,其中脾中的组织载量最高(图4G),表明PX0923具有一定的组织嗜性。
剖检死亡小鼠,发现其腹腔、胸腔内有大量淡红色液体,4.3×107CFU·mL-1组与4.3×1010CFU·mL-1组小鼠的肺和脑组织均出现不同程度的出血,4.3×107CFU·mL-1组小鼠肝上出现白色干酪样病变,4.3×1010CFU·mL-1组呈现黄白相间的花纹样肝(图5A、B)。病理组织学观察发现,攻毒组小鼠肺泡壁增厚且肺泡囊中充满红细胞;软脑膜充满大量红细胞;肝细胞发生脂肪变性,胞质呈现空泡状且细胞核偏向一侧(图5C),表明感染分离菌株PX0923具有一定的致病性,可导致小鼠脑膜炎、肺和肝等组织严重的损伤。
2.5 耐药性分析
2.5.1 生物被膜形成能力 大肠杆菌O157在在刚果红琼脂上生成灰白色、边缘锯齿状的菌落(图6A),表明大肠杆菌O157没有生成生物被膜的能力,证明刚果红琼脂有效。如图6B所示,分离株PX0923在刚果红琼脂上形成了暗红色且边缘卷曲、隆起、干燥的菌落,表明分离株PX0923具有生成生物被膜的能力。结晶紫染色试验显示,在无水乙醇脱色后测得分离株PX0923组OD570 nm的平均值为0.406,对照组OD570 nm的平均值为0.167(图6C),判定分离菌株PX0923具有中等成膜能力。
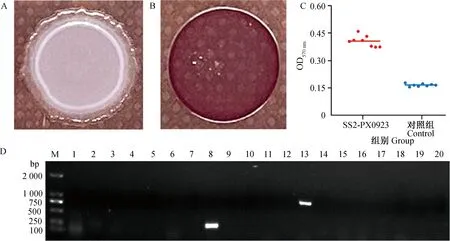
A. 大肠杆菌O157在刚果红琼脂平板上的菌落形态;B. 分离株PX0923在刚果红琼脂平板上的菌落形态;C. 结晶紫试验结果;D. 分离株耐药基因筛查结果(M. DL2000 DNA相对分子质量标准;1. tetC;2. tetM;3. tetA;4. gryA;5. gryB;6. ermF;7. ereD;8. aadA1;9. aadB;10. sul1;11. sul2;12. bla-IMP;13. bla-TEM;14. bla-SHV;15. bla-CTX;16. bla-OXA;17. bla-DHA;18. β-KPC;19. β-HDM;20. lnuH)A. Colony morphology of Escherichia coli O157 on Congo red agar plate; B. Colony morphology of the isolated strain on Congo red agar plate; C. Results of crystal violet experiment; D. Screening results of drug resistance genes in strain (M. DL2000 DNA marker; 1. tetC; 2. tetM; 3. tetA; 4. gryA; 5. gryB; 6. ermF; 7. ereD; 8. aadA1; 9. aadB; 10. Sul1; 11. Sul2; 12. bla-IMP; 13. bla-TEM; 14. bla-SHV; 15. bla-CTX; 16. bla-OXA; 17. bla-DHA; 18. β-KPC; 19. β-HDM; 20. lnuH)
2.5.2 耐药基因检测结果 耐药基因筛查结果显示,分离菌株PX0923携带aadA1和bla-TEM2种耐药基因,其余耐药基因的筛查结果为阴性(图6 D),表明该分离株PX0923具有一定的耐药性。
2.5.3 抗生素敏感性试验结果 金黄色葡萄球菌 (ATCC25923)为质控菌株进行的药敏试验,结果证实药敏片有效。抑菌圈直径测量发现,庆大霉素、卡那霉素、新霉素、阿米卡星、克林霉素、多黏菌素、呋喃唑酮、多西环素、四环素、美满霉素、麦迪霉素和头孢拉定等12种药物对PX0923的抑菌圈直径均≤15 mm,表明PX0923菌株对以上抗生素均耐药;对诺氟沙星、青霉素、阿莫西林、头孢他啶和氨苄西林5种抗生素中介;对环丙沙星、氧氟沙星、头孢哌酮和头孢唑林4种抗生素的抑菌圈直径均>20 mm,表明分离菌株PX0923菌株对上述4种抗生素均敏感;以上结果表明,分离菌株PX0923为多重耐药菌株。
2.5.4 中药抑菌试验结果 中药体外抑菌试验结果显示,全蝎对分离菌株的抑菌直径为25 mm,大于20 mm,表明其对PX0923抑菌作用较强,为极度敏感;三七的抑菌直径为14 mm,对PX0923抑菌作用为中度敏感;在中药最小抑菌浓度的试验中,全蝎的最小抑菌浓度为3.91 mg·mL-1,三七的最小抑菌浓度为125 mg·mL-1;其余中药提取液对分离菌株PX0923无显着抑制效果。
3 讨 论
猪链球菌在感染人的病例中,主要以SS2感染居多,少数为1、4、5、9、14、16、21、24和31血清型所致[26,31-32]。研究发现,当前在SS的诸多MLST型别中,世界范围内流行的猪链球菌主要是ST1、ST7和ST28,其中ST1和ST7是感染人的主要菌株型[8]。除此之外,最近在我国的不同地方发现了猪链球菌新的ST型,如ST658、ST242、ST377、ST1131和ST665等;这些新发现的ST型目前仅出现在人类感染的病例中,尚无人与人之间传播和流行的直接证据[28]。本研究从患呼吸道疾病猪脑组织中分离的PX0923经16S rRNA测序、PCR和PCR-RFLP鉴定为SS2,这与流行病学调查中亚洲主要流行血清型2、3和4的研究结果相一致。分离菌株PX0923进一步经分子分型鉴定为ST7型,这也与SS在世界范围内的分子分型的流调结果一致[7,29]。在已报道的ST7型猪链球菌中,均分布在国内,来源于人和猪的组织。2022年,熊衍峰等[33]首次发现江西省赣州市人源ST7型猪链球菌(血清2型)病例;本研究从患病猪的脑组织中分离出可导致脑膜炎的ST7型猪链球菌(血清2型),目前尚未见报道。猪源和人源ST7型猪链球菌(血清2型)病例的发现,提示SS2作为一种人兽共患病病原,不管是经典菌株型,还是新型菌株,其在人和动物及环境中的传播,结合其致病性和耐药性的潜在威胁,应引起高度的重视,开展深入、系统的流调和致病机制研究,防患于未然。
据统计,猪链球菌可产生百余种不同的毒力因子,主要分为四大类:细菌表面成分/分泌分子、酶、转录因子/调节系统、转运因子/分泌系统。EPF、MRP和FBPS属胞外蛋白,MRP是SS主要的黏附素,FBPS是细菌黏附的底物,这些毒力因子均与细菌的侵染相关;研究发现,毒力基因型为mrp+epf+的菌株大多为强毒株,常引起猪典型的脑膜炎和关节炎。SLY是一种巯基活化类毒素,研究发现其可能在SS侵入和裂解细胞的过程中发挥重要作用;GAPDH与SS黏附宿主细胞有关[34-35]。本研究的分离的猪源ST7型分离株PX0923携带7种毒力基因[36]:epf、mrp、sly、gapdh、fbps、orf2和sao,以及SS2特有的毒力基因簇nmt。人工感染试验中,攻毒组小鼠腹腔、胸腔内有大量淡红色液体,肺组织出现显着病变,这与自然发病猪胸、腹腔积液的临床症状相一致。分离菌株所携带毒力因子的致病作用与本研究致病性试验中小鼠的临床症状相符合。猪源ST7型分离株PX0923可致小鼠出现脑膜炎、脾和肝出血等多器官损伤,这可能与其携带的毒力因子mrp、epf、sly和gapdh有关,也与分离菌株本身具有的α溶血活性相关。经病理组织学分析,分离菌株能够导致脑和肺等组织器官出血、肝细胞发生脂肪变性和细胞质空泡化等病理变化,进一步说明分离菌株具有一定的致病性。高剂量感染分离株PX0923可导致小鼠死亡,同时从死亡小鼠的脾、肺、肝等器官中均可分离到攻毒菌株,印证了猪源ST7型猪链球菌(血清2型)与湖北某猪场暴发的呼吸道疾病的关联性。
鉴于养殖场呼吸道疾病抗生素治疗效果不理想的情况,本研究通过药敏试验发现ST7型猪链球菌(血清2型)PX0923菌株是一株多重耐药菌,对庆大霉素、卡那霉素、新霉素、阿米卡星等12种抗生素耐药,且携带aadA1和bla-TEM2种耐药基因。研究发现,生物被膜的形成与细菌耐药有着密切关系,生物被膜的特殊屏障渗透作用使得猪链球菌对多种抗生素产生强的耐药性。生物被膜试验结果显示,分离菌株PX0923能够生成生物被膜,且具有中等的生物被膜形成能力,这与其在药敏试验中表现的多重耐药情况相符。鉴于致脑膜炎猪源ST7型猪链球菌(血清2型)PX0923菌株的血清型和致病性,应及早开展系统性的流行病学调查和溯源工作,深入研究不同来源猪链球菌的血清型、多位点序列分型、毒力和致病机理,为猪链球菌的源头控制和精准防控奠定基础。
中药历史悠久、药源广泛、低毒、功效明确且不易产生耐药性,在抗致病菌、病毒感染和提高机体的免疫力方面有得天独厚的优势,特别是在当前禁抗、减抗的大背景下,筛选针对耐药菌株有效的中药成为研究热点[37-38]。Li等[39]发现黄连提取物在体外对猪链球菌具有抑制作用;冯沙沙等[40]发现黄连、黄柏、黄芩、丹参等29种中药对猪链球菌具有显着的抑制效果;陈俭清等[41]确定大黄、 黄芩水提物对猪链球菌生物被膜具有极显着的干预作用;詹佳飞等[42]研究发现毛蕊花糖苷在不影响2型猪链球菌生长活性的情况下,可通过抑制溶血素活性来降低2型猪链球菌对小鼠的致病性。唐阳[43]通过提取大黄素,发现大黄素可有效抑制溶血素蛋白产生,抑制猪链球菌的溶血能力,同时引起毒力基因表达量下调,发挥对猪链球菌抑菌活性。本研究发现,中药全蝎和三七对分离菌株的抑菌效果最佳,其中全蝎对分离菌株极度敏感,这与前人的研究结果存在不同,可能与中药的产地、中药的采集部位、炮制方法、菌株的毒力及耐药性等原因有关。中药的种类和成分繁多,可通过多种靶点抑制病原菌生长、破坏病原菌结构或杀死病原;本研究仅进行了体外抑菌试验,后续开展中药组方、生物被膜清除剂和中西药联合用药,发掘中药全蝎和三七在动物体内的对猪链球菌的抑菌效果及抑菌机制,为开发和利用中药治疗耐药链球菌感染奠定理论基础。
4 结 论
本试验证实从患脑膜炎病猪脑组织中分离出一株猪链球菌(血清2型),ST型为ST7,具有多重耐药特性,且携带epf、mrp、sly、gapdh、fbps、orf2和sao7种毒力基因;在绵羊血平板上呈现α型溶血特点,能导致小鼠患脑膜炎、肺炎等症状,具有一定的致病性,对公共卫生安全具有潜在威胁;其携带aadA1和bla-TEM2种耐药基因,对庆大霉素、卡那霉素、新霉素、阿米卡星等12种药物耐药,对环丙沙星、氧氟沙星、头孢哌酮、头孢唑林4种药物敏感;中药全蝎和三七在体外试验中对分离菌株PX0923均有显着抑菌作用。相关结果旨在为致脑膜炎猪源ST7型猪链球菌(血清2型)的研究提供科学参考。



