毛秋艳,周淑宁,刘 朔,彭 程,尹 馨,张雅馨,周婉婷,李金平,侯广宇,蒋文明*,宋厚辉*,刘华雷,*
(1.浙江农林大学动物科技学院·动物医学院,杭州 311300;2.青岛农业大学动物医学院,青岛 266109;3.中国动物卫生与流行病学中心,青岛 266032;4.内蒙古农业大学兽医学院,呼和浩特 010018)
禽流感(avian influenza,AI)是由禽流感病毒(avian influenza virus,AIV)引起的一种禽类烈性传染病,主要感染野生鸟类和家禽,偶尔也会传播给人类等哺乳动物宿主[1-2]。AIV属于正黏病毒科、甲型流感病毒属成员,核酸类型为单股负链分节段的RNA,病毒基因组内含8条片段,编码10种病毒必需蛋白和一些辅助蛋白[3-4]。目前已知AIV可依据表面蛋白血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)抗原性的不同划分为16种HA亚型和9种NA亚型[5],此外在蝙蝠上有H17N10、H18N11亚型流感病毒的报道[6]。由于各亚型病毒对宿主的致病力不尽相同,又可将AIV分为两类:高致病性禽流感病毒(highly pathogenic avian influenza virus, HPAIV)和低致病性禽流感病毒(low pathogenic avian influenza virus, LPAIV)[7],其中H3亚型AIV是野生鸟类和家禽中最常见的LPAIV之一[8],它可以长期存在于家禽体内而不易被发现,因常导致呼吸道症状、蛋鸡产蛋率下降等问题而严重影响着我国养禽业的发展[9]。与此同时,该亚型毒株能与其他亚型AIV发生基因重排使得其致病性发生改变,进而增加了病毒突破物种传播至人类的风险[10-11],对人类公共卫生构成极大的威胁。自2022年相继出现两起H3亚型AIV感染人类事件以来[12-13],世界卫生组织(WHO)于2023年4月再次报道了中国第三例人感染H3N8亚型AIV确诊病例,患者因出现急性呼吸道感染而死亡[14],这一事件使得人们对禽流感存在的大流行潜力而感到担忧。虽然当前流行的新型H3亚型AIV尚未获得在人际间持续传播的能力[15],但病毒不断重组进化的特性可能会导致其在禽类与哺乳动物间的传播特性发生改变[16],因此需要高度重视这些新型的禽流感病毒株对家禽养殖业和人类健康所带来的风险和挑战,强调了当前行之有效的检测方法对病毒监测的重要性,以此达到预防控制禽流感疫病暴发和降低大流行发生风险的目的。
目前实验室针对禽流感的检测主要有以下3种方法:病毒分离与鉴定、病毒核酸检测和血清学试验[17-18],其中病毒核酸检测中的荧光定量RT-PCR方法因具有省时特异、高效灵敏、自动化程度高等特点而被广泛推荐应用于临床检测和监测工作中。本研究以近期在中国流行的H3亚型AIV的HA基因作为靶序列,设计一对特异性引物和荧光标记探针,建立一种针对H3亚型AIV的荧光定量RT-PCR检测方法,为H3亚型AIV的临床诊断及常规监测提供快速可靠的技术支持。
1 材料与方法
1.1 材料
1.1.1 病毒株 A/Californa/04/2009(H1N1)、A/duck/Guangdong/G2037/2022(H3N2)、A/chicken/Jiangsu/NT0322/2023(H3N3)(简称CK/JS/NT0322/23)、A/duck/Hunan/K1354/2022(H3N6)、A/chicken/Jiangxi/P1027/2023(H3N8)、A/duck/Auhui/AG61/2011(H4N6)、A/duck/Anhui/A1105/2023(H5N1)、A/duck/Hunan/K1212/2022(H5N6)、A/duck/Guangdong/G1392/2022(H5N8)、A/duck/Guangdong/G1231/2022(H6N6)、A/chicken/Hebei/LF0317/2023(H7N9)、A/chicken/Yunnan/KM0224/2023(H9N2)、A/chicken/Jiangsu/J1284/2022(H10N3)病毒株均由中国动物卫生与流行病学中心国家禽流感专业实验室保存;新城疫病毒(Newcastle disease virus,NDV)LaSota株、传染性支气管炎病毒(infectious bronchitis virus,IBV)、传染性法氏囊病毒(infectious bursal disease virus,IBDV)、禽腺病毒(fowl adenovirus,FADV)及鹅细小病毒(goose parvovirus,GPV)均由本实验室保存。
1.1.2 主要试剂及实验动物 试剂:病毒DNA/RNA提取试剂盒购自济凡生物科技(常州)有限公司;HiScript®High Fidelity One Step RT-PCR Kit和HiScript®II U+One Step qRT-PCR Probe Kit购自南京诺唯赞生物科技有限公司;DNA凝胶回收试剂盒购自湖南艾科瑞生物工程有限公司;pEASY-T5试剂盒、Trans1-T1感受态细胞和质粒提取试剂盒购自北京全式金生物技术有限公司;限制性内切酶,购自NEB(北京)有限公司;DNase I 消化酶和T7体外转录试剂盒购自翌圣生物科技(上海)股份有限公司;RNeasy®Mini Kit购自QIAGEN公司。
实验动物:10日龄SPF鸡胚购自购自济南斯帕法斯家禽有限公司;6周龄SPF鸡购自北京梅里亚维通实验动物技术有限公司。
1.2 方法
1.2.1 引物和TaqMan探针的设计与合成 根据GenBank数据库中公开的H3亚型AIV毒株的HA基因序列,利用DNAStar软件进行同源性分析保守区域,通过Primer5.0软件设计特异性引物和TaqMan探针,经BLAST验证引物和探针与相对应的靶基因匹配性较好,引物和探针均由武汉赛维尔生物科技有限公司合成。同时设计一对常规RT-PCR扩增引物(H3-504F/H3-504R),由北京睿博兴科生物技术有限公司合成,具体信息见表1。
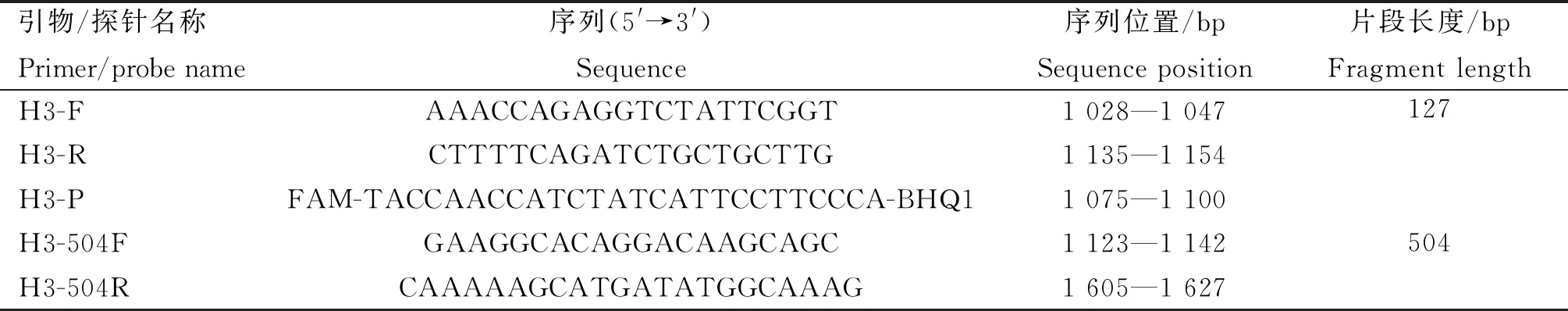
表1 引物和TaqMan探针序列
1.2.2 病毒核酸的提取 参照病毒DNA/RNA提取试剂盒说明书抽提各亚型AIV、NDV、IBV、IBDV、FADV和GPV的病毒核酸;同时将H3N3亚型AIV病毒株CK/JS/NT0322/23(108.83EID50·0.1 mL-1)由106EID50·0.1 mL-110倍倍比稀释至100EID50·0.1 mL-1,并提取各梯度核酸产物,然后置于-80 ℃保存备用。
1.2.3 cRNA阳性标准品的制备 使用HA基因全长通用引物对H3亚型AIV的HA基因进行RT-PCR扩增,产物经DNA凝胶回收试剂盒回收纯化后,将其连接到pEASY-T5载体上,然后再转化至Trans1-T1感受态细胞中。挑取单菌落后进行菌液PCR扩增,利用10 g·L-1琼脂糖凝胶电泳验证目的片段是否连接成功,随后按照质粒提取试剂盒说明书提取疑似阳性质粒,送至青岛睿博兴科生物技术有限公司进行序列测定,阳性质粒命名为pEASY-AIV-H3。通过限制性内切酶将pEASY-AIV-H3进行线性化,使用T7体外转录试剂盒对线性化质粒进行体外转录,待反应结束后,向产物中加入1 μL DNase I消化酶并混匀,37 ℃孵育15 min,以除去体系中的模板DNA;再加入2 μL 0.5 mol·L-1EDTA(pH=8.0),65 ℃孵育10 min终止反应。使用RNeasy®Mini Kit再次纯化体外转录产物,最终得到含有H3亚型AIVHA基因的cRNA阳性标准品。然后利用全波长酶标仪测定cRNA标准品的浓度和纯度,依据下列公式计算得出阳性标准品的拷贝数为1.27×1012copies·μL-1,用作下一步建立荧光定量RT-PCR的模板置于-80 ℃冰箱中保存备用。拷贝数(copies·μL-1)=[6.02×1023×样品浓度(ng·μL-1)×10-9]/(RNA length×340)。
1.2.4 反应条件的优化 使用RNase-Free ddH2O先将上述pEASY-AIV-H3阳性标准品的浓度稀释至1.0×1012copies·μL-1,再进行10倍倍比稀释,以拷贝数浓度为1.0×108copies·μL-1的标准品为模板,采用HiScript®II U+One Step qRT-PCR Probe Kit说明书中推荐的扩增体系,对体系中的引物浓度(2、4、6、8、10 pmol·μL-1)和探针浓度(1、2、3、4、5、10 pmol·μL-1)配比、模板量(2、3 μL)、退火温度(55、58、60 ℃)及延伸时间(30、45 s)等扩增条件进行优化,以确定最适反应条件。
1.2.5 标准曲线的建立 选取1.0×108~1.0×100copies·μL-1的cRNA阳性标准品和106~100EID50·0.1 mL-1的病毒核酸标准品作为绘制标准曲线的模板,体系配制完成后采用优化好的反应条件在荧光定量PCR仪上扩增,同一梯度的样品进行三次平行重复,然后统计检测结果并使用Excel软件绘制相应的标准曲线。
1.2.6 特异性试验 以H1、H3N2、H3N3、H3N6、H3N8、H4、H5、H6、H7、H9、H10亚型AIV及NDV、IBV、IBDV、FADV、GPV的核酸作为模板,RNase-Free ddH2O作为阴性对照,验证建立的H3亚型AIV荧光定量RT-PCR检测方法的特异性。
1.2.7 灵敏性试验 将10倍梯度稀释的cRNA标准品和病毒核酸标准品作为扩增模板,制备cRNA阳性标准品的空载体质粒和RNase-Free ddH2O为阴性对照,分别采用该检测方法和常规RT-PCR检测方法对这两种标准品模板进行扩增,以检测到S型曲线或目的条带的标准品最低浓度为依据,对两种检测方法进行比较。常规RT-PCR反应程序:50 ℃反转录30 min;94 ℃预变性3 min;94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸45 s,共35个循环;最后72 ℃ 孵育5 min。PCR产物使用10 g·L-1琼脂糖凝胶电泳鉴定。
1.2.9 动物攻毒试验样品检测 分别将含有106EID50·0.1 mL-1的H3亚型AIV毒株(CK/JS/NT0322/23)病毒悬液、0.01 mol·L-1PBS溶液滴鼻接种于6周龄SPF鸡,每组3只,接种剂量均为0.1 mL·只-1。在攻毒的第3天剖杀所有鸡并采集肺、气管喉头、盲肠、脾、肾、胰腺、脑、法氏囊、心、肝及胸腺等11种脏器,共计33份攻毒组样品和33份对照组样品。将组织样品经研磨匀浆、离心处理后,取0.1 mL上清液接种至10日龄SPF鸡胚,48 h后收获鸡胚尿囊液并进行血凝试验。同时使用病毒DNA/RNA提取试剂盒提取每份组织样品的核酸,再分别使用H3亚型AIV荧光定量RT-PCR、常规RT-PCR方法对上述66份样品进行检测,最后将两者的检测结果与病毒分离鉴定结果进行比较并计算相应的符合率。
1.2.10 临床样品检测 随机挑选96份2023年本实验室保存的从活禽市场中采集到的口咽部和泄殖腔拭子,提取拭子样品的RNA,应用本研究建立的荧光RT-PCR方法进行检测。同时采用鸡胚培养法分离病毒,利用血凝试验验证并收集阳性鸡胚的尿囊液,进一步抽提病毒核酸后扩增HA和NA基因片段,通过测序确定病毒亚型,比较该方法的准确性。
2 结 果
2.1 荧光定量RT-PCR反应条件的优化
通过对引物探针浓度配比、模板量、退火温度及延伸时间的摸索和优化,最终确定本研究建立的荧光定量RT-PCR的反应体系为:2×One Step U+Mix 10.0 μL,Enzyme Mix 1.0 μL,H3-F(10 pmol·μL-1)0.4 μL,H3-R(10 pmol·μL-1)0.4 μL,H3-P(10 pmol·μL-1)0.2 μL,模板RNA 2.0 μL,最后用RNase-Free ddH2O补足至20.0 μL。反应程序:50 ℃逆转录15 min;95 ℃预变性30 s;95 ℃变性10 s,60 ℃延伸30 s,共40个循环。
2.2 标准曲线的建立
以10倍梯度稀释的cRNA阳性标准品(1.0×108~1.0×100copies·μL-1)和病毒核酸标准品(106~100EID50·0.1 mL-1)为模板,通过荧光定量RT-PCR进行扩增,每个梯度重复3次,结果如图1所示。使用cRNA标准品为模板时,本方法的标准曲线线性方程为y=-3.189 6x+ 41.555,扩增效率为105.83%,相关系数R2=0.998 2>0.99;使用病毒核酸标准品为模板时,本方法的标准曲线线性方程为y=-3.443 3x+ 41.025,扩增效率为95.17%,相关系数R2=0.999 5>0.99,说明这两种标准品的Ct值与浓度之间均存在着良好的线性关系。
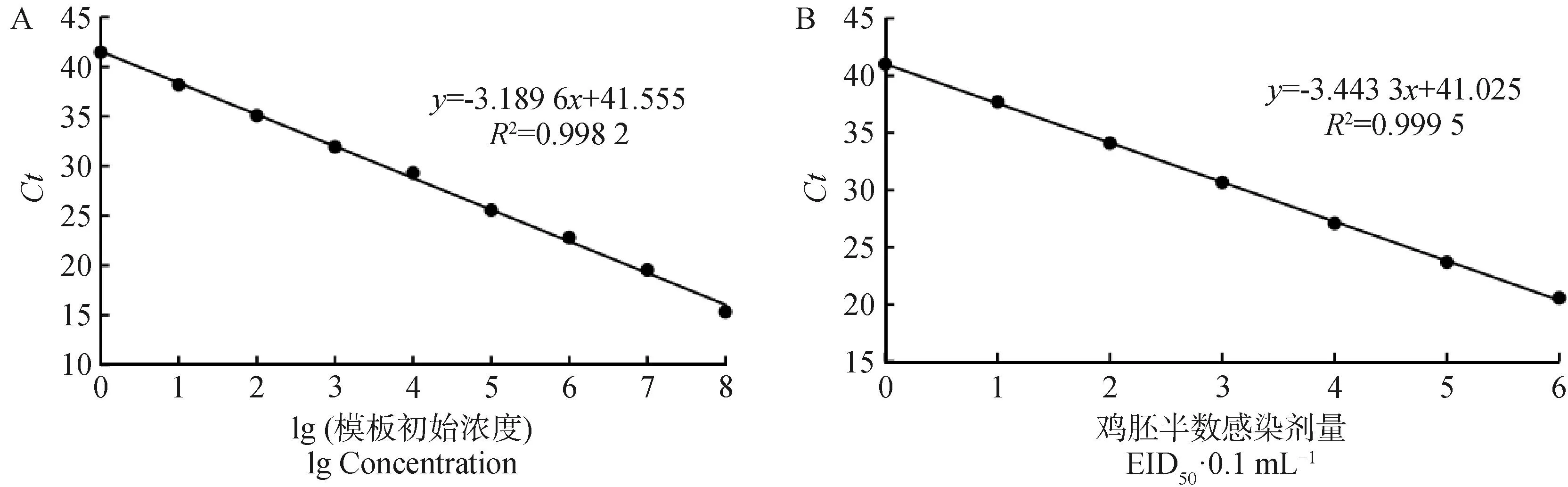
A.以cRNA阳性标准品为模板的标准曲线;B.以病毒核酸标准品为模板的标准曲线A. The standard curve of using cRNA positive standard as template; B. The standard curve of using viral nucleic acid standard as template
2.3 特异性试验
特异性结果显示,只有H3亚型AIV能在FAM荧光通道中出现典型的S型扩增曲线(图2),而其他亚型AIV、NDV、IBV、IBDV、FADV及GPV的检测结果均为阴性,表明本研究建立的检测方法特异性良好。
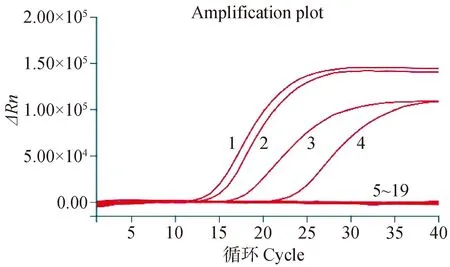
1. H3N3 AIV;2. H3N8 AIV;3. H3N2 AIV;4. H3N6 AIV;5~13. H1、H4、H5N1、H5N6、H5N8、H6、H7、H9、H10 AIV; 14~19.NDV、IBV、IBDV、FADV、GPV、阴性对照1. H3N3 AIV; 2. H3N8 AIV; 3. H3N2 AIV; 4. H3N6 AIV; 5-13. H1, H4, H5N1, H5N6, H5N8, H6, H7, H9, H10 AIV; 14-19. NDV, IBV, IBDV, FADV, GPV, and Negative control
2.4 灵敏性试验
将拷贝数浓度为1.0×108~1.0×100copies·μL-1的cRNA标准品及病毒滴度为106~100EID50·0.1 mL-1的核酸标准品分别利用荧光定量RT-PCR和常规RT-PCR进行检测,试验结果显示,H3亚型AIV荧光定量RT-PCR检测方法可检测到的最低拷贝数浓度为1.0×102copies·μL-1(图3A),最低病毒滴度为102EID50·0.1 mL-1(图4A);而常规RT-PCR的最低拷贝数浓度和病毒滴度分别为1.0×103copies·μL-1和103EID50·0.1 mL-1(图3B、图4B),可见该方法的灵敏度是常规RT-PCR的10倍。
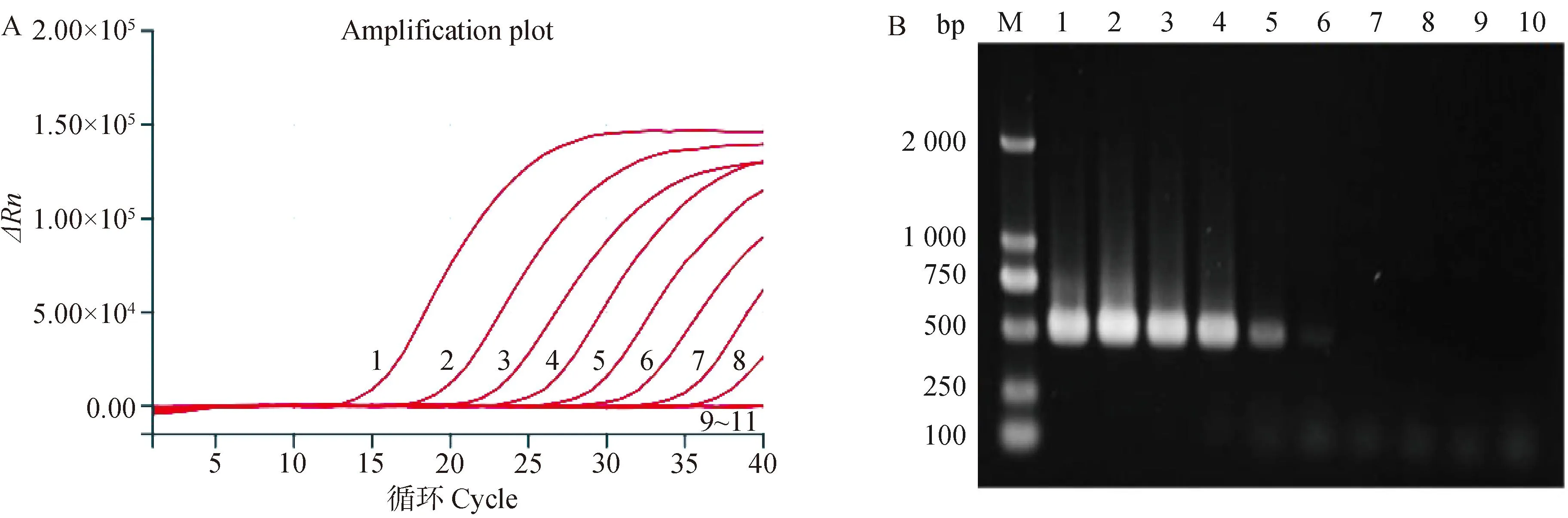
M. DNA相对分子质量标准;1~9. 1.0×108~1.0×100 copies·μL-1;10. 阴性对照;11.空载体质粒M. DNA marker; 1-9. 1.0×108-1.0×100 copies·μL-1; 10. Negative control; 11. Empty vector
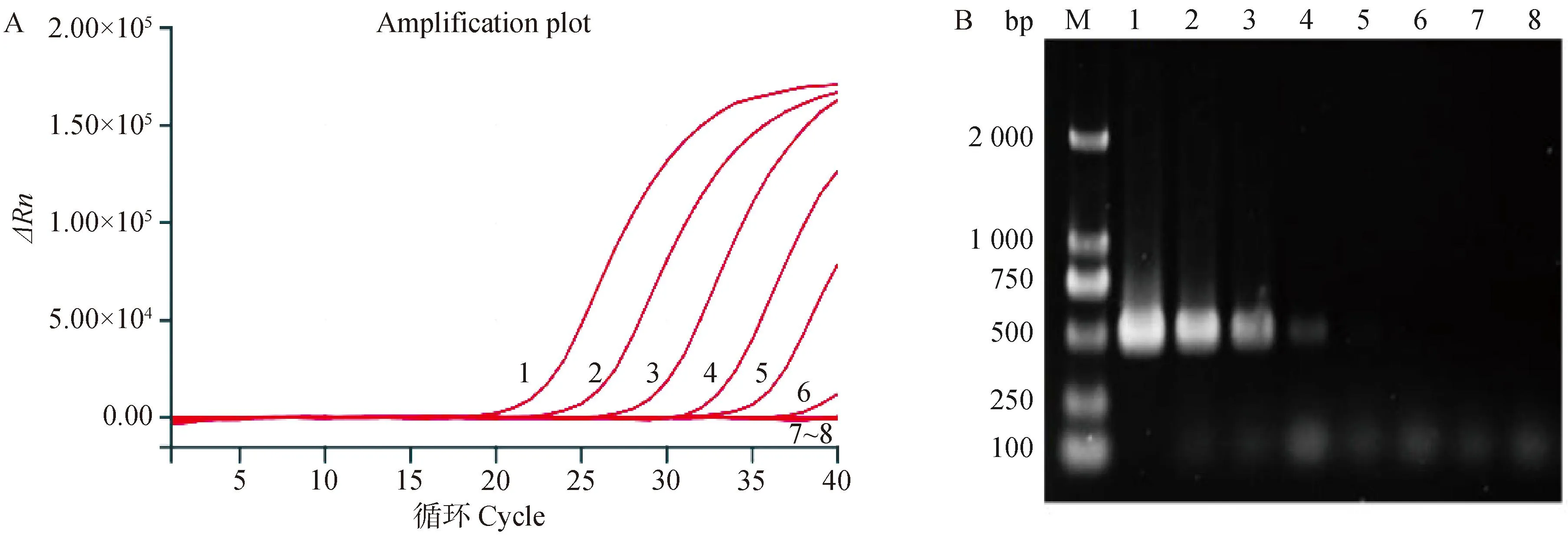
M. DNA相对分子质量标准;1~7. 106 ~100 EID50·0.1 mL-1;8. 阴性对照M. DNA marker; 1-7. 106 -100 EID50·0.1 mL-1; 8. Negative control
2.5 重复性试验
选取1.0×107、1.0×105和1.0×103copies·μL-1的cRNA标准品和106、104、102EID50·0.1 mL-1的病毒核酸分别进行组内和组间重复性试验,组内重复性结果显示(图5),两种标准品不同浓度模板的3次平行反应在FAM荧光通道下的扩增曲线均具有几乎相同的扩增趋势。经计算可得两者的组内和组间Ct值变异系数均小于1.5%(表2),表明本研究建立的荧光定量RT-PCR检测方法具有较好的重复性。
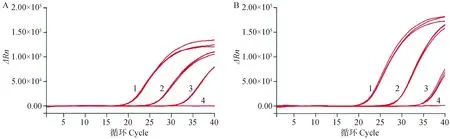
A. cRNA阳性标准品(1. 1.0×107 copies·μL-1;2. 1.0×105 copies·μL-1;3. 1.0×103 copies·μL-1;4. 阴性对照);B. 病毒核酸标准品(1. 106 EID50·0.1 mL-1;2. 104 EID50·0.1 mL-1;3. 102 EID50·0.1 mL-1;4. 阴性对照)A. cRNA positive standard (1. 1.0×107 copies·μL-1; 2. 1.0×105 copies·μL-1; 3. 1.0×103 copies·μL-1; 4. Negative control); B. Viral nucleic acid standard (1. 106 EID50·0.1 mL-1; 2. 104 EID50·0.1 mL-1; 3. 102 EID50·0.1 mL-1; 4. Negative control)
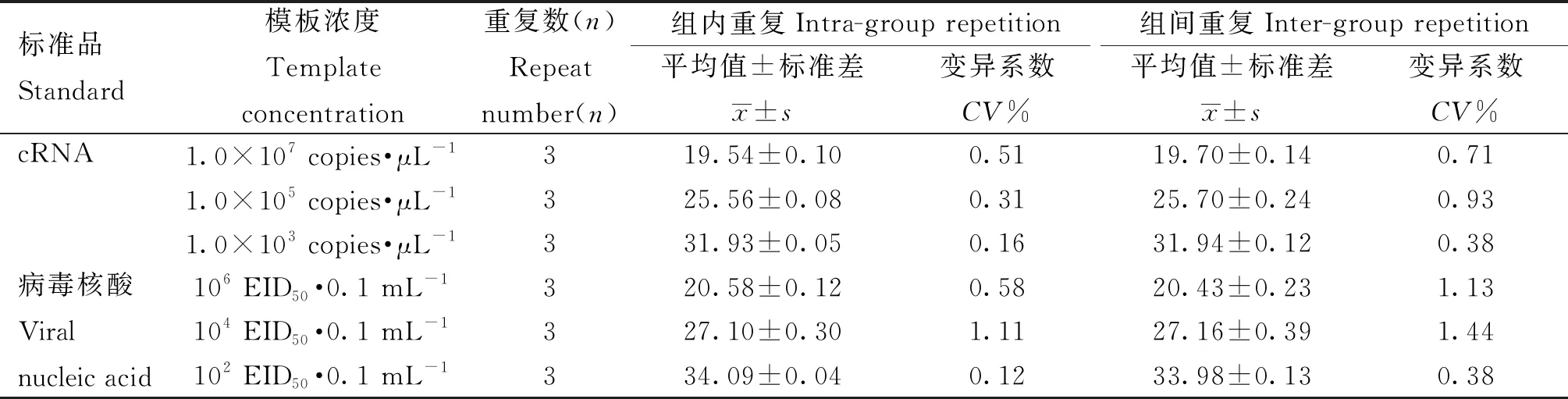
表2 荧光定量RT-PCR重复性试验结果
2.6 动物攻毒试验样品检测
对采集到的66份动物攻毒试验组织样品分别利用病毒分离鉴定、本研究建立的荧光定量RT-PCR和常规RT-PCR检测方法进行检测,结果(表3)显示荧光定量RT-PCR和病毒分离鉴定的样品阳性率均为36.36%(24/66),常规RT-PCR的阳性率为31.82%(21/66)。该检测方法与病毒分离鉴定结果的符合率为100%,与常规RT-PCR的符合率为87.50%;而常规RT-PCR与病毒分离方法的符合率为84.00%,本方法相较于常规RT-PCR而言,其检出率和灵敏性更高,适用于临床检测。
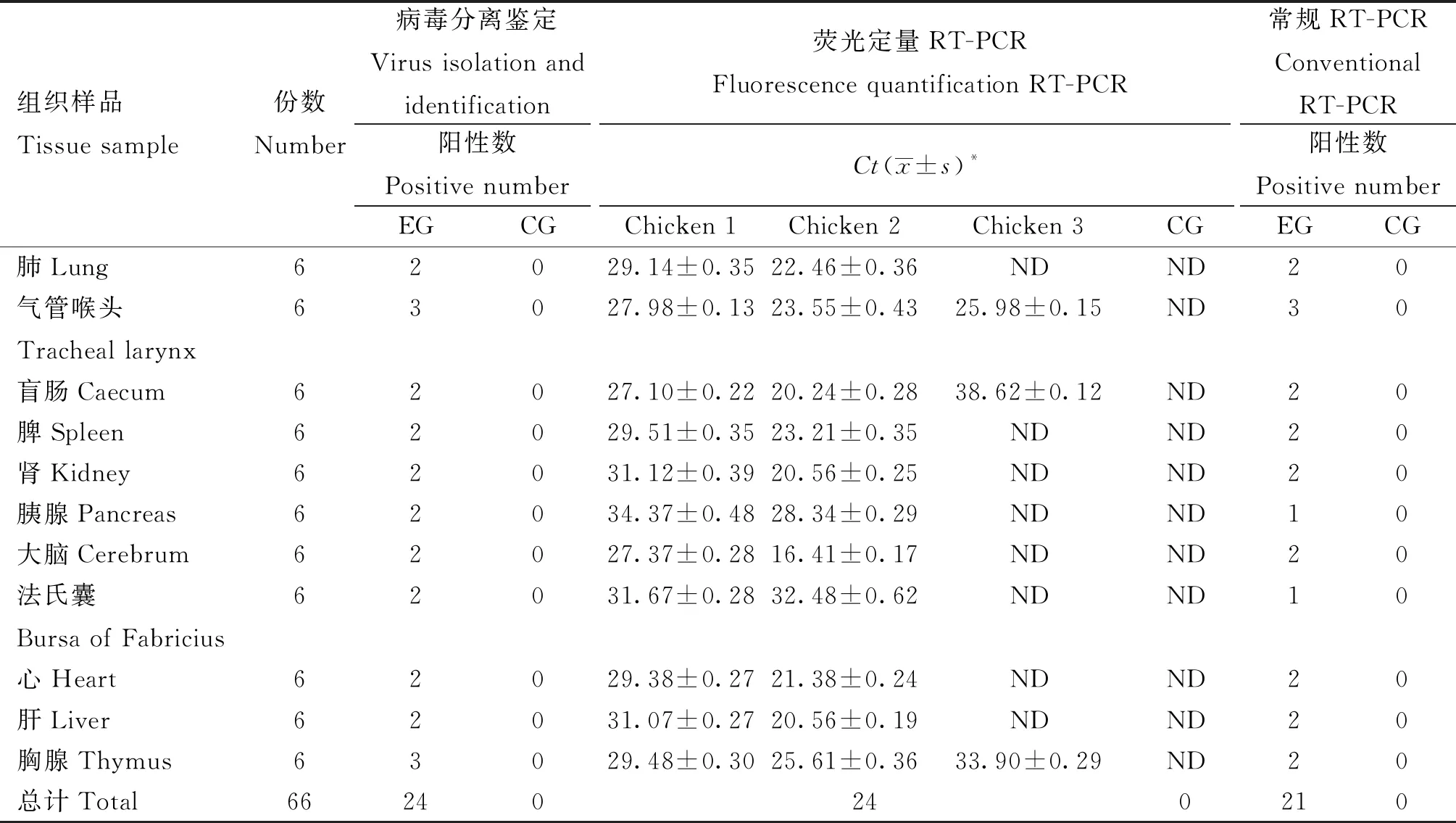
表3 动物攻毒试验样品检测结果
2.7 临床样品检测
利用所建立的检测方法对2023年采集的96份临床样品进行检测,结果(表4)显示,检出的H3亚型AIV阳性样品数为4份,阳性率为4.17%,与病毒分离鉴定结果一致。
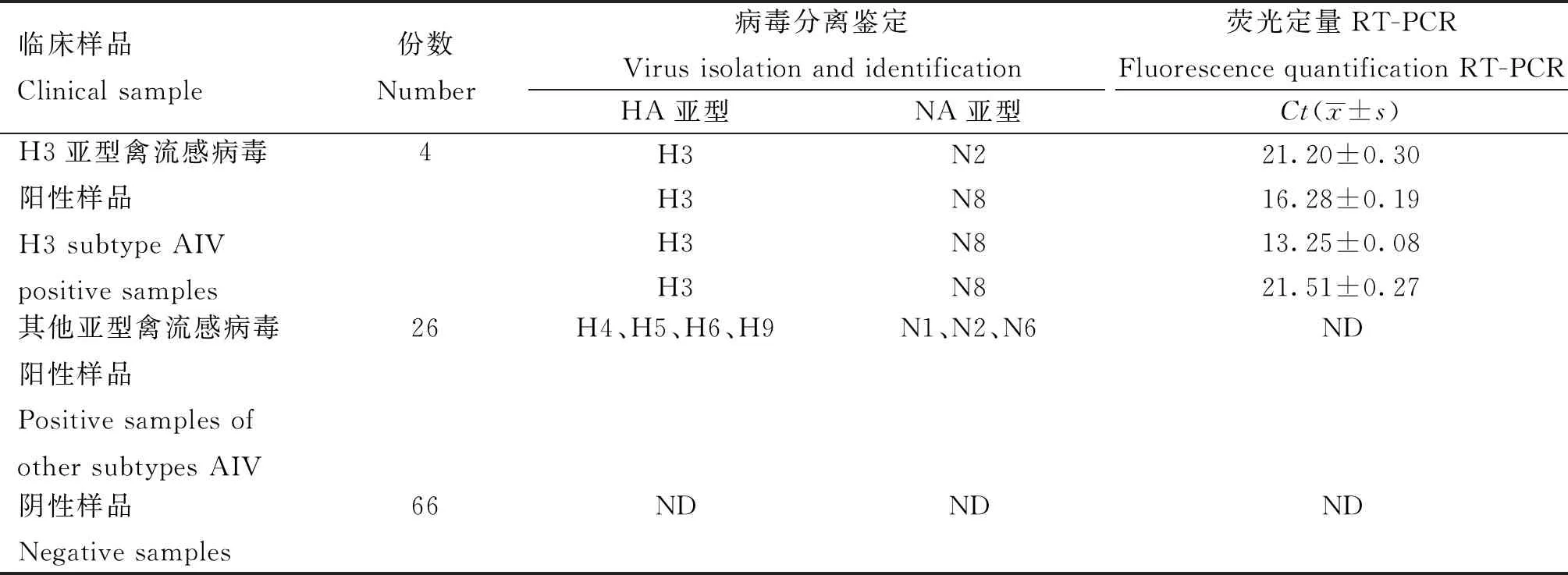
表4 临床样品检测结果
3 讨 论
禽流感不仅是严重危害家禽养殖业的传染性疾病,也是一种重要的人畜共患病。自2000年以来,H3亚型AIV一直在我国的家禽和野生鸟类中持续传播,尤其是在中国南方的家鸭中普遍存在,是水禽中最为流行的AIV亚型之一[19-20]。与此同时,该亚型宿主广泛,除了感染家禽和野生鸟类之外,还可传播至多种哺乳动物,如猪、马、犬、猫、海豹及人类等[21]。我国在家禽中检测到了多种H3 AIV的NA组合,包括了H3N1、H3N2、H3N3、H3N6、H3N7和H3N8[22],其中以H3N2和H3N8亚型的检出率最高[23]。虽然H3亚型AIV是LPAIV,通常只引起轻微的呼吸道症状或无症状感染[24],死亡率较低,但由于病毒之间存在着频繁的基因突变和重组现象,导致了近两年H3亚型AIV新型重组体的出现[25-26],这些新型毒株不仅增加了对鸡的致病性,还对人类健康构成了潜在的威胁。孙洪磊等[27]的研究结果表明,一种新型三源重排H3N8亚型AIV在我国多个省份的鸡群中流行,呈现出高度适应的表现,引起鸡群临床发病,且具有感染人类的风险。2022年以来,新型H3N8 AIV已在河南、湖南、广东引起3起人感染病例[14,28]。同时,水禽和陆生禽类界面复杂的流行病学和生态学可能促进了新型H3亚型重组病毒株在鸡群中的出现[19,23]。因此,加强对国内家禽和野鸟中H3亚型AIV的快速诊断和监测必不可少,将有助于疾病的早期预警。
当前对于H3亚型AIV的诊断方法较多,其中以病毒分离鉴定和常规PCR检测在临床实际中运用最为广泛,同时也存在一些不可避免的缺点,如耗费时间长、操作繁琐、自动化程度低、检出率不高等。为解决此类问题在临床样品检测中所带来的困扰,一种具备高度特异、灵敏特点的荧光定量RT-PCR检测方法应运而生,该方法现多运用于人源、猪源、马源的H3毒株的检测[29-31],而适用于我国禽源H3亚型AIV的检测应用较少。为此本研究设计了一对特异性引物和相应的TapMan探针,通过优化反应条件,开发了一种用于检测H3亚型AIV的荧光定量RT-PCR方法。该方法可特异性检测H3亚型禽流感病毒株,与其他病毒之间无交叉反应性;最低拷贝数浓度和病毒滴度检测线分别为1.0×102copies·μL-1和102EID50·0.1 mL-1,灵敏度是常规RT-PCR的10倍;组内和组间的变异系数均小于1.5%,以上结果说明本研究建立的检测方法具有良好的特异性、灵敏性和重复性。应用此方法对采集到的动物攻毒试验组织样品进行检测,并与病毒分离鉴定和常规RT-PCR相比较,结果表明,荧光定量RT-PCR的结果与病毒分离鉴定一致,符合率为100%,而阳性检出率要高于常规RT-PCR,两者的符合率为87.50%。因此该方法更灵敏,检测效率更高,同时可实现大量样品的快速检测,节省大量的时间,能够满足临床快速诊断的实际需求。从动物攻毒试验样品检测结果可以看出,本研究选取的试验毒株具有较广的组织嗜性,可在多个脏器中复制,对鸡的损伤较大。以往的研究表明之前流行的H3亚型AIV主要存在于水禽中,而当前一些研究显示现阶段流行的毒株在鸡群中的比例有所上升[22],且基因片段逐渐复杂多样化,极大地增加了病毒感染哺乳动物或“溢出性”感染人类的风险[32-33],为此高效灵敏快捷的检测手段对H3亚型AIV的早期预警和预防控制具有重要意义。
4 结 论
本研究建立了一种针对H3亚型AIV的荧光检测方法,具有良好的特异性、灵敏性和重复性,同时可实现大量样品的快速检测,为禽流感流行病学调查和常规监测及防控提供一定的技术支撑。



