梁灿新,郑小雪,舒雪利,周婉怡,廖 明,曹伟胜
(华南农业大学兽医学院,广东省动物源性人兽共患病预防与控制重点实验室,人兽共患病防控制剂国家地方联合工程实验室,农业部兽用疫苗创制重点实验室,广州 510642)
禽白血病是由禽白血病病毒引起的导致禽类免疫抑制、生长缓慢、生产性能下降并诱发多种肿瘤的疾病[1]。目前该病在我国及世界多个国家广泛流行,在家禽生产中危害极大,给家禽养殖行业带来重大的经济损失[2],更是严重影响并危害到我国地方品种鸡的优质基因库[3],曾于2012年被纳入我国动物疫病净化的重点防控对象和净化目标,是《全国肉鸡遗传改良计划(2021-2035)》《全国蛋鸡遗传改良计划(2021—2035)》以及《种源动物健康标准》中重点防控的动物疫病。根据宿主范围、病毒囊膜糖蛋白及病毒中和试验,ALV被分为A~K等亚群,目前在中国地方鸡群中流行较多且引起主要危害的是A、B、J、K等亚群[4]。其中ALV-K是2012年由王鑫等[5]从芦花鸡中发现的新型禽白血病病毒,其复制能力和致病力相对较弱,感染ALV-K的鸡群往往表现出亚临床症状[6]。但是由于我国地方品种鸡的品种繁多且分布较广,这可能有利于禽白血病的传播和进化,ALV-K在地方鸡群中的潜在流行趋于严重[7],且频繁出现与其他亚群ALV重组出现双重、多重ALV重组株的相关报道[8-10]。本研究在华南地区某规模化种禽场中调查发现其部分父母代花鸡头部出现疑似肿瘤病变,通过对该病例进行实验室诊断及相关病原研究,结果表明该病例的主要相关性病原为ALV-K,以期为ALV-K的致病性分析支撑和致病机理的研究提供基础,并且为中国地方鸡群的ALV净化方案提供依据。
1 材料与方法
1.1 样品、细胞和主要试剂
鸡血浆、组织病料样品均来自于华南地区各规模化种禽场;鸡胚成纤维细胞系(DF-1细胞)由广东省动物源性人兽共患病预防与控制重点实验室保存;DMEM高糖培养基、胰酶(0.25% Trypsin-EDTA)、新西兰胎牛血清均购自Gibico公司;总RNA极速抽提试剂盒购自上海飞捷生物技术有限公司;PCR酶2×Hieff PCR Master Mix (With Dye)购自上海翌圣生物科技有限公司;高保真酶、反转录酶均购自南京诺唯赞生物科技有限公司;ALV p27单克隆抗体购自广州千寻生物科技有限公司;ALV-J单克隆抗体(JE9)由扬州大学秦爱建教授提供;荧光二抗goat anti-mouse IgG secondary antibody购自LI-COR公司。
1.2 病理学诊断
无菌操作剪取患病鸡头部疑似肿瘤病变组织,于4%多聚甲醛固定液中进行固定,24 h后对病料组织块进行修块、冲洗、乙醇梯度脱水、丙酮透明、软蜡和硬蜡浸蜡后石蜡包埋,经切片、摊片、烘干后制作成组织切片。然后对组织切片进行脱蜡、苏木精-伊红(HE)染色,并且进行显微镜检查。
1.3 PCR检测禽白血病病毒
提取疑似肿瘤组织RNA反转录获得前病毒cDNA,并且以此为模板,使用特异性引物(表1)[11-13]进行ALV-A/B/J/K、REV和MDV等病原的特异性检测。ALV-A/J的PCR检测程序:95 ℃ 5 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,共35个循环,72 ℃ 7 min,16 ℃保存。在ALV-B/K的PCR检测程序中退火温度为60 ℃,延伸时间为1 min 30 s,其余同上。在REV和MDV的PCR检测程序中退火温度为57 ℃,延伸时间为40 s,其余同上。PCR产物用含1%琼脂糖凝胶进行电泳,并且通过凝胶成像分析系统观察并拍照。
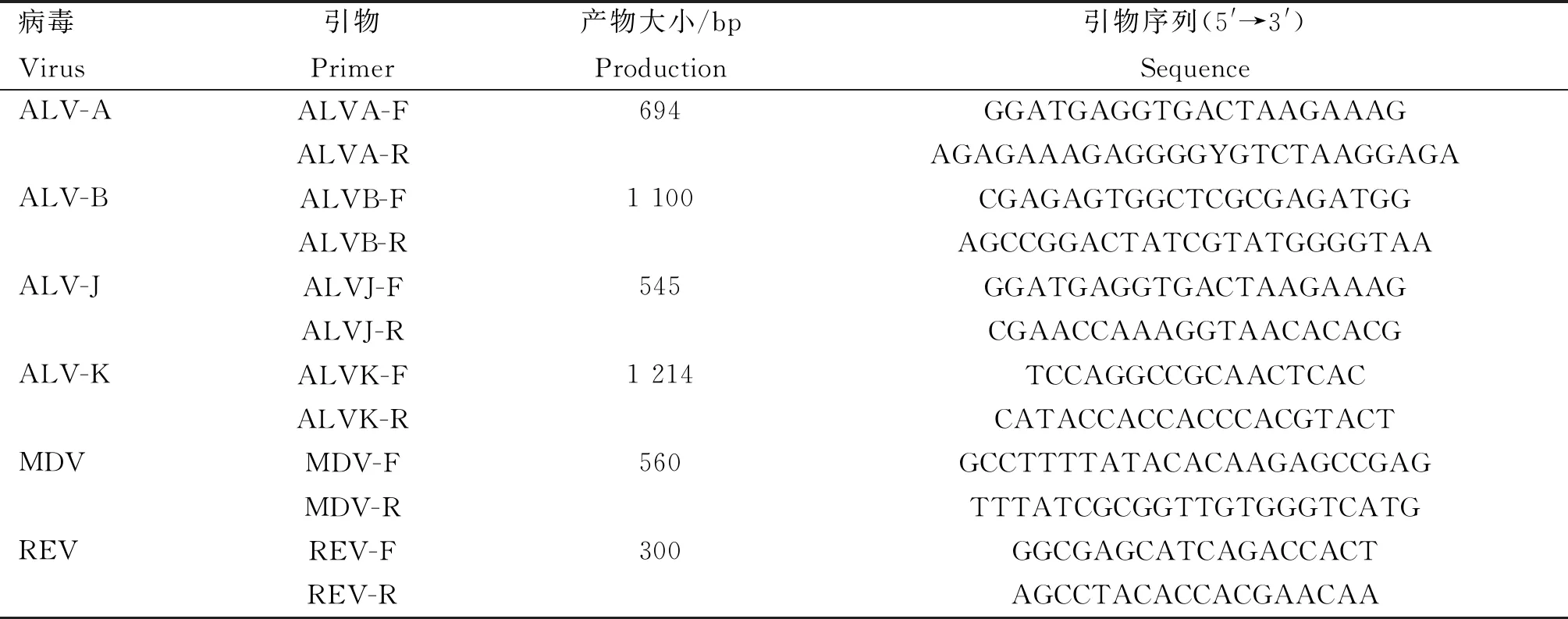
表1 ALV-A/B/J/K、REV、MDV特异性引物
1.4 病毒分离和鉴定
无菌操作采集患病鸡的血浆样品32份,疑似肿瘤组织、脑组织样品各6份并且制备成组织匀浆。将血浆样品和组织匀浆接种至生长密度为70%~80%的DF-1细胞,于37 ℃、5%CO2细胞培养箱中孵育3 h,更换含10% FBS的细胞培养基并且盲传三代,更换1% FBS的细胞培养基维持培养9 d。细胞培养板经过反复冻融三次后,吸取上清液使用奥睿特禽白血病抗原检测试剂盒进行ALV p27抗原ELISA检测。
1.5 ALV分离株纯净性检测
将ALV p27抗原检测阳性的样品重新接种DF-1细胞进行病毒扩繁,维持培养9 d后,分别使用ALV p27单克隆抗体及ALV-J单克隆抗体JE9作为一抗,FITC标记的羊抗鼠IgG作为二抗,对感染了ALV分离株的DF-1细胞进行间接免疫荧光试验(IFA)验证,同时设置阴性对照。并且提取细胞培养上清液中病毒RNA,通过RT-PCR进行ALV亚群鉴定。
1.6 ALV分离株env基因扩增、测序及序列分析
为更好地分析ALV分离株的分子遗传信息特征,本研究从华南地区其他5个规模化种禽场中分离获得与本病例相同亚群ALV。参考相关文献的特异性引物对ALV分离株的env基因进行扩增[14],并将PCR产物连接到pMD18T克隆载体上,转化至DH5α感受态细胞中,挑取阳性菌落送生工生物工程(上海)股份有限公司测序。测序结果使用用DNAstar软件对进行剪辑,使用MEGA-X分析软件中的Maximum Likelihood方法对ALV分离株的gp85基因与NCBI数据库中的各亚群ALV参考株(表2)进行遗传演化分析,并且使用MegAlign程序针对gp85囊膜蛋白氨基酸序列进行了突变位点的分析。

表2 ALV参考株信息
2 结 果
2.1 头部疑似肿瘤病例初步诊断
华南地区某黄羽肉鸡规模化种禽场在400日龄的部分父母代花鸡头部鸡冠下缘出现白色、质地坚硬且形状不规则的肿块(图1),发病率约为2%,除头部肿块外未见其他不良表现,且发病鸡群仅限于花鸡品系中,其他黄羽肉鸡品系未见类似病症。对患病鸡头部肿块病理组织学诊断,样品中均有肿瘤组织形成的新生血管和分化中的血管(图2a、b),可见海绵状新生血管(图2c、d),并且伴随有伪嗜酸性粒细胞样瘤细胞增生浸润(图2e、f),病理组织学诊断为内皮血管瘤。
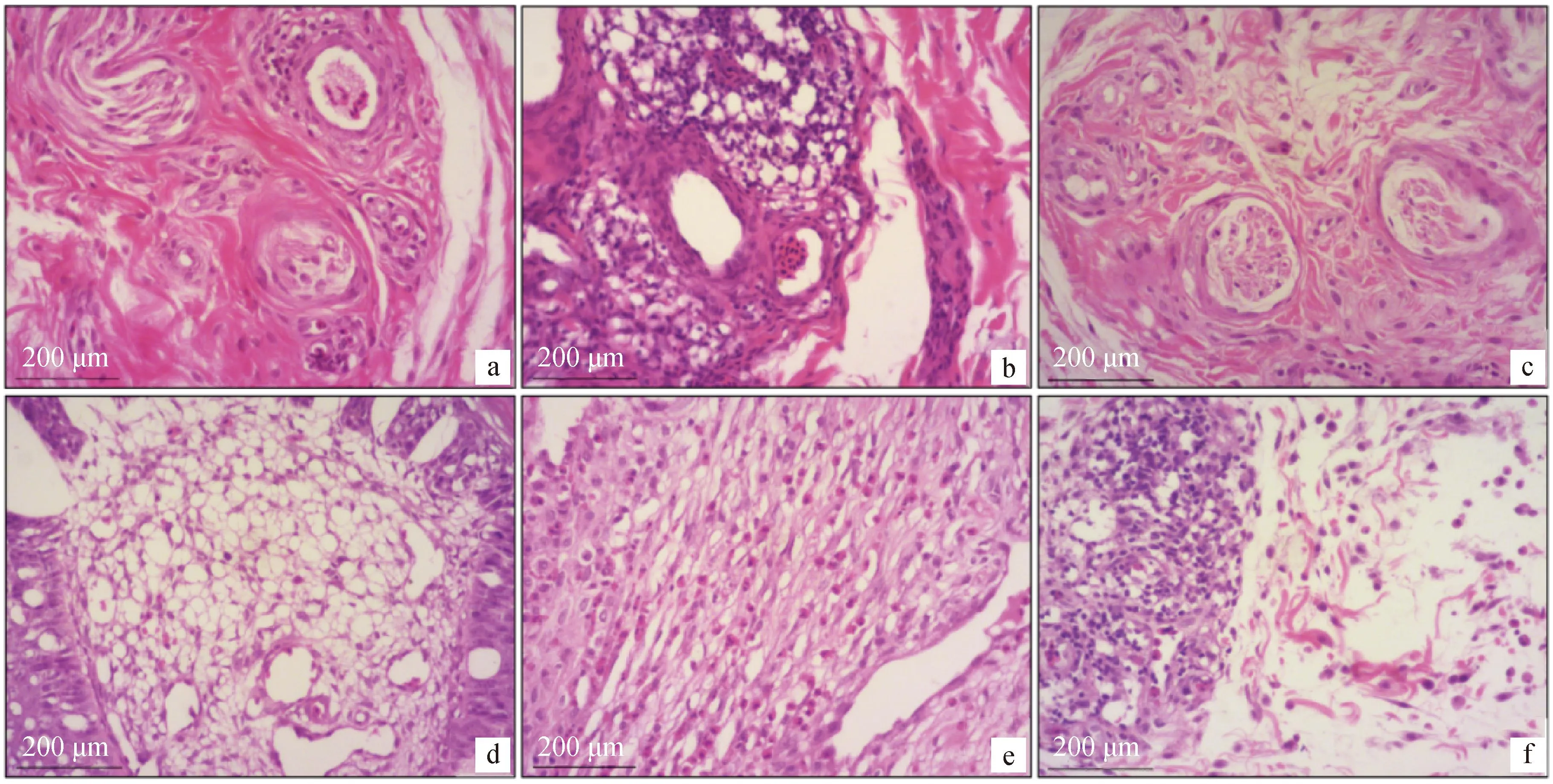
A、b.肿瘤组织中可见新生血管和分化中的血管形成;c、d.肿瘤组织中可见海绵状新生血管;e、f.肿瘤组织中可见为嗜酸性粒细胞样瘤细胞浸润a, b. Neovascularization and differentiated angiogenesis are seen in tumor tissue; c, d. Cavernous neovascularization is seen in the tumor tissue; e, f. The tumor is infiltrated with eosinophilic granulocytoma cells
对6只发病鸡肿瘤组织RNA进行ALV-A/B/J/K、REV、MDV等病毒性肿瘤病病原的RT-PCR检测结果显示,6份肿瘤组织中均检测到ALV-K特异性条带(图3),且1号发病鸡肿瘤组织中同时出现ALV-J和ALV-K特异性条带,均未见ALV-A、ALV-B、MDV、REV感染。初步表明发病鸡头部肿瘤的症状可能与禽白血病病毒相关。
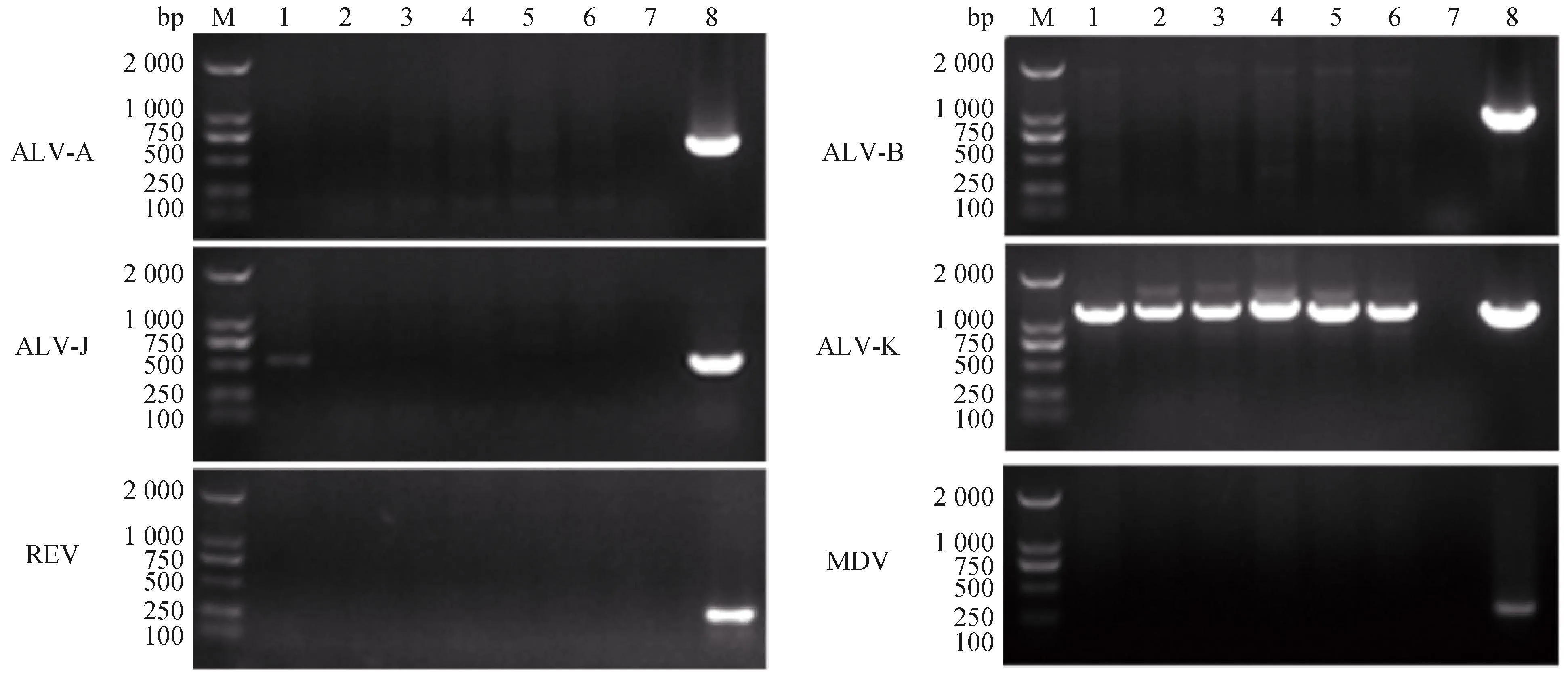
M.DNA相对分子质量标准;1~6.患病鸡肿瘤组织cDNA;7.阴性对照;8.阳性对照M.DL2000 DNA marker;1-6. cDNA from tumor tissue of diseased chicken;7.Negative control;8.Positive control
2.2 病毒的分离鉴定
在病毒分离鉴定中,从脑组织匀浆中成功分离4株ALV,分别命名为GXJL01~GXJL04。对4个ALV分离株的IFA检测结果显示接种GXJL01~GXJL04的DF-1细胞,p27单抗处理组发出特异性绿色荧光,JE9单抗处理组和阴性对照组均无荧光出现(图4a),显示GXJL01~GXJL04均不是ALV-J。经RT-PCR检测验证,GXJL01~GXJL04均为ALV-K,无ALV-A/B/J共感(图4b)。而血浆样品和肿瘤组织匀浆中均未分离到外源性ALV病原。
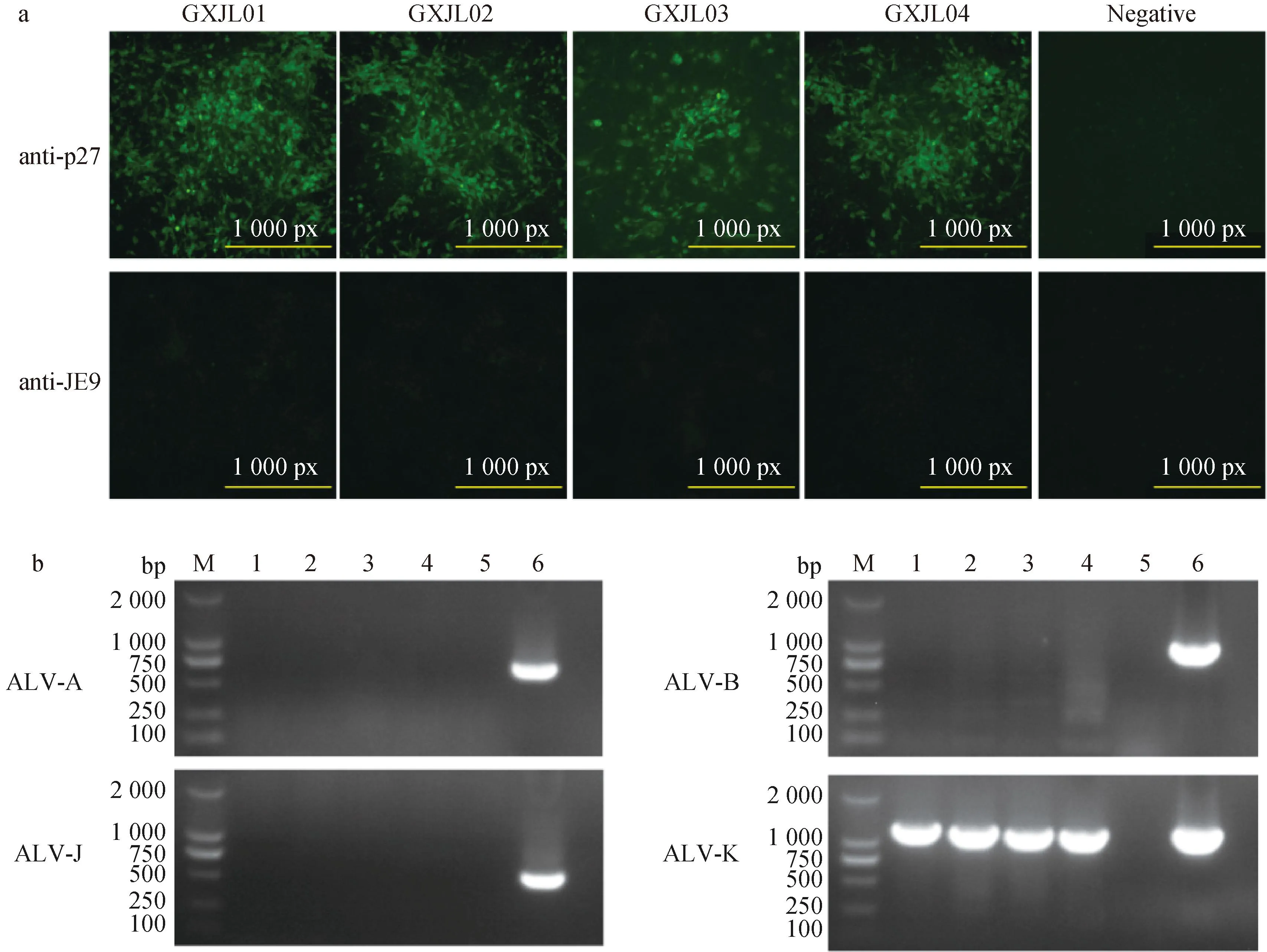
A. GXJL01-GXJL04分离株IFA鉴定; b.GXJL01-GXJL04分离株的外源性ALV的RT-PCR鉴定;M.DNA相对分子质量标准;1~4.GXJL01-GXJL04接种DF-1细胞培养上清;5.阴性对照;6.阳性对照a. Identification of GXJL01-GXJL04 by IFA; b. RT-PCR identification of exogenous ALVs from GXJL01-GXJL04 isolates; M.DL2000 DNA marker; 1-4. cDNA of GXJL01-GXJL04 from DF-1 cell culture supernatant; 5. Negative control; 6. Positive control
2.3 11个ALV-K分离株gp85基因演化分析
为进一步了解GXJL01~GXJL04这4个ALV-K分离株的遗传进化特点,本研究从华南地区5个规模化种禽场临床血浆样品中分离得到7个ALV-K流行毒株,分别命名为GD22JL01、GD22JL02、GD22LH01、GD22FX01、GD22FX02、GD22NH01、GD22HD01。基于ALV-K分离株的gp85基因,利用MEGA-X分析软件中的Maximum Likelihood方法进行遗传演化分析。结果显示(图5),GXJL01~GXJL04与GD22JL01等7个ALV-K分离株虽与ALV-K参考株同属于同一进化分支上,但分属于2个小的拓扑群,GXJL01~GXJL04与Km_5845、Sp53等FGV参考株及JS15SG01等在同一遗传进化分支拓扑群上,命名为Group 1,而GD22JL01等7个ALV-K分离株则与ALV-K原型株JS11C1等在另一个遗传进化分支拓扑群上,命名为Group 2。揭示了GXJL01-GXJL04这4个ALV-K分离株的gp85基因相较于华南地区ALV-K流行株具有一定特殊性。
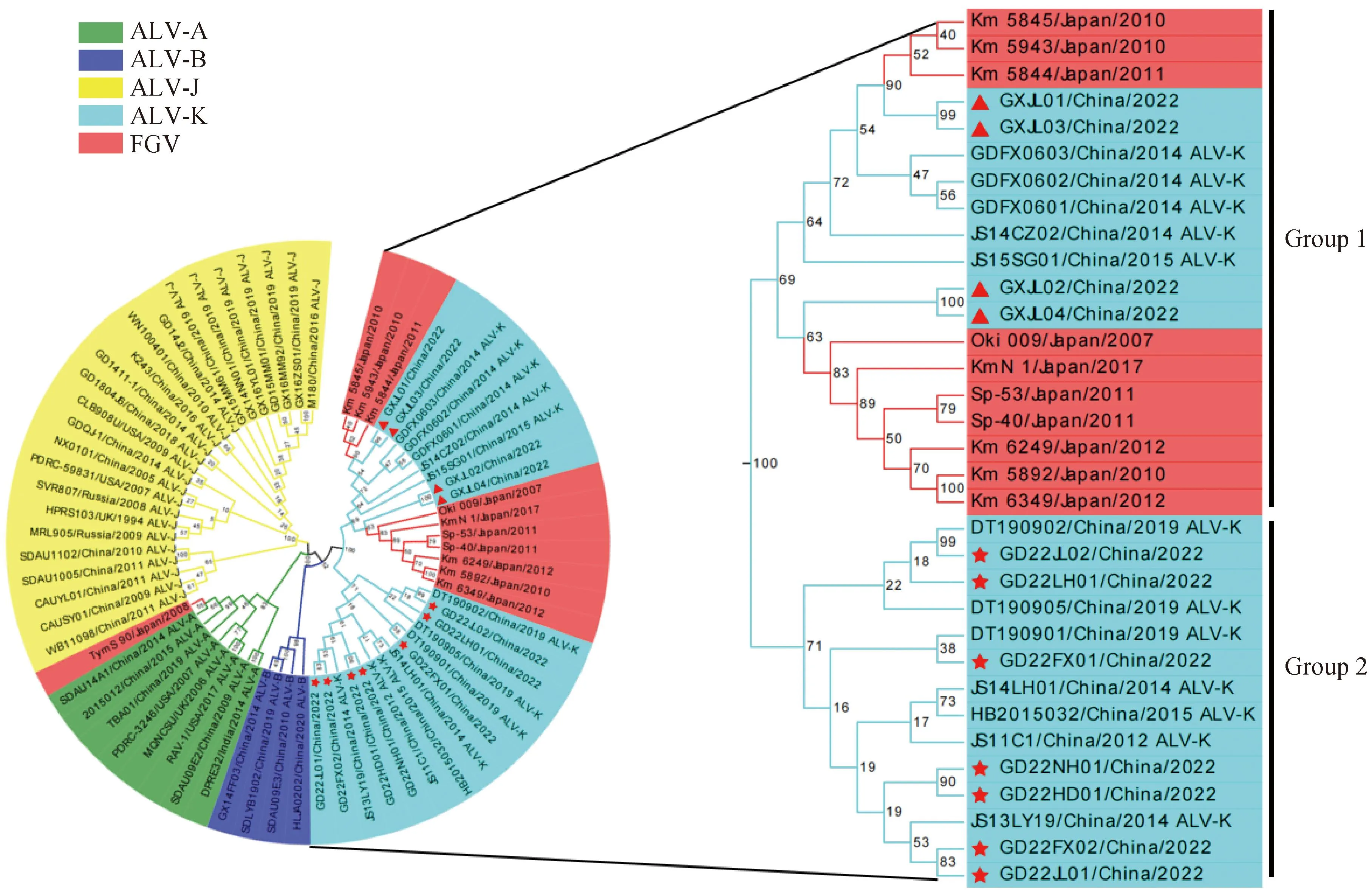
红色三角形标记为头部肿瘤ALV-K分离株,红色星号标记为华南地区分离的7个ALV-K流行株The red triangle marks the head tumor ALV-K isolate, Red asterisks indicate seven endemic strains of ALV-K isolated from South China
2.4 11个ALV-K分离株gp85氨基酸序列突变位点分析
将11个ALV-K分离株与NCBI数据库中的ALV-K参考株及FGV参考株进行gp85氨基酸序列比对。结果显示,GXJL01~GXJL04分离株gp85囊膜蛋白氨基酸序列存在多个与FGV参考株及JS15SG01相同而区别于华南地区ALV-K分离株的氨基酸位点突变,主要集中在vr1、hr1及hr2区域。
在vr1区域中,GXJL01~GXJL04存在I66V、G69A的突变情况,在第70位氨基酸位点,相较于大部分ALV-K参考株及7个华南地区ALV-K分离株,插入一个丝氨酸(S),位点突变及插入情况与大部分FGV参考株及JS15SG01一致。在hr1区域中,GXJL01和GXJL03存在P122S位点突变,与FGV参考株及JS15SG01一致;GXJL01~GXJL04存在N123G为点突变,与FGV参考株及JS15SG01一致而区别于大部分ALV-K参考株及7个华南地区ALV-K分离株。在hr2区域中,GXJL01和GXJL03存在P196S、R198F和A205V位点突变,第196位和205位突变情况与FGV参考株及JS15SG01一致,第198位突变与Km_5844等FGV参考株及JS15SG01一致;GXJL01-GXJL04存在H202R、T204P、S215R位点突变,突变情况与FGV参考株及JS11C1参考株一致,有区别于大部分ALV-K参考株及7个华南地区ALV-K分离株。在可变区和高变区外,GXJL01~GXJL04存在G55D和L163V位点突变,第55位突变情况与FGV参考株一致,第163位突变情况与FGV参考株及JS15SG01一致。此外,GXJL02和GXJL04的gp85囊膜蛋白多个氨基酸位点表现出独有的突变情况,如G61R、W150E、L153V、T194R和R199F及第138位点表现为独特的精氨酸(R)。
综上,GXJL01~GXJL04四个分离株的氨基酸序列存在多个与日本FGV参考株及JS15SG01相同而区别于其他ALV-K的位点突变,同时也存在多个区别于其他所有ALV-K参考株及FGV参考株的独特突变位点,揭示GXJL01-GXJL04的gp85囊膜蛋白的特殊性。
3 讨 论
自2012年王鑫等[5]在芦花鸡中发现ALV-K以来,其在鸡群中的致病力和复制能力显着低于ALV-A/B/J[15],感染鸡往往表现出生长缓慢、生产性能下降及疫苗免疫失败等亚临床症状,鲜有ALV-K致病诱发鸡肿瘤的相关报道,且本病例头部出现疑似肿瘤的表观症状在中国本土鸡群中少有出现,且鲜有针对类似病例的相关报道。在该病例的临床诊断过程中发现患病鸡头部出现的疑似肿瘤与日本矮脚鸡出现的神经胶质瘤相似,神经胶质瘤是由FGV引起的肿瘤性疾病,其特征病变为弥散性非化脓性脑炎,多发性神经胶质结节增生甚至出现星形胶质细胞瘤的病变[16-19],为本病例的实验室诊断及相关病原研究提供了方向。
但是在病理学诊断过程中发现,患病鸡头部肿瘤中可见明显海绵状新生血管及分化中的血管,并伴随有伪嗜酸性粒细胞样瘤细胞增生浸润,为内皮血管瘤。而在过往中国地方品种鸡关于血管瘤的相关报道中,其主要相关病原多为ALV-J,特征病变为皮肤、脚趾、内脏器官等出现血管瘤样病变[20-22]。但是在RT-PCR检测中发现,6份患病鸡头部肿瘤组织均呈现ALV-K阳性,其中1份肿瘤组织呈现出ALV-J和ALV-K共感染的情况,提示ALV-K很可能为该头部内皮血管瘤病例的相关病原,这在过往关于ALV致瘤研究中是未曾出现的。
在进一步开展病毒的分离鉴定中,参考2002年Iwata等[16]利用神经胶质瘤患病矮脚鸡脑组织匀浆攻毒SPF鸡的研究,证明日本矮脚鸡神经胶质瘤是由ALV引起的,因此在针对本病例的病毒分离鉴定中,除了无菌操作采集32份患病鸡血浆样品及6份肿瘤组织匀浆外,还无菌操作采集了6份脑组织匀浆,接种至DF-1细胞中进行病毒分离鉴定,最终成功从脑组织匀浆中分离得到ALV-K(GXJL01~GXJL04),但在血浆和肿瘤组织匀浆中均未能成功分离相关病原体,其原因可能是该ALV-K病原体存在一定的组织嗜性,在血浆中病毒含量较低,且位于体表的肿瘤组织容易受到环境因素影响而失活导致病毒分离失败。而在脑组织匀浆中分离到的GXJL01~GXJL04,表明该ALV-K分离株可入侵并定殖于中枢神经系统,而研究表明FGV毒株也能入侵家禽的中枢神经系统,而导致小脑发育不全、非化脓性脑炎及星形胶质细胞增生甚至神经胶质瘤等症状[18],且对在中国地区分离获得的ALV-K、ALV-E和ALV-J多重重组毒株JS15SG01的致病性试验结果表明,感染JS15SG01的病鸡大脑皮层内的神经胶质细胞明显增多,也具有神经组织嗜性[23],该研究结果为本研究从脑组织匀浆中成功分离ALV-K提供了依据。
为了更好地分析GXJL01~GXJL04的分子遗传特征,本研究还从华南地区5个规模化种禽场中分离ALV-K流行株共7个,在临床上7个ALV-K分离株的宿主鸡均未表现出明显症状。基于ALV-Kgp85基因的遗传演化分析中,发现GXJL01~GXJL04与GD22JL01等7个ALV-K分离株的遗传进化关系较远。GXJL01~GXJL04与Km_5845、Sp53等FGV参考株及JS15SG01等ALV-K参考株具有相近的遗传进化关系,由于ALV的gp85基因编码的囊膜蛋白gp85含有病毒入侵宿主时与受体结合的抗原决定簇,决定着ALV入侵宿主细胞的偏嗜性[24],且Km_5845、Sp53等FGV参考株及JS15SG01等均为有神经组织嗜性的毒株,因此在遗传分子水平上提示GXJL01~GXJL04也存在与Km_5845、Sp53等FGV参考株及JS15SG01等相同的生物学特性[25-26],可能为引起本病例的关键致病因素,但具体GXJL01~GXJL04分离株是否有神经组织嗜性还需进一步致病性试验验证。
本研究在对gp85囊膜蛋白氨基酸位点突变分析中,发现GXJL01~GXJL04的gp85氨基酸序列存在多个区别于华南地区ALV-K分离株而与日本FGV及ALV-K重组株JS15SG01一致的氨基酸位点突变,主要集中在vr1、hr1、hr2区且不仅限于以上区域。如G55D、I66V、G69A、N123G、L163V、H202R、T204P、S215R,以及GXJL01~GXJL04在第70位插入的丝氨酸(S)。由于以上突变位点与日本FGV毒株及JS15SG01等具有明显神经组织嗜性的ALV-K参考株一致,结合从头部肿瘤病鸡脑组织匀浆中分离获得的ALV-K,提示GXJL01~GXJL04也具有神经组织嗜性的极大可能性,因此推测以上突变位点为花鸡头部肿瘤致病以及ALV-K突变株表现出神经组织嗜性的关键氨基酸突变位点。此外,GXJL02和GXJL04的gp85囊膜蛋白还存在多个独特的突变位点,如G61R、W150E、L153V、T194R和R199F等,是其他ALV-K及FGV参考株均未出现的突变情况。以上gp85氨基酸突变位点的具体生物学功能需要进一步的病毒改造及致病性试验验证。
4 结 论
本研究首次证明华南地区某规模化种禽场中花鸡头部出现的肿瘤病例为内皮血管瘤,其主要相关病原为ALV-K,并且分离鉴定到4株ALV-K(GXJL01~GXJL04),遗传演化分析表明内皮血管瘤相关的GXJL01~GXJL04与FGV、JS15SG01等具有神经组织嗜性的毒株高度同源。



