高 龙,常心怡,李 程,赵晓亚,李汶洁,范浩谦,马静云
(华南农业大学动物科学学院,广州 510642)
目前,肿瘤已经是仅次于心血管疾病的第二大人类主要疾病死亡原因,根据世卫组织的数据显示,2020年约有近2 000万例的新发患者和近1 000万例的死亡患者[1]。癌症同时也是犬猫死亡的主要原因之一,10岁以上的老年犬有50%是因肿瘤相关疾病死亡,中国目前已有超过6 000万只家养犬,而肿瘤相关疾病的治疗方案除了传统的手术治疗外目前尚无其他系统有效的疗法面世[2]。肿瘤相关的传统治疗方式亟待革新与突破,目前肿瘤的治疗已经不限于手术、化疗和放射性治疗等传统疗法,包括CRISPR/Cas9基因编辑技术[3-4]、溶瘤病毒、肿瘤浸润淋巴细胞(TIL)治疗、质子疗法、嵌合抗原受体T细胞(CAR-T)疗法等新型治疗手段均在快速发展。其中溶瘤病毒、嵌合抗原受体T细胞(CAR-T)、肿瘤浸润淋巴细胞(TIL)治疗等免疫疗法,是目前发展较为迅速且十分具有发展前景的治疗方式。
溶瘤病毒是指使用天然的或通过基因工程改造后的病毒,可以通过肿瘤特异性受体或抗病毒通路缺失等靶向肿瘤细胞,并在肿瘤细胞内进行复制,通过诱导细胞凋亡、细胞焦亡和坏死性死亡等多种机制诱导肿瘤细胞死亡[5]。溶瘤病毒当前已有4款药物获批上市:Latima公司研发的Rigvir;三维生物研发的安柯瑞;Amgen公司研发的T-Vec;Daiichi Sankyo公司研发的Delytact (teserpaturev/G47Δ)。与此同时全球还有众多的溶瘤病毒产品处于临床试验中,主要有疱疹病毒科、腺病毒科、痘病毒科、细小病毒科、副黏病毒科等[6],各种溶瘤病毒产品的作用方式和其作用机制各不相同。但溶瘤病毒行业整体呈现快速发展的趋势。
腺病毒是溶瘤病毒临床试验中最主要的病毒载体之一,但很多患者具有预存抗体对人腺病毒具有一定程度的耐受,因此对其作用效果产生了影响[7],而犬腺病毒-2型(canine adenovirus type 2,CAV-2)则具备解决该问题的潜能,因为CAV-2在人体内几乎不存在预存抗体,并且可以实现在肿瘤细胞中复制且不引起患者机体致病[8-9],具有一定的安全性,使其在溶瘤病毒领域具备了潜在的应用前景。CAV-2基因组全长约为32 kb,其可以插入7 kb以上的外源基因片段,易于纯化[10],有利于使用CAV-2携带治疗基因进入肿瘤细胞进而获得更好的抗瘤效果。
肿瘤微环境通过透明质酸的合成和降解发生重塑[11-12]。透明质酸维持实体瘤高内压的肿瘤微环境,为肿瘤细胞的增殖和迁移提供有利条件[13],构筑肿瘤免疫逃逸的物理屏障,严重阻碍了抗肿瘤药物的瘤内递送与治疗。透明质酸酶可以降解透明质酸,生殖簇中编码的精子黏附因子(SPAM1)是基因组编码的6种透明质酸酶中结构和功能最优的[14]。在肿瘤细胞中表达SPAM1蛋白可以降解透明质酸从而增强抗瘤药物的瘤内弥散以及Th1型免疫细胞的瘤内浸润、重塑肿瘤微环境破坏肿瘤免疫逃逸物理屏障系统性增强抗瘤效应[15-16]。
本研究以CAV-2病毒作为载体,构建缺失E3区域并插入外源基因SPAM1序列的P15A-CAV-2-mCMV-SPAM1-SV40 polyA感染性克隆质粒,并拯救重组病毒,以获得能够稳定表达外源基因SPAM1的重组病毒CAV-2-DelE3-SPAM1。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒与细胞 GBdir-pir116-gyrA462、GBred-A462-CAV-2、GB08-red工程菌均来自实验室前期构建与保存。R6K-amp-mCMV-eGFP-SV40 polyA-kmccd质粒来自实验室前期构建与保存。MDCK-E1A细胞系来自本实验室保存。
1.1.2 试剂NheI、AscI、EcoR V、NcoI内切酶购自NEB。质粒大提试剂盒购自天根。胶回收试剂盒、PCR扩增酶、病毒总核酸提取试剂盒、DNAmarke购自诺唯赞。Lipo3000转染试剂购自赛默飞。所有引物由上海生工合成。TBST,脱脂奶粉购自康为世纪。CAV、SPAM1多克隆抗体购自AbcamIgG二抗- DyLight 594IgG二抗-iFluor 488购自艾美捷。CCK8试剂,3D细胞微球制备板(SpheroXTM96Ukit)购自碧云天。
1.2 方法
1.2.1 引物设计与合成 在本研究中用到的PCR扩增引物及荧光定量扩增引物以及用于敲除反向筛选基因的段引物如表1所示。

表1 引物信息
1.2.2 R6K-amp-mCMV-eGFP-SV40 polyA-kmccdB中间载体构建及鉴定NheI酶切使质粒R6K-amp-mCMV-eGFP-SV40 polyA-kmccdB线性化,并回收线性片段。使用引物F2、R2扩增SPAM1目的基因片段b并回收扩增片段。在GBdir-pir116-gyrA462工程菌中进行同源重组构建携带外源基因的重组质粒R6K-amp-mCMV-SPAM1-SV40 polyA-kmccdB。以F1、R1为引物进行外源基因测序并使用NcoI对中间载体进行酶切验证。
PCR反应体系20 μL:2 × Phanta® Flash Master Mix(Dye Plus) 10 μL,上、下游引物各1 μL,质粒模板1 μL,ddH2O 7 μL。PCR反应条件:98 ℃预变性30 s;98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸30s,共30个循环;72 ℃彻底延伸1 min,使用1.0%琼脂糖凝胶进行检测。
1.2.3 感染性克隆的构建及鉴定AscI酶切R6K-amp-mCMV-SPAM1-SV40 polyA-kmccdB重组质粒,回收酶切后的质粒片段,在GBred-A462-CAV-2中进行同源重组。使用F3、R3进行检测并使用EcoR Vd对P15A-CAV-2-mCMV-SPAM1-SV40 polyA-kmccdB质粒进行酶切验证。
再利用合成引物del kmccdB-mCMV进行反向筛选表达盒的敲除,并使用F3、R3进行测序验证P15A-CAV-2-mCMV-SPAM1-SV40 polyA感染性克隆构建。
PCR反应体系20 μL:2 × Phanta® Flash Master Mix(Dye Plus) 10 μL,上、下游引物各1 μL,质粒模板1 μL,ddH2O 7 μL。PCR反应条件:98 ℃预变性30 s;98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸30 s,共30个循环;72 ℃彻底延伸1 min,使用1.0%琼脂糖凝胶进行检测。
1.2.4 病毒拯救及鉴定 提取P15A-CAV-2-mCMV-SPAM1-SV40 polyA质粒,用AscI酶切并回收CAV-2-mCMV-SPAM1-SV40 polyA线性片段,使用Lipo3000转染MDCK-E1A细胞系。回收P1~P15代病毒样品并提取病毒核酸,使用F2、R2、F3、R3进行PCR检测。
PCR反应体系20 μL:2 × ChamQ Universal SYBR qPCR Master Mix 10 μL,上、下游引物各0.5 μL,质粒模板1 μL,ddH2O 8 μL。PCR反应条件:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,共40个循环;溶解曲线95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。
1.2.5 重组病毒株生长曲线测定 以MOI=0.1接种CAV、CAV-2-DelE3-SPAM1于12孔板中,并于6、12、24、30、36、42、48、54、60、66、72 h收样,使用病毒总核酸提取试剂盒提取病毒核酸,使用F5、R5检测病毒拷贝数,绘制病毒一步生长曲线图。
1.2.6 外源蛋白表达间接免疫荧光(IFA)鉴定 将重组病毒CAV-2-DelE3-SPAM1按照 MOI=0.1接种 MDCK-E1A细胞,接种后48 h收获病毒上清继续传代。取P15代重组病毒CAV-2-DelE3-SPAM1,以MOI=1接种6孔板培养的 MDCK-E1A,感染24 h后收获细胞样品。使用1 mL 4%的多聚甲醛4 ℃固定30 min,PBS浸洗3次,加入1 mL 0.1%Triton X-100常温作用15 min,PBS洗涤3次,之后加入1 mL 5%脱脂奶粉封闭液,封闭1 h,PBS洗涤3次后,加入CAV-2、SPAM1多克隆抗体4 ℃过夜。PBS洗涤3次后加入荧光二抗孵育1 h后再用PBS洗涤3次加入适量的DAPI覆盖后于倒置荧光显微镜观察。
1.2.7 重组溶瘤病毒CAV-2-DelE3-SPAM1 2D与3D体外溶瘤效应观察 将重组病毒CAV-2-DelE3-SPAM1、野生型毒株CAV-2 按MOI=10接种 A72犬癌细胞系,接种后48 h显微镜下观察野生毒株与重组毒株的2 D杀伤效应。
在3D细胞球制备板(SpheroXTM96Ukit)中每孔加入100 μL抗黏附包被液,置于37 ℃培养箱中静置过夜。弃去抗黏附包被液后以每孔5 000个A72细胞的密度进行细胞接种。待A72细胞形成球体后弃去培养液,按照 MOI=10接种重组病毒CAV-2-DelE3-SPAM1、野生型毒株CAV-2,在培养箱中继续培养,并于48 h显微镜下观察A72 3 D细胞球杀伤情况。
1.2.8 重组溶瘤病毒CAV-2-DelE3-SPAM1 CCK8细胞杀伤检测 在96孔板中每孔铺5 000个A72细胞,置于37 ℃细胞培养箱中培养至细胞密度为90%。弃去培养液后使用PBS洗涤,使用不同的MOI(MOI=0.1、1、10)将重组病毒CAV-2-DelE3-SPAM1、野生型毒株CAV-2接种感染A72细胞,不加病毒的细胞孔作为对照组,不接种细胞的空白孔作为空白组。接毒后继续培养48 h,弃去培养液每孔加入含10% CCK8的100 μL维持混合溶液,孵育20 min,使用酶标仪在450 nm处测量其吸光度(OD)值。细胞存活率=[(As-Ab)/(Ac-Ab)]*100%,其中As为试验组在450 nm处的OD值,Ab、Ac为空白组、对照组在450 nm处的OD平均值。
1.2.9 统计学分析 数据以“平均值±标准误差(SEM)”表示。采用 GraphPad Prism 8.0 软件对细胞存活率检测CCK8试验结果进行单因素方差分析,显着性用P值表示,P<0.05代表差异显着。
2 结 果
2.1 目的基因扩增
通过使用F2、R2引物扩增SPAM1目的基因,PCR结果显示获得1条1 653 bp的目的条带与预期相符(图1A),成功扩增出携带中间载体同源臂的SPAM1目的基因。

A. SPAM1目的基因PCR鉴定;B. R6K-amp-mCMV-SPAM1-SV40 polyA-kmccdB中间载体酶切鉴定;C. 感染性克隆P15A-CAV-2-mCMV-SPAM1-SV40 polyA酶切鉴定;D. P15A-CAV-2-mCMV-SPAM1-SV40 poly-kmccdB质粒PCR鉴定,泳道1、2、3为重复单克隆;E. 感染性克隆P15A-CAV-2-mCMV-SPAM1-SV40 poly阳性菌PCR鉴定,泳道1、2、3为重复单克隆,泳道4、5、6为重复单克隆A. PCR identification of SPAM1 target gene; B. Identification of R6K-amp-mCMV-SPAM1-SV40 polyA-kmccdB intermediate vector by restriction enzyme digestion; C. Cloning and identification of infectious clone P15A-CAV-2-mCMV-SPAM1-SV40 polyA; D. P15A-CAV-2-mCMV-SPAM1-SV40 poly-kmccdB plasmid was identified by PCR, and lane 1, 2, 3 were duplicate monoclonal; E. The infectious clone P15A-CAV-2-mCMV-SPAM1-SV40 poly-positive bacteria was identified by PCR, and lane 1, 2, 3 were duplicate monoclonal,lane 4, 5, 6 were duplicate monoclonal
2.2 R6K-amp-mCMV-SPAM1-SV40 polyA-kmccdB中间载体PCR与酶切鉴定
使用限制性内切酶NcoI对构建的中间载体R6K-amp-mCMV-SPAM1-SV40 polyA-kmccdB进行酶切电泳,酶切结果显示分别获得了在2 864、1 416、700、235处的4条目的条带(图1B),结果符合预期。通过测序酶切阳性菌结果显示成功构建出携带SPAM1外源基因的中间载体R6K-amp-mCMV-SPAM1-SV40 polyA-kmccdB。
2.3 P15A-CAV-2-mCMV-SPAM1-SV40 polyA感染性克隆PCR与酶切鉴定
使用限制性内切酶EcoR V对构建的感染性克隆P15A-CAV-2-mCMV-SPAM1-SV40 polyA进行酶切电泳,酶切结果显示分别获得了在11 115、8 116、5 356、2 940、1 730、849、789 bp处的7条目的条带(图1C),结果符合预期。
2.4 重组感染性克隆PCR与测序验证
使用F3、R3为引物,构建的P15A-CAV-2-mCMV-SPAM1-SV40 poly-kmccdB质粒为模板进行PCR扩增,PCR结果显示获得一条4 955 bp的目的条带,符合预期(图1D)。分别使用F1、R1和F3、R3为引物,感染性克隆P15A-CAV-2-mCMV-SPAM1-SV40 poly酶切阳性菌为模板进行PCR扩增,PCR结果显示分别获得1 748、3 492 bp的目的条带与预期相符(图1E),并进行测序验证,证明携带外源基因SPAM1的感染性克隆P15A-CAV-2-mCMV-SPAM1-SV40 poly构建成功。
2.5 病毒拯救及鉴定
以提取的P1~P16代重组病毒CAV-2-SPAM1的基因组为模板,分别使用F1、R1和F3、R3为引物进行PCR扩增,PCR结果显示分别获得1 748、3 492 bp的目的条带与预期相符(图2),说明成功拯救出1株携带外源基因SPAM1的重组病毒,并且该重组病毒具有基因组遗传稳定性。
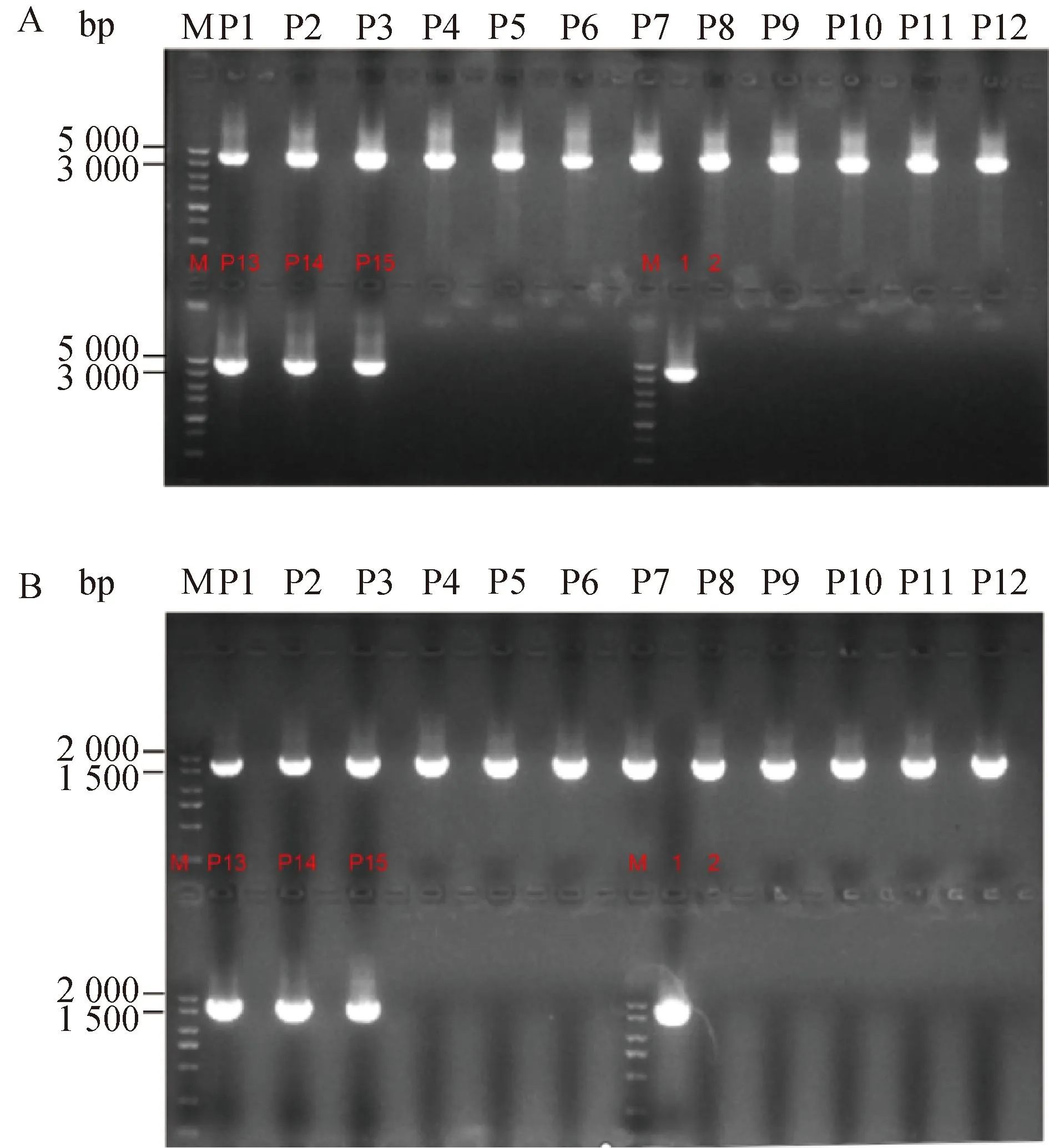
A. 以F3、R3为引物重组病毒CAV-2-SPAM1: P1~P15. PCR结果;M.5 000 bp的DNA marker;1.阳性对照组;2.阴性对照组。B. 以F1、R1为引物重组病毒CAV-2-SPAM1: P1~P15. PCR结果; M.2 000 bp的DNA marker;1.阳性对照组;2.阴性对照组A. Recombinant virus CAV-2-SPAM1 used F3 and R3 as primers: P1-P15. PCR results; M. 5 000 bp DNA marker; 1. Positive control group; 2. Negtive control group. B. Recombinant virus CAV-2-SPAM1 used F1 and R1 as primers: P1-P15. PCR results; M. 2 000 bp DNA marker; 1.Positive control group; 2. Negtive control group
2.6 重组毒株生长曲线测定
以MOI=0.1进行接毒每隔6 h收样,收取至72 h的样品进行一步生长曲线测定,结果显示,野生型毒株在54 h到达平台期,重组毒株在60 h到达平台期(图3),总体趋势上野生毒株与重组毒株没有显着差异,最大增殖滴度无显着差异。
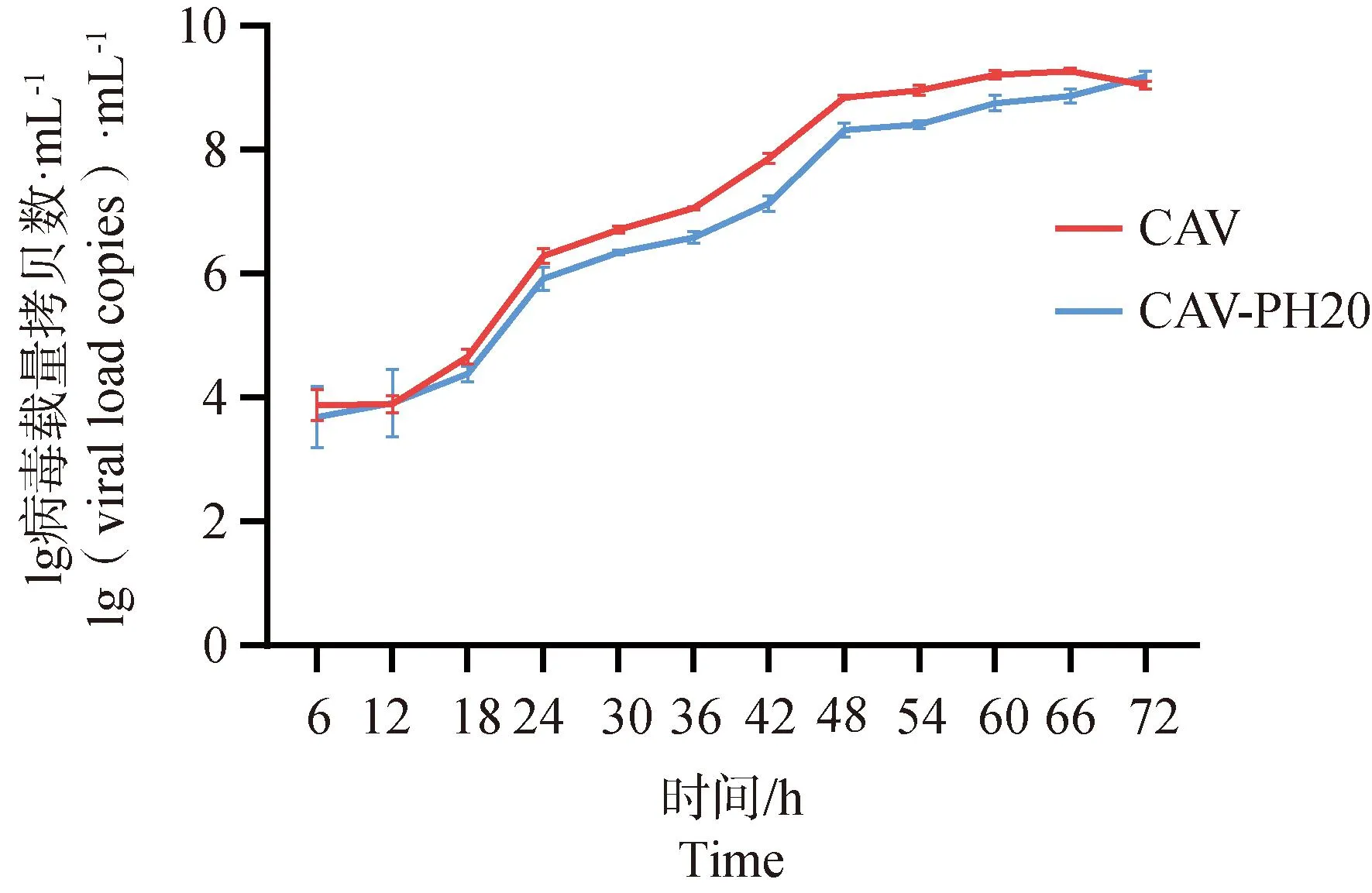
CAV. 接种CAV病毒的CAV组;CAV-PH20. 接种CAV-PH20的CAV-PH20组(PH20为SPAM1基因的别名)。下同CAV. Group infected with CAV virus, named CAV group; CAV-PH20. Group infected with CAV-PH20, named CAV-PH20 group(PH20 is the alias of SPAM1 gene). The same as below
2.7 外源蛋白表达间接免疫荧光IFA检测
以MOI=1接种6孔板培养的 MDCK-E1A,感染24 h后进行间接免疫荧光检测,结果显示,在没有接种毒的空白对照组中与绿色荧光指示的CAV-2和红色荧光指示的SPAM1均无反应。在接种亲本毒CAV-2的对照组中与绿色荧光指示的CAV-2有特异荧光反应且与红色荧光指示的SPAM1无反应。在接种重组病毒CAV-2-DelE3-SPAM1的实验组中与绿色荧光指示的CAV-2和红色荧光指示的SPAM1均有反应。且可以发现红色荧光指示的SPAM1有胞间弥散分布的特点,不完全被局限于病毒感染的细胞中(图4)。
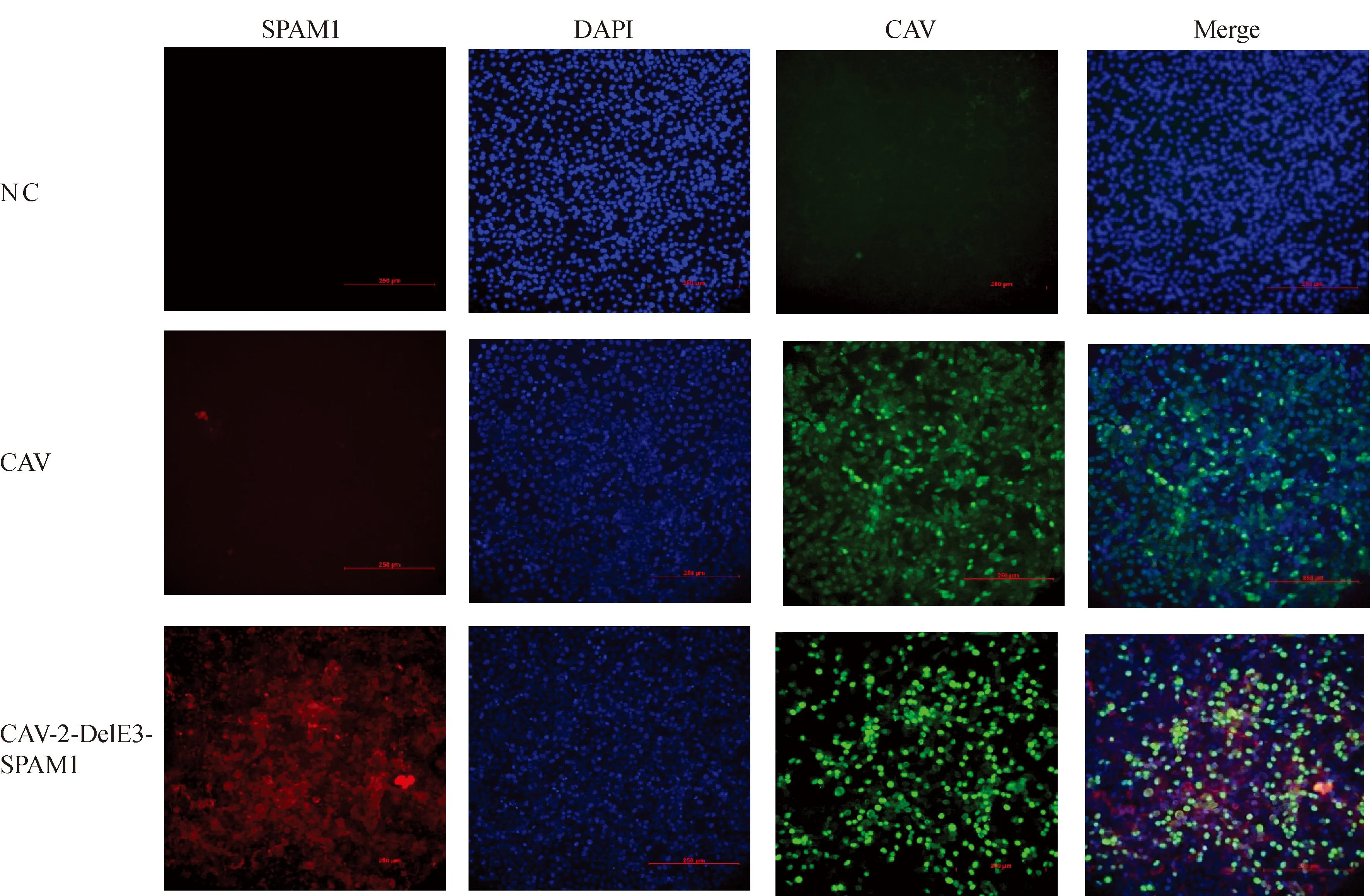
NC. 空白对照组;CAV. 接种原毒试验组;CAV-2-DelE3-SPAM1. 接种重组毒试验组;SPAM1. 重组基因抗体显色通道;DAPI.染核染料显色通道;CAV. 病毒结合抗体显色通道;Merge. 三通道融合显色图NC. Blank control group; CAV. Experimental group inoculated with the original virus; CAV-2-DelE3-SPAM1. Experimental group inoculated with the recombinant virus; SPAM1. Recombinant gene antibody color channel; DAPI. Nuclear dye color channel; CAV. Virus-binding antibody color channel; Merge. Three-channel fusion color image
2.8 重组溶瘤病毒体外溶瘤效应检测
如图5,显微镜明场下观察2D细胞杀伤模型和CCK8细胞杀伤检测试验可以发现,缺失E3区域表达外源基因SPAM1的重组溶瘤病毒对A72犬癌细胞系有强烈的溶瘤杀伤效应与野毒相比没有明显差异,且肿瘤细胞杀伤效应具有剂量依赖性(图6),说明重组改造没有影响腺病毒载体对肿瘤细胞的体外杀伤活性。在3D细胞模型上可以观察到接种野生型CAV毒株比起NC组细胞微球边缘弥散,微球长径略有回缩,说明野生型CAV毒株对A72 3D微球具有一定的杀伤效应。而CAV-2-DelE3-SPAM1重组毒比CAV野生型毒株显着减小了A72 3D细胞微球的体积。

下行图比例尺为均5 μm,3D细胞微球直径从左到右依次为:17.63、15.85、12.27 μmThe scale of the pictures on the lower line is 5 μm, the diameters of 3D cell microsphere from left to right are 17.63, 15.85, 12.27 μm, respectively
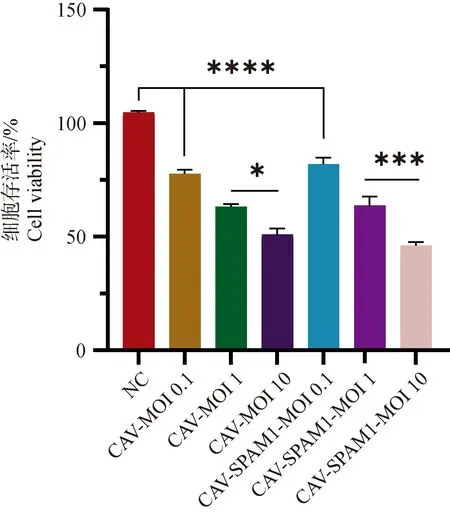
*. P<0.05,***. P<0.001
3 讨 论
溶瘤病毒为肿瘤治疗提供了更安全有效的治疗方法,某些天然的溶瘤病毒本身特异性靶向肿瘤细胞以及对人体的弱毒性均为溶瘤病毒治疗方案提供了安全保障[17]。但是单纯依靠天然溶瘤病毒去彻底杀伤清除肿瘤细胞是非常困难的。随着基因工程技术的发展以及对病毒基因结构和功能的深入了解,目前已经可以对天然病毒基因组进行编辑[17-18]。在病毒序列中插入外源基因,如Ma等[19]在单纯疱疹病毒中删除与病毒紧密关联的ICP34.5/ICP0基因,插入治疗基因GM-CSF(粒细胞巨噬细胞集落刺激因子),王立朋等[20]在流感病毒中插入PD1(程序性细胞死亡蛋白)序列等,获得对肿瘤具有多能效应的溶瘤病毒从而提高其溶瘤效果。当前应用的抗瘤外源基因,主要具有刺激抗瘤免疫应答、重塑肿瘤微环境、诱导肿瘤细胞凋亡等功能[21],从多方面加强溶瘤病毒的治疗效果。
SPAM1可以通过降解透明质酸,破坏肿瘤免疫逃逸物理屏障,重塑肿瘤微环境从而增加溶瘤病毒的瘤内扩散,以及促进树突状细胞激活肿瘤特异细胞毒性T细胞并促进Th1型免疫细胞的瘤内浸润从而提高抗肿瘤效果[22-25]。本研究首次采用犬腺病毒CAV-2作为溶瘤载体表达SPAM1蛋白,构建拯救的重组病毒CAV-2-DelE3-SPAM1能够高表达SPAM1蛋白,并且通过共定位关系可以发现SPAM1随着细胞裂解可以被释放并广泛分布于所有细胞间隙不局限于病毒感染的区域,这预示着在实体瘤中SPAM1可以随着弥散作用广泛作用于实体瘤的肿瘤微环境实现其促进抗瘤免疫效应的目的。在体外肿瘤细胞杀伤试验中可以观察到其对犬癌细胞系A72强烈的杀伤效果,与野生型毒株无显着差异。说明缺失E3区域和SPAM1外源基因的表达没有影响毒株对癌细胞的杀伤效率。进一步在3D细胞微球模型中可显着减低A72细胞微球体积,证明重组毒CAV-2-DelE3-SPAM1在实体瘤杀伤效应上有显着改善。
在Cloquell等[26]研究中使用CAV17进行临床试验治疗10只自发脑胶质瘤的患犬,无严重不良反应,仅有2只出现了疾病进行性进展,9只在外周血中检出了循环CAV17。在Martín-Carrasco等[27]的研究中使用CAV15进行临床试验治疗上皮源性的肿瘤患犬,有75%的患犬疾病被有效控制。在Cloquell等[26]和Martín-Carrasco等[27]的研究中均证明了犬腺病毒作为肿瘤患犬治疗手段具有广泛的安全性、有效性以及临床应用前景。在Kremer等[28]的研究中,证明了CAV2可以在体内体外对犬高发骨肉瘤产生有效的杀伤效应。CAV2作为一种病理生理学上类人Ad2、Ad5型腺病毒,若在犬肿瘤临床治疗上取得有意义的进展,通过比较肿瘤学,深入评估其对人源性肿瘤疾病的临床治疗应用前景[29],有望为解决人体内预存人源腺病毒抗体影响溶瘤病毒疗效以及难以重复治疗的问题提供新思路。
酶切连接的基因编辑技术连接效率较低并受限于天然病毒基因组单酶切位点的数量和位置不能进行病毒所有基因组区域的广泛编辑与改造,而且酶切连接由于酶切位点的限制不能实现无痕重组,非必要的碱基残留可能会影响病毒的生物学特性增加病毒的复制负担[30-31]。本研究使用RED/ET同源重组作为反向遗传操作的主要基因编辑技术,可以通过同源臂的设计实现在病毒全基因组的所有区域进行无痕插入,最大程度减少不必要的碱基接入,降低基因重组对病毒生物学特性的影响[32]。通过重组病毒一步生长曲线可以发现,由于外源基因的存在以及E3区域的缺失,野生毒株在54 h到达复制平台期而重组病毒则在72 h到达复制平台期,达峰时间延缓但病毒的最大增殖滴度未受影响,和野生型毒株一致。
在井汇源等[33]的研究中使用PRRSV作为病毒载体,在病毒基因的基因组稳定性评估中发现,随着连续传代外源基因表达量有逐渐降低的趋势并且最大病毒增殖滴度也低于野生型毒株。CAV-2是一种双链DNA病毒,具有稳定的病毒基因组不会发生与宿主基因组的整合事件,具有临床应用安全性与稳定性的优势。通过P1~P15的连续传代以及PCR检测可以发现,外源基因在重组病毒基因组中并未发生丢失、突变重组等事件,在P15代的间接免疫荧光试验中可以发现,外源基因的高表达没有因连续传代而丢失[34-35]。
4 结 论
本研究以CAV-2为亲本株成功构建缺失E3区域并表达外源基因SPAM1的重组CAV-SPAM1,该重组毒株具有对犬癌细胞系A72强烈的体外溶瘤活性。



