黄 杰,阮子豪,蔡 瑞
(西北农林科技大学动物科技学院 陕西省动物遗传育种与繁殖重点实验室,杨凌 712100)
精液保存技术极大推动了猪AI的应用范围,促进了生猪产业的发展[1]。与自然交配相比,AI不仅能够降低种公猪的饲养成本,还提高了良种利用率,打破了时空局限性。AI包括采精、稀释、保存和输精等多个环节,其中精液保存环节易受到细菌污染,对精子质量产生不良影响,从而降低受胎率,导致经济损失。因此,在精液稀释剂中添加抗菌剂来抑制细菌的繁衍是必要的选择。在“限抗禁抗”的大环境下[2],开发精液保存剂中抗生素替代品势在必行。抗菌肽作为生物体内的一种小分子肽,是免疫系统的重要组分,具有多种生物学功能[3]。相比于传统抗生素,抗菌肽具有分子量小、抗菌范围广、杀菌速度快和活性强等优势[2-4],因此被认为是新型抗菌药物的重要候选分子。本文综述了猪精液保存技术、猪精液细菌污染、抗菌肽的抑菌机制及其在猪精液常温保存中应用的研究进展,以期为抗菌肽产品与猪精液常温保存技术研发提供理论基础。
1 猪精液保存技术
种公猪精液保存根据保存温度可以分为常温保存(15~25 ℃)、低温保存(0~4 ℃)和冷冻保存(-79 ℃或-196 ℃)3种[5]。低温和冷冻保存可以有效抑制精液中有害菌群繁殖,减弱细菌群对精子的毒害作用[6-7],但低温和冷冻保存在生产实践中仍面临一些问题:1)公猪精液因富含不饱和磷脂,对低温非常敏感,易遭受冷休克的影响[8];2)设备要求较高,价格昂贵,市场上与之配套的试剂和设备也较少;3)与常温保存相比,低温保存会降低母猪产仔率20%~30%[9];4)冷冻解冻后的精子存活率和受孕率均较低,不能达到生产应用的要求[10-11]。因此,我国大多数规模化猪场在进行人工授精时选择常温保存的精液。
常温保存主要是利用弱酸环境抑制精子活动和代谢,减少能量的消耗,再恢复pH等环境条件又使精子复苏的原理来达到保存精液的目的[12-13]。在常温保存过程中,许多因素都会对精液品质造成影响,包括温度、pH、渗透压、微生物、稀释倍数和活性氧含量等[10]。由于常温保存精液受孕率高、投资少、人工操作方便,能带来较高的经济效益,因此在生产实践中利用常温保存的公猪精液进行人工授精已经得到了广泛的应用。
2 猪精液细菌污染
在精液采集和保存的过程中,细菌污染是一个普遍存在的问题[14-15],根据污染来源分为内源性污染和外源性污染。内性源污染是公猪的生殖泌尿系统、前列腺、附睾受到感染,细菌可通过公猪睾丸、副性腺、包皮等途径污染精液[16-17];而外源性污染由采精用具污染、添加剂污染、采精过程中的不当操作所引起,譬如公猪包皮清洗消毒不到位、粪便、皮毛、水源和空气等都有可能造成精液细菌污染[18-19]。研究表明,猪精液中的细菌种类繁多,来源广泛,如粪肠杆菌、大肠杆菌、铜绿假单胞菌、粘质沙雷氏菌和无乳链球菌等[20-21],其中大部分菌株都是由于卫生因素引起的[22-23]。因此,了解公猪精液中的细菌菌群及其抗生素耐药性,严格控制精液收集和处理设备的卫生对降低细菌污染尤为重要。稀释后的公猪精液本质上可以看作是一种细胞培养基,对细菌来说是一个理想的生长环境[16]。精子依靠精液中的营养成分进行正常的代谢活动,但在精液中存在的大量细菌会竞争环境中的营养物质,产生代谢废物,甚至可能引发精子凝集现象,最终会影响精子的寿命、质量和活力,从而降低精液保存的效果[10],并且使用受污染的精液配种会降低受胎率,导致出现胚胎早期死亡等母猪繁殖障碍[24]。因此,在制备精液稀释剂的过程中通过添加一定量的抗生素来防止细菌传播和保持精液质量。但盲目地使用高剂量的抗生素会导致细菌产生耐药性的问题[25],所以目前世界动物卫生组织(WOAH)和世界卫生组织(WHO)都在积极提倡规范、合理地使用抗生素,以降低对抗生素的依赖性。
近年来,为了避免过度使用抗生素,人们对抗生素替代物进行了大量研究,如以中草药提取物为代表的天然提取物和纳米颗粒等,发现这些替代物具有一定的抗菌效果[24,26-27]。作为猪精液抗菌剂应当满足以下要求:1)广泛的抗菌作用;2)对精子无毒性;3)不影响生育能力;4)高稳定性;5)在保存温度下仍具有较高活性;6)不易引起细菌耐药性;7)利于商业推广和应用[28]。
3 抗菌肽
3.1 AMPs的发展
AMPs是一类广泛存在于生物体内的小分子多肽,一般由10~100个氨基酸组成,是生物体先天免疫系统中重要的内源性防御分子之一,可有效抵御各种致病因子[29-31]。迄今为止,抗菌肽数据库已经收录了3 569种AMPs,根据其来源[32]可以分为(图1):1)植物源抗菌肽,如硫素、植物防御素;2)动物源抗菌肽,如天蚕素、防御素;3)细菌源抗菌肽,如细菌素;4)原生动物源抗菌肽;5)真菌源抗菌肽;6)古细菌抗菌肽;7)人工来源抗菌肽[33]。
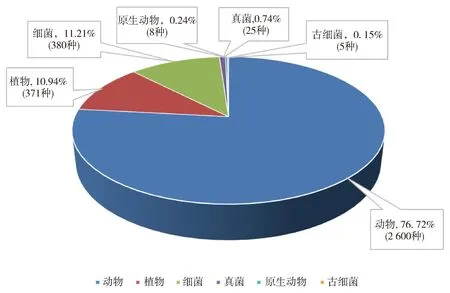
图1 天然抗菌肽的来源Fig.1 The sources of natural AMPs
目前AMPs的生产方式主要有3种:天然提取、化学合成和生物工程发酵。天然提取的抗菌肽主要来源于植物,但提取过程复杂且耗时长,产量有限。化学合成方法成本高昂,不适合大规模生产和广泛应用。相比之下,生物工程发酵利用发酵技术实现了规模化生产,且具备稳定的质量和较低的生产成本,被公认为是最佳的生产途径[34]。
随着氨基酸对AMPs活性影响的研究增多,发现通过更改或取代AMPs原有的非活性序列,可以获得具有更高和更稳定抗菌活性的AMPs衍生物[35]。而AMPs涂层、AMPs水凝胶、AMPs石墨烯、AMPs纳米粒等策略的出现,也为AMPs的应用奠定了坚实的技术基础[3]。如今,AMPs已经广泛应用于临床治疗、制药工程、食品加工、畜牧业生产、水产养殖、疾病预防、植物保护及美容养颜等多个领域[36-38]。
3.2 AMPs的抑菌机制
AMPs与作用于细胞内特定通路或受体的传统抗生素抑菌机制不同,大多数抗菌肽以细菌细胞膜为靶标,利用独特的理化性质破坏细菌脂质双层和诱导细胞内容物泄漏以产生抗菌作用,无需特定的受体,因此可以抑制细菌耐药性的产生[39]。不同抗菌肽的抑菌机制不同,根据现有的研究报道,可以大致将其分为细胞膜损伤机制和非膜损伤机制[40-41]。
3.2.1 细胞膜损伤机制 带正电荷的阳离子AMPs通过静电作用与带负电荷的细菌细胞壁相接触,并优先与细菌细胞质膜中的负电荷磷脂基团如磷脂酰甘油和心磷脂相互作用,取代稳定这些磷脂基团的二价阳离子,造成膜扰动[31-33]。抗菌肽普遍具有疏水性和两亲性结构,可以增加细胞膜的通透性,导致膜结构改变,破坏稳态,溶解细胞膜,促进内容物释放以实现抗菌功能[32]。细胞膜结构与成分的不同是AMPs选择性杀伤原核生物的一个主要因素[42]。与原核生物细胞不同,哺乳动物细胞膜外层脂质则主要由卵磷脂和鞘磷脂等两性离子磷脂组成,而且含有真核细胞所特有的固醇类物质,这类物质的存在可以提高膜的稳定性[43]。该机制也在一定程度上解释了AMPs可能是通过利用肿瘤细胞病变等真核细胞的膜脂质成分的改变或排列的变化来产生抑癌效果[44]。研究表明,抗菌肽的物理化学性质,如氨基酸序列、分子量大小、阳离子性质和两亲性等[45],在肽-膜相互作用中起着至关重要的作用,并决定其作用方式[40],目前认可度较高的有3种模型(图2):环形孔模型(toroidal-pore model)[46-47]、桶-板模型(barrel stave model)[48-49]、毯式模型(carpet model)[50-51]。因此,绝大多数抗菌肽可以与细胞膜相互作用,插入到膜中形成孔道或通道,破坏细菌膜的完整性,导致细菌溶解和死亡。
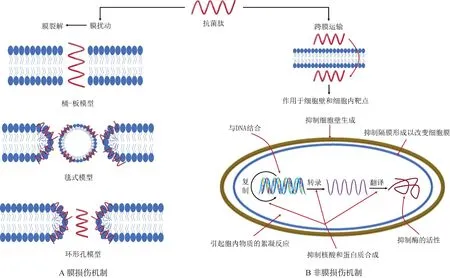
图2 抗菌肽抑菌机制Fig.2 The antibacterial mechanism of AMPs
3.2.2 非膜损伤机制 尽管AMPs的抑菌作用最初是由膜活性机制描述的,但近年来,人们已经了解到许多AMPs不同于与细胞膜相互作用的抑菌方式,主要有以下几种[52](图2):1)抑制细胞壁生成;2)与核酸物质相结合;3)抑制核酸或蛋白质合成;4)抑制酶的活性;5)引起胞内物质的絮凝反应;6)抑制隔膜形成以改变细胞膜。Omardien等[53]研究发现,AMPs中的杆菌肽(Bacitracin)和万古霉素(Vancomycin)可选择性地与脂质Ⅱ结合,干扰细胞壁成分肽聚糖(PGN)的生物合成,从而破坏细胞壁的完整性。布福林Ⅱ(Buforin Ⅱ)可以穿透脂质囊泡而不影响膜通透性,并与DNA和RNA结合来抑制细胞功能,从而导致细胞快速死亡[54]。鱼类抗菌肽pleurocidin的衍生物,在其有效抑菌浓度时可以抑制DNA和RNA的合成而不引起细胞膜的透化[55]。Upert等[56]研究表明,富含脯氨酸的抗菌肽(PrAMPs)通常具有高含量的脯氨酸和精氨酸残基,其主要通过抑制细菌蛋白质合成来影响细胞内活性。猪小肠抗菌肽PR-39可以通过阻止蛋白质的生物合成,诱导在DNA复制过程中的关键蛋白质降解,从而抑制细菌的繁殖生长[57]。来自牛和宽吻海豚的PrAMPs、bactenecin 7(Bac7)和Tur1A通过与核糖体相互作用来抑制翻译过程,阻断从起始阶段到伸长阶段的过渡[58-59]。阳离子抗菌肽Mel4能通过激活细菌内部的自溶酶来诱导细菌死亡[60]。Otvos等[61]发现,许多AMPs靶向于DnaK蛋白,抑制金黄色葡萄球菌细胞内酶的活性,导致蛋白质错误折叠和聚集,最终导致细菌死亡。此外,AMPs还能与脂多糖结合,并作为免疫细胞的化学引诱剂结合细胞受体,调节细胞因子和趋化因子的表达[62]。可见,部分抗菌肽可以抑制核酸、蛋白质和一些合成细胞壁和细菌生长的必需酶的生物合成来抑制甚至杀死细菌。
上述AMPs的抑菌方式与细菌细胞膜的结构和性质以及抗菌肽所含的氨基酸组成有着密不可分的关系。一般来说,抗菌肽的疏水性越强,膜干扰越强,细胞选择性越差;而电荷密度越高,肽与膜之间的静电作用越显着,对哺乳动物细胞毒性越弱[63]。
4 AMPs在猪精液常温保存中的应用
AMPs因具有优越的理化性质和独特的杀菌机制,一直以来备受学者的关注与青睐。在过去几十年中,越来越多的研究人员投身于AMPs的产品开发与应用之中[2]。AMPs在各个领域中都展现出了巨大的潜力,尤其在畜牧业生产方面得到了迅猛的发展。Schulze等[64]研究表明,猪精液稀释液中添加低浓度的环状六肽(4 μmol·L-1c-WFW)可以代替抗生素,且母猪产仔存活率达到了88.9%(表1),这使其成为极具前景的精液保存候选药物,具有重要的研究价值[65]。
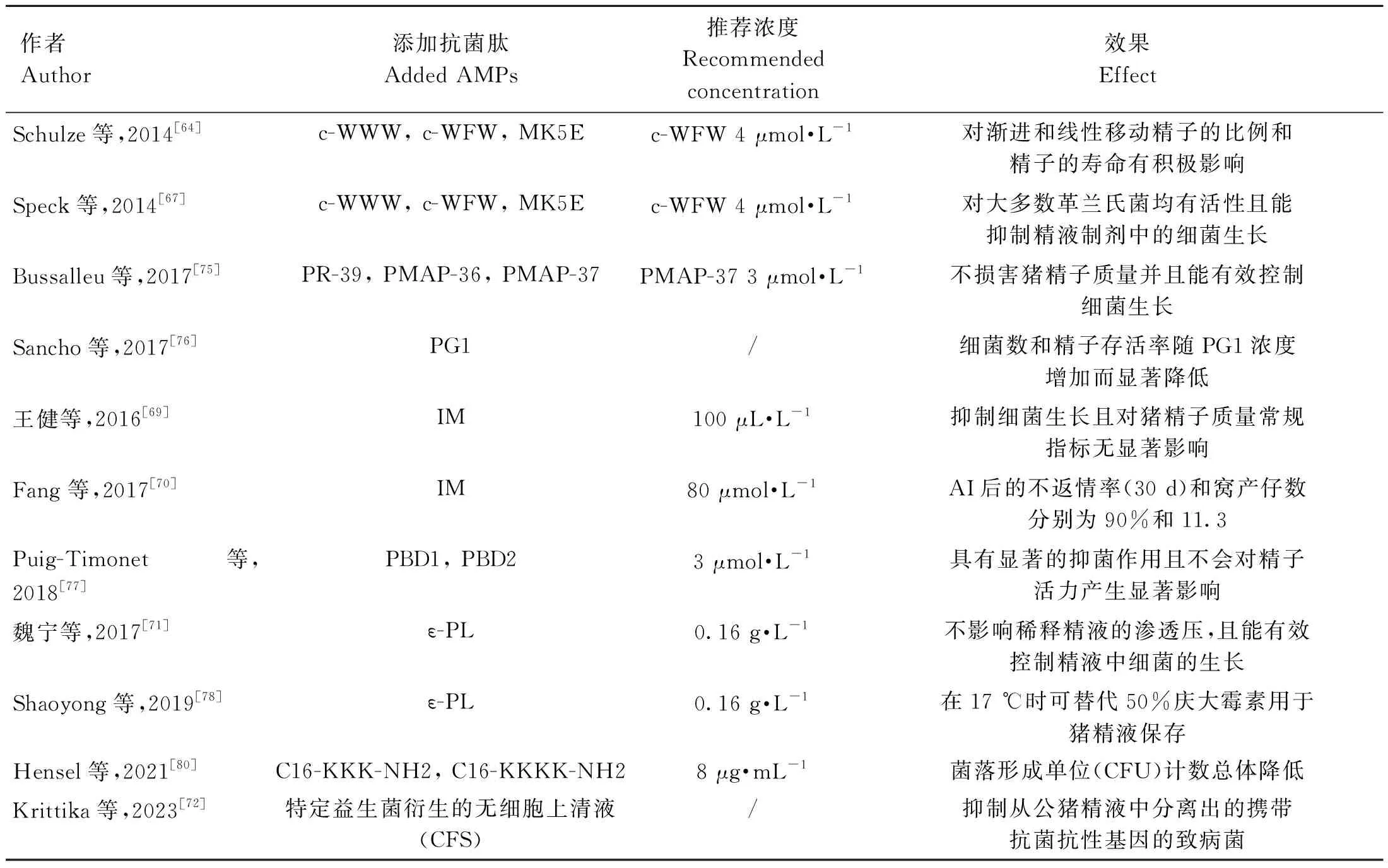
表1 抗菌肽在猪精液常温保存中的研究Table 1 Studies on the effects of antimicrobial peptides in preservation of porcine semen at room temperature
4.1 AMPs对常温保存过程中细菌的影响
在种类繁多的AMPs中,有研究称富含精氨酸(R)和色氨酸(W)的短环肽表现出高抗菌活性和对真核细胞的低毒性作用[66]。Speck等[67]通过体外试验验证了富含R和W的环状六肽c-WWW、c-WFW和一种螺旋magainin II酰胺类似物(MK5E)对2种革兰氏阳性菌和11种革兰氏阴性菌的体外抗菌活性,结果表明合成阳离子抗菌肽在体外对不同的革兰氏阴性和革兰氏阳性细菌绝大多数具有活性,个别菌种可能因为能够合成切割线性阳离子AMPs的蛋白酶而不受影响,如大肠杆菌、阴沟肠杆菌和金黄色葡萄球菌。Hensel等[68]研究发现,C16-KKK-NH2和C16-KKKK-NH2两种短抗菌脂肽不会对精子质量产生不利影响,且均导致菌落形成单位(CFU)计数总体降低,和对照比,革兰氏阳性杆菌减少40%,革兰氏阴性杆菌减少60%。王健等[69]和Fang等[70]研究表明,蛋氨酸碘(IM)可以抑制变形杆菌门和葡萄球菌属以及假单胞菌的增殖。魏宁等[71]发现,ε-聚赖氨酸(ε-PL)能够改变细菌的增殖和组成,可以有效控制精液中细菌的生长,提高关中黑猪精液的保存效果。2023年Keeratikunakorn等[72]研究报道了益生菌衍生的无细胞上清液(CFS)对从公猪精液中分离出的携带抗菌抗性基因的致病菌具有抑制作用,认为CFS含有的抗菌肽或细菌素成分抑制了精液来源的致病菌,但仍需要进一步的研究来确定该CFS中抗菌化合物的组成,来构建和合成这些AMPs。因此,抗菌肽在猪精液常温保存过程中可以通过细胞膜损伤机制和非膜损伤机制发挥抗菌作用,具有替代抗生素起到防止细菌污染的潜力。
4.2 AMPs对常温保存过程中猪精子质量的影响
公猪的精液品质是其繁殖力的基础,同时也是发挥公猪遗传性能的重要保障[73]。精液质量的好坏直接影响到猪场的配种受胎率、产仔数、健仔数和经济效益,猪精液保存期间所有工作的最终目标都是为了尽可能提高AI时使用精液的质量。AMPs对于猪精子的毒害作用,是猪精液保存过程中不可忽视的关键一环。Schulze等[64]发现,2 μmol·L-1的c-WWW和4 μmol·L-1的c-WFW能抑制精液制剂中的细菌生长,且4 μmol·L-1的c-WFW能够增强精子的线性运动;而MK5E(20 μmol·L-1和40 μmol·L-1)却对精子运动产生负面影响,这与Reddy等[74]研究报道的由蛙皮素(magainins)引起的精子活力降低的结论一致,说明肽的氨基酸组成在一定程度上决定了肽与精子的相容性。Bussalleu等[75]评估了富含脯氨酸和精氨酸的抗菌肽(PR-39)、猪髓系抗菌肽36(PMAP-36)和37(PMAP-37)3种AMPs对于精子的安全性,发现抑菌效果随AMPs浓度增加而显着增加,但精子活率随着AMPs的浓度增加而显着降低,这与Sancho等[76]对抗菌肽蛋白1(PG1)的研究结论一致,都表明了猪精子对肽的浓度和时间依赖性,因而需要选择合理的AMPs浓度才能保证抑菌效果和精液品质。Puig-Timonet等[77]揭示了猪β防御素-1(PBD1)和猪β防御素-2(PBD2)添加量为3 μmol·L-1时具有显着的抑菌作用,且不会对精子活力产生显着影响,在5 μmol·L-1时观察到两种肽的轻微杀精作用;PBD1和PBD2分别在3 μmol·L-1和5 μmol·L-1时对细菌生长的抑制作用最高,有必要进一步研究评估PBD1和PBD2在3 μmol·L-1对体内生殖性能的影响。Shaoyong等[78]研究表明,0.16 g·L-1ε-PL可显着改善精子活力、质膜完整性、线粒体膜电位和顶体完整性等精子质量参数。除此以外,Sancho等[76]发现适当的AMPs浓度能在发挥抑菌作用时,不会对渗透压和pH产生影响。Fang等[70]提出了80 μmol·L-1IM是最适添加浓度,同时验证了AI后30 d的不返情率和80 μmol·L-1IM组的窝产仔数分别为90%和11.3,但仍需要更多的研究来了解常温保存猪精液中IM的抗菌机制。综上所述,抗菌肽可以保护猪精子免受细菌污染和调节猪精子周围环境的免疫响应,维持猪精子的稳定性和活力,提高精液品质。
4.3 AMPs与抗生素的协同作用
肽和螯合产物之间的协同作用或肽与常规抗生素之间的协同作用,是微生物学中普遍的现象[79]。Speck等[67]与Schulze等[64]发现,c-WWW和c-WFW能够抑制精液制剂中的细菌生长,特别是与低浓度庆大霉素联合使用时,母猪繁殖力并未受到不良影响。魏宁等[71]和Shaoyong等[78]验证了将0.16 g·L-1ε-PL与0.125 g·L-1庆大霉素联合使用的抗菌效果与单独使用0.25 g·L-1庆大霉素的效果相似,0.16 g·L-1ε-PL能够通过降低细菌浓度和破坏细菌群落组成来改善精子质量参数、精子活力和体外受精能力,有望替代庆大霉素。
综上,AMPs已经在猪精液常温保存过程中展现出强大的抑菌作用,c-WFW、PMAP-37、IM、ε-PL、C16-KKK-NH2和C16-KKKK-NH2等AMPs已成为猪精液常温保存中减抗替抗的有力候选者。但由于膜成分和结构的特殊性,猪精子比一般的真核细胞更容易受到抗菌肽的影响,因此目前还需对有潜力的AMPs进行进一步的安全性评估[44,81-82],探究其与细菌和精子的互作机制,筛选、设计、合成出高抗菌活性和对精子的低毒性作用甚至无毒性的AMPs,才能进一步推动AMPs在精液保存领域的发展,早日实现AMPs作为猪精液稀释液添加剂在生猪产业上的应用[83-85]。
5 总结与展望
在猪精液常温保存过程中,细菌污染是不可避免的。随着细菌耐药性的增加以及禁抗政策的实施,我们亟需寻找精液抗菌替代品来抑制细菌的繁殖。抗菌肽具有分子量小、抗菌范围广、杀菌速度快和低耐药性等优点,因此将其应用于猪精液保存稀释剂中可为抗菌替代品研究提供新的思路。
随着合成生物学等新型交叉学科的快速发展,给抗菌肽的筛选、设计、合成提供新的研究思路与技术平台,使得抗菌肽应用于猪精液稀释剂以提高常温保存效果的研究具有广阔的应用前景。其中主要的可行的发展策略包括:1)利用计算机对抗菌肽结构进行分析,预测抗菌肽的抗菌活性、空间构象、突变体等性能,实现抗菌肽的高通量筛选,设计出兼具广谱抗性和低精子毒性的新型抗菌肽;2)基于合成生物学技术,利用CRISPR/Cas9等新型的基因编辑技术对天然抗菌肽基因进行定向编辑,例如增加、替换、删除某些氨基酸残基,减少抗菌肽对精子的毒性,增加抗菌肽的抗菌性能;3)筛选优化新型生物合成菌株系统,完善抗菌肽生物合成的工业化体系,简化纯化程序,降低生物合成成本;4)与现有抗生素联合使用,增强抗菌效果,避免耐药性,降低抗生素或抗菌肽的毒副作用;5)与纳米、生物、材料结合,提高抗菌肽稳定性,降低对精子的毒性;6)随着抗菌肽的发展,也应逐步完善抗菌肽的法律法规,从整体上改善我国的生猪养殖水平。



