和晓兰,赵艳坤,,孟 璐,刘慧敏,高姣姣,郑 楠*
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.新疆农业科学院农业质量标准与检测技术研究所农业农村部农产品质量安全风险评估实验室(乌鲁木齐)新疆农产品质量安全实验室,乌鲁木齐 830091)
金黄色葡萄球菌(Staphylococcusaureus,S.aureus),为革兰阳性菌,属于人畜共患致病菌,也是临床中最常见的致病菌。2021年全国细菌监测报告显示,纳入监测的细菌中,革兰阳性菌占28.9%,金黄色葡萄球菌在革兰阳性菌的分离率中排名第一,占革兰阳性菌的31.8%。甲氧西林耐药金黄色葡萄球菌的发生率近年来有所增加[1-2]。在我国,甲氧西林耐药金黄色葡萄球菌的平均检出率为29.4%。研究发现,从2010年到2021年的收集的糖尿病患者样本中有52%存在至少3种MRSA(耐甲氧西林金黄色葡萄球菌)危险因素[3]。Russell等[4]发现,巴西72%的病例中感染了MRSA。近年来,随着抗菌药物在养殖场所、食品保藏和临床上大量及不合理的使用,金黄色葡萄球菌对多种抗菌药物表现出了耐药现象。甲氧西林耐药金黄色葡萄球菌对青霉素、甲氧西林、苯唑西林等耐药[5],也对头孢菌素等β-内酰胺类抗菌药物耐药[6]。万古霉素是治疗甲氧西林耐药金黄色葡萄球菌的黄金药物,然而有许多万古霉素对甲氧西林耐药金黄色葡萄球菌的最低抑制浓度上升的报道[7-9]。异质性耐药可看成抗菌药物敏感菌株向耐药菌株转化的中间阶段[10],加强异质性耐药转变过程中的研究,有助于抗菌药物对致病菌的防治。异质性耐药细菌是指存在耐药亚群,其能够在至少8倍的最低抑菌浓度下生长,并且耐药亚群出现的频率大于10-7。本文简要综述了金黄色葡萄球菌异质性耐药的流行状况及机制,旨在加深对金黄色葡萄球菌异质性耐药的了解,并为其评估治疗方案和指导临床抗菌药物的合理使用提供参考。
1 异质性耐药的特点
异质性耐药最广泛的定义是存在异质性细菌种群,其中有一个亚群或几个亚群与主要种群相比表现出更高水平的抗菌药物耐药性[11]。异质性耐药的克隆性分为单克隆和多克隆。单克隆指的是细菌在高频率上分化出了敏感亚群和耐药亚群。在抗菌药物存在的情况下,异质性耐药群体中耐药亚群的比例增加,但当抗菌药物压力下降时,细胞又恢复到抗菌药物敏感状态,如图1[12]。在抗菌药物治疗期间,感染了耐药菌株,或感染致病菌后,经过抗菌药物的治疗,某些菌株产生自发耐药突变,都属于多克隆异质性耐药[11]。异质性耐药与耐药亚群的耐药水平有关,如果某些耐药亚群可以在比主要亚群的最低抑菌浓度高8倍的情况下生长,则认为该菌疑似存在异质性。定义异质性耐药的另一个因素是耐药亚群的出现频率,根据目前常用的检测方法,耐药亚群频率的检测限为10-7甚至更低[11]。异质性耐药分为稳定的和不稳定的,在连续传代培养的过程中,稳定的异质性耐药亚群最低抑菌浓度基本不变,不稳定的异质性耐药亚群最低抑菌浓度可能从耐药逐步恢复到敏感。
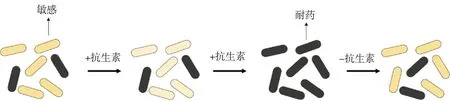
图1 单克隆异质性(改自参考文献[12])Fig.1 Monoclonal heteroresistance(Modified from reference[12])
2 异质性耐药的检测方法
目前,用于异质性耐药检测最常用的方法有肉汤微量稀释法、K-B纸片扩散法、E-test法和菌群谱型分析PAP法(图2)。随着生物技术的发展,出现了很多新型的检测方法包括全自动微生物鉴定药敏分离系统、液滴数字PCR[13]、等离子体胶体体耦合技术[14]、等离子胶质体偶联基质辅助激光解吸电离飞行时间质谱技术、拉曼光谱技术、DNA分子探针等。
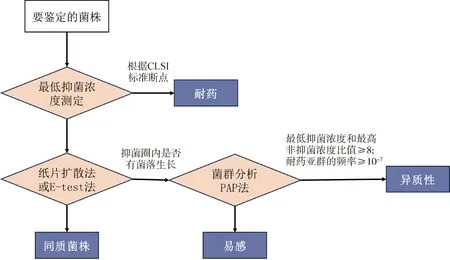
图2 金黄色葡萄球菌异质性耐药筛选方案Fig.2 Scheme for determination of heteroresistance of S. aureus
K-B纸片扩散法和E-test试纸条法是检测致病菌异质性耐药的初筛方法。操作简单,成本低,具有可重复性,可以灵活选择抗菌药物。但是存在较高的假阴性率,会导致异质性耐药菌株的漏检[13]。纸片扩散法[15]作为大多数细菌病原体的抗生素药敏试验的可靠方法,具有较完备的标准。改良的纸片扩散EUCAST法[16-17]具有较高的可重复性。Vitek 2自动化系统在7 h内就可得出耐药性结果,在对甲氧西林耐药性的检测中,具有高度的准确性[18]。菌群谱型分析PAP法是检测致病菌异质性耐药的确证方法,被认为是检验异质性耐药的黄金标准。然而典型的PAP方法成本高,既费时又费力。肉汤微量稀释法主要用于致病菌对抗菌药物最低抑菌浓度MIC值的测定。Zuill等[17]建立了改良的EUCAST酵母肉汤微量稀释MIC法。Spencer等[19]开发了电动肉汤微量稀释法,可在1 h快速完成检测。
目前,不断有新型快速的异质性耐药检验方法被开发出来,相比异质性耐药表型的检测,新型检测方法具有更高的准确度。Kim和Lee[20]开发了TaqMan单核酸多态性SNP基因分型测定法。Ding等[21]开发了噬菌体扩增试验的方法来间接定量检测目标细菌及其敏感性。高通量测序[22]和微滴式数字聚合酶链式反应[13]是检测异质性耐药的有效方法,但是存在较多的局限性。Price等[23]研究出固定化细菌细胞自动显微镜技术来鉴别菌株的耐药性。Gallois等[24]评估了基于微流控芯片技术和显微成像分析的快速抗菌药物药敏试验方法。等离子胶质体偶联基质辅助激光解吸电离飞行时间质谱可将生物体鉴定时间缩短1~1.5 d[25]。将细菌代谢活性与拉曼光谱结合可使抗菌药物快速筛选成为可能[26](表1)。

表1 异质性耐药检验方法对比Table 1 Comparison of detection methods for heteroresistance
3 金黄色葡萄球菌异质性耐药的流行情况
3.1 金黄色葡萄球菌对糖肽类抗菌药物异质性耐药的流行情况
随着万古霉素的广泛使用,金黄色葡萄球菌的敏感性逐渐下降,MRSA的发病率越来越高。金黄色葡萄球菌的异质性耐药研究常见于糖肽类抗菌药物,关于糖肽类的异质性耐药率被广泛报道,但其大都集中于临床医学方面。金黄色葡萄球菌对糖肽类抗菌药物的异质性耐药率在不同的研究之间有很大差异,从2.19%~25.9%(表2)。胡远芳等[27]从滨州医学院附属医院患者痰液中检出异质性耐药万古霉素中介金黄色葡萄球菌22株,检出率为8.4%,比刘彩林和明亮[28]从郑州大学第一附属医院临床分离株检测的17.9%低了两倍。Nam等[29]显示出韩国医院临床分离株万古霉素的异质性耐药率为20%,比意大利从血流、肺炎和皮肤结构感染患者分离的万古霉素异质性耐药率25.9%低。M等[30]显示出印度卡纳塔克邦医院糖尿病和非糖尿病患者对万古霉素的异质性耐药率为6.4%,这比Amberpet等[31]发现的印度医院临床分离株的异质性耐药率12.4%低两倍左右。Ramli等[32]显示出马来西亚医院患者分离株万古霉素的异质性耐药率为2.19%,比从我国黄河三角洲地区脓液、血液、痰液中分离到的异质性耐药率10.8%低五倍左右[33]。
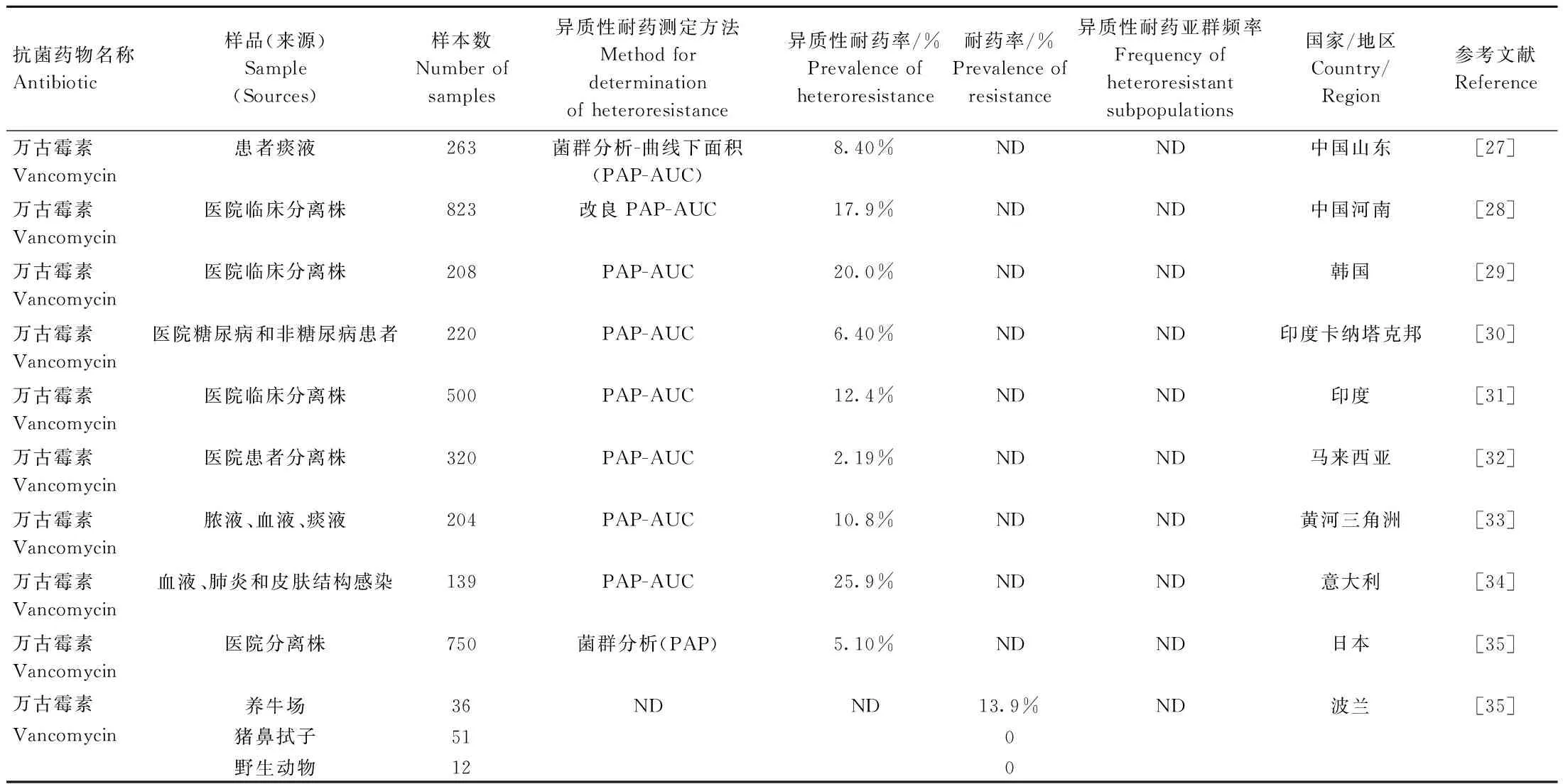
表2 金黄色葡萄球菌对糖肽类抗菌药物异质性耐药的流行情况Table 2 Prevalence of heteroresistance of S. aureus to glycopeptide antibiotics
3.2 金黄色葡萄球菌对β-内酰胺类抗菌药物异质性耐药的流行情况

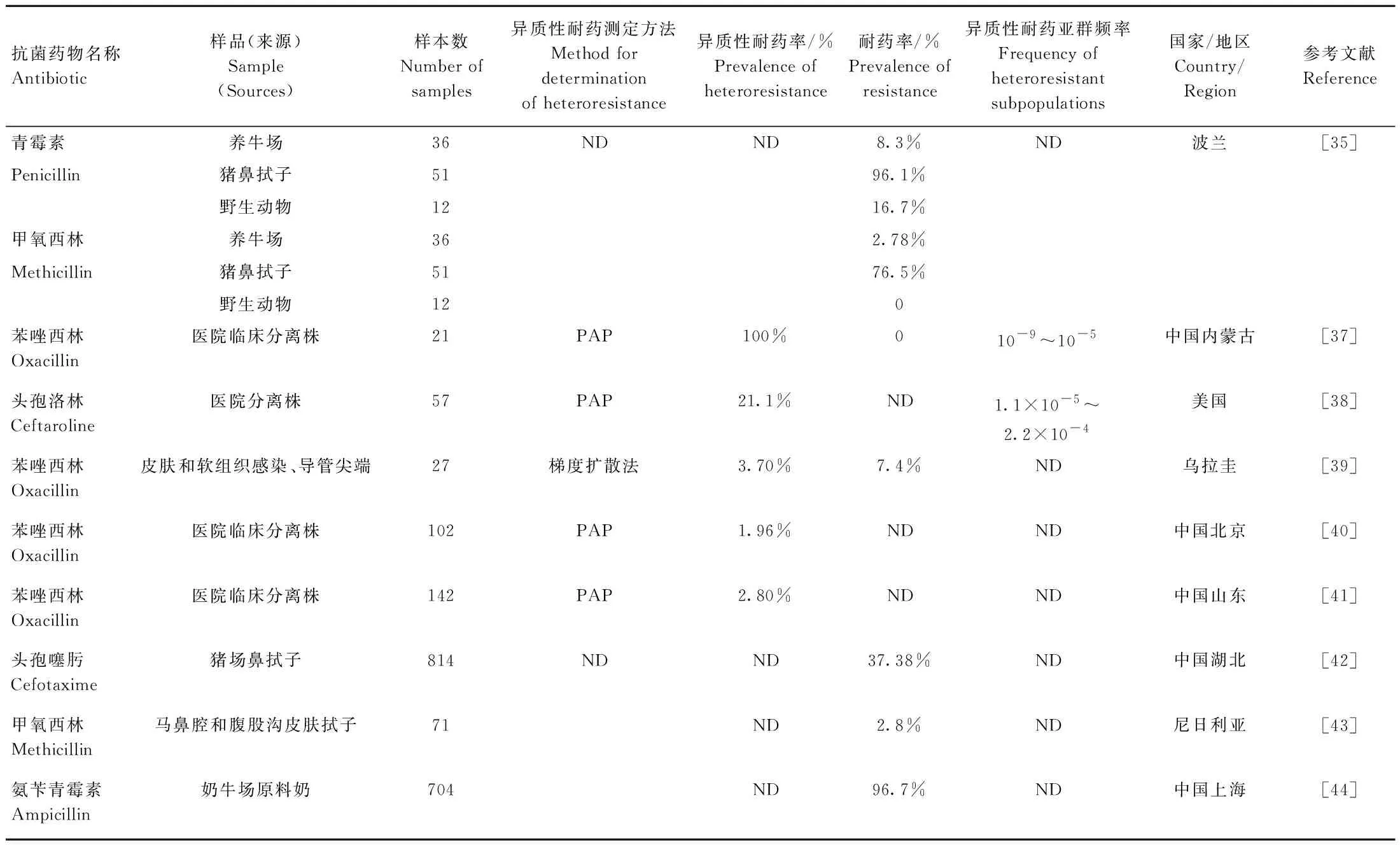
表3 金黄色葡萄球菌对β-内酰胺类抗菌药物异质性耐药的流行情况Table 3 Prevalence of heteroresistance of S. aureus to β-Lactam antibiotics
3.3 金黄色葡萄球菌对磺胺类抗菌药物异质性耐药的流行情况
磺胺类抗菌药物主要包括磺胺甲恶唑、磺胺异恶唑等抗菌药物。甲氧苄氨嘧啶/磺胺甲恶唑经常被用来治疗甲氧西林耐药金黄色葡萄球菌的感染。Xu等[42]研究显示,猪场鼻拭子样本中分离的金黄色葡萄球菌对复方新诺明的耐药率为100%。Huang等[44]发现,奶牛场的金黄色葡萄球菌对磺胺甲恶唑的耐药率为65%。Amare等[45]通过对街头售卖食品中的细菌病原体进行分离鉴定,发现金黄色葡萄球菌是分离频率最高的分离株,经药敏试验发现甲氧苄氨嘧啶-磺胺甲恶唑是对所有分离株均有明显抗菌效果的药物之一。随着磺胺类药物的广泛使用,Sato等[46]报道了医院临床分离株金黄色葡萄球菌对甲氧苄氨嘧啶/磺胺甲恶唑耐药的风险。Nurjadi等[47]从来自医院临床分离株的马血琼脂平板上观察到了甲氧苄氨嘧啶/磺胺甲恶唑异质性耐药菌株。Nakipolu等[48]发现医院临床分离株甲氧苄氨嘧啶-磺胺甲恶唑的耐药性。Wang等[49]发现巴氏杀菌牛奶样品的金黄色葡萄球菌对甲氧苄氨嘧啶-磺胺甲恶唑的耐药率为71.4%。目前,关于磺胺类异质性耐药的研究在临床方面非常少。在动物源方面,大多与耐药率有关,还没有深入到异质性耐药的研究。
3.4 金黄色葡萄球菌对其他抗菌药物异质性耐药的流行情况
我国研究异质性耐药的抗菌药物的种类很多,包括四环素类、喹诺酮类、氨基糖苷类、大环内酯类等,异质性耐药率为0%~73.7%(表4)。Xu等[42]经过猪鼻拭子四环素、庆大霉素、环丙沙星和氯霉素异质性耐药的检测,显示其耐药率分别为93.46%、34.58%、24.30%和100%。Mutu等[50]显示医院临床分离株的莫匹罗星异质性耐药率为27.7%,异质性耐药亚群的频率为10-9~10-8。Bai等[51]显示医院临床分离株氨甲基环素的异质性耐压率为7.98%,对氨甲基环素的异质性耐药率为20.73%。陈东科等[52]结果显示医院临床分离株红霉素的异质性耐药率为73.7%。
表4 金黄色葡萄球菌对其他抗菌药物异质性耐药的流行情况Table 4 Prevalence of heteroresistance of S. aureus to other antibiotics
4 金黄色葡萄球菌异质性耐药机制
4.1 对糖肽类抗菌药物异质性耐药机制
糖肽的异质性耐药还没有直接与特定的机制相联系[11]。异质性耐药可能是由于细菌在生长过程中产生了突变,这些不稳定的突变可以由点突变、插入序列和小缺失引起,这些突变在遗传上是稳定的,但具有很高的适应度成本,在没有抗菌药物压力的情况下,高适应成本是选择第二位点代偿性突变的驱动因素,补偿突变有助于降低适应成本[11]。Liang等[33]认为,万古霉素能与D-丙氨酸-D-丙氨酸末端结合形成复合体,进而阻止转肽和转糖基化,导致在细胞壁合成过程中不完全或无效的肽聚糖交联。Yamakawa等[35]发现hVISA(万古霉素中介金黄色葡萄球菌)菌株具有非同义突变。Hu等[54]发现58%的hVISA菌株存在Agr功能障碍,具体机制见图3。Katayama Y等[56]研究显示,实验室突变株含有1个突变的vraS,导致氨基酸替换,与临床hVISA表现出相似的表型,说明额外的突变机制可能是导致hVISA表型进化的原因。Howden等[57]在Walk突变体的假定运输基因中检测到了两个潜在的代偿突变。Shu等[58]认为内源性S-亚硝化可以诱导转录信号绕过万古霉素的作用,是调节金黄色葡萄球菌对万古霉素耐药性的关键机制。
图3 参与金黄色葡萄球菌生物膜形成调节的相关基因(改自参考文献[59])Fig.3 Related genes involved in the regulation of S. aureus biofilm formation(Modified from reference[59])
4.2 对β-内酰胺类药物异质性耐药机制
目前,关于β-内酰胺类异质性耐药的研究大多集中在革兰阴性菌中,而在革兰阳性菌中研究相对较少。在金黄色葡萄球菌的治疗过程中,β-内酰胺类药物经常被用到,但随着MRSA菌株的流行,金黄色葡萄球菌开始对β-内酰胺类抗菌药物耐药[39]。对于其异质性耐药机制的研究,存在很多关于mecA基因编码青霉素结合蛋白PBP2a产生的增加导致对甲氧西林耐药的说法[60],具体机制见图4。造成异质性耐药的另一个可能机制是转录调控因子的失活[61]。β-内酰胺类药物通过抑制青霉素结合蛋白,进一步影响细胞壁的肽聚糖合成从而发挥抗菌药物作用[62]。Sasaki等[63]研究显示青霉素结合蛋白中的突变赋予了临界MRSA菌株对苯唑西林的耐药特性。Proulx等[64]认为在甲氧西林敏感表型向甲氧西林耐药金黄色葡萄球菌转化过程中,会出现以重复核苷酸延伸为特征的序列突变。Liang[65]等发现mecA基因的第二个启动子的错义突变和单取代突变都可以使苯唑西林和头孢西丁敏感的SA分离株变为隐形耐药的MRSA。

图4 由4种 PBP 酶(PBP 1-4)完成的甲氧西林敏感金黄色葡萄球菌中肽聚糖生物合成(改自参考文献[62])Fig.4 Peptidoglycan biosynthesis in the methicillin-susceptible S. aureus is accomplished by four PBP enzymes (PBPs 1-4) (Modified from reference[62])
4.3 对磺胺类药物异质性耐药机制
磺胺类药物的异质性耐药机制往往与耐药突变和适应性降低有关(图5)。Sato等[46]在体外复方新诺明暴露实验中发现耐药株突变。金黄色葡萄球菌小菌落变异株对SXT的敏感性降低,通常涉及胸腺嘧啶核苷、甲萘二酮或氯化血红素营养不良[47]。Clarke等[66]发现,复方新诺明介导的DNA损伤可能导致耐药菌株的出现。有些异质性耐药基因突变与小菌落变异表型相关,这种耐药突变体在没有抗菌药物作用时,会选择增加适应性和敏感性的代偿突变[11]。Kriegeskorte等[67]发现复方新诺明在短期暴露后诱导了胸苷依赖性耐药小菌落变异体表型。
图5 点突变、插入序列和小缺失引起的异质性耐药(改自参考文献[11])Fig.5 Heteroresistance caused by point mutations, insertion sequences and small deletions(Modified from reference[11])
4.4 对其他抗菌药物异质性耐药机制
对其他抗菌药物的异质性耐药机制主要涉及两方面,一方面与抗菌药物的外排或内流有关,很多研究报道外排泵的增加、外排相关基因上调、磷霉素内流、孔蛋白编码基因表达减少、外排泵过表达等都有助于异质性耐药表型的形成,另一方面与点突变、插入序列、小缺失等引起的耐药突变有关[11],具体机制见图6。Mutu 等[50]发现,突变是导致金黄色葡萄球菌莫匹罗星异质耐药的关键机制。Bai等[51]发现支链氨基酸转运系统II 载体蛋白和 Na/Pi 协同转运蛋白家族蛋白和基因的过表达有助于奥达环素异质性耐药的产生。陈东科等[52]发现,金黄色葡萄球菌对红霉素呈现异质性耐药,且检出ermA基因。虞培娟等[68]发现1株菌出现了“G”-“T”点突变。Wang等[69]发现Na/Pi 协同转运蛋白和支链氨基酸载体蛋白可以促进金黄色葡萄球菌的二氢四环素异质性耐药。
图6 主要促进因子超家族多药外排泵的离子驱动反转运机制(改自参考文献[70])Fig.6 Modulation of MFS efflux pump by efflux pump inhibitors (EPIs) in S. aureus(Modified from reference[70])
5 小 结
异质性耐药的本质是对抗菌药物敏感的菌株,其亚群对于抗菌药物存在不同的反应,即大多数亚群对抗菌药物敏感,而少部分亚群出现对抗菌药物耐药的情况。目前,对猪源、牛源金黄色葡萄球菌的研究仍然局限于抗菌药物耐药性和分子流行病学,缺乏对于异质性耐药和更深层次的研究。因此,牧场和养殖场中金黄色葡萄球菌的耐药情况和异质性耐药流行情况更应该引起重视,以防止耐药和多重耐药的广泛传播。



