张少华,王 帅,邹 扬,刘仲藜,才学鹏
(1.中国农业科学院兰州兽医研究所 动物疫病防控全国重点实验室,兰州 730000;2.甘肃农业大学动物医学院,兰州 730070)
捻转血矛线虫(Haemonchuscontortus)是一种严重危害反刍动物健康的土源性线虫;分类上隶属于圆线目(Strongylata)、毛圆科(Trichostrongylidae)、血矛属(Haemonchus)[1]。该线虫具有致病力强、繁殖力高和嗜血量大的特性;当寄生于羊皱胃内可引起捻转血矛线虫病,又称“捻转胃虫病”,对羔羊危害最为严重[2-3]。该病在我国牧区感染率高达90%[4-5],已被列为三类动物疫病。捻转血矛线虫生活史无需中间宿主,虫卵在外界约需7 d发育为第三期(L3)感染性幼虫;L3幼虫被宿主食入后经2次蜕皮在皱胃发育为成虫(图1)。感染潜伏期为18~21 d;此期间因L4幼虫口囊有矛状齿,感染11 d左右已开始损伤宿主黏膜引起出血。据估算,每条成虫每天吸血量约50 μL;感染2 000条成虫的病羊日失血量至少100 mL;且每条雌虫日产卵5 000~15 000枚,可持续生产大量L3幼虫,过度污染草场和牧场环境,严重影响羊只生产性能和健康,对养羊业造成重大经济损失[6-8]。
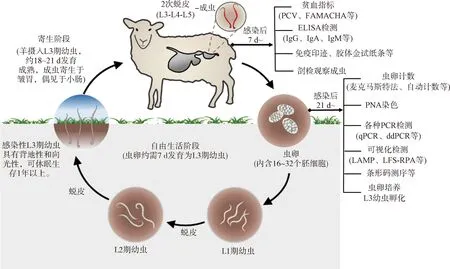
图片修改自https://www.scops.org.uk/internal-parasites/worms/species-and-lifecycles/。PCV. 血红细胞压积;FAMACHA. 贫血检测卡片;PNA. 花生凝集素;qPCR. 实时荧光定量PCR;ddPCR. 微滴数字PCR;RPA-LFS.重组酶聚合酶扩增-侧流层析试纸条The figure modified from https://www.scops.org.uk/internal-parasites/worms/species-and-lifecycles/. PCV. Packed cell volume; FAMACHA. Faffa Malan chart; PNA. Peanut agglutinin; qPCR. Real-time PCR; ddPCR. Droplet digital PCR. RPA-LFS. Recombinase polymerase amplification-lateral flow strip图1 羊捻转血矛线虫生活史及相关检测方法Fig.1 The typical life cycle and some related detection approaches for Haemonchus contortus in sheep and goats
羊捻转血矛线虫病防控暂无安全长效疫苗可用,药物防控仍是相对有效的方法,但存在严重的耐药性和药物残留问题[9]。可靠、准确的检测手段对该病感染诊断和判断驱虫时机至关重要;同时在流行病学调查、耐药性监测及减少牧场环境污染等方面都发挥着关键作用[10-11]。目前可通过临床检测、病原检测、血清学检测及核酸检测等方法对该病进行感染性诊断和耐药性监测[10]。常用方法包括贫血检测卡片(Faffa Malan chart, FAMACHA)、粪便虫卵计数(faecal egg count,FEC)、酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)、聚合酶链式反应(polymerase chain reaction, PCR)、环介导等温扩增(loop-mediated isothermal amplification,LAMP)、重组酶聚合酶扩增(recombinase polymerase amplification, RPA)及测序技术等(图1)。本文综述了国内外报道的各种羊捻转血矛线虫病检测技术,并对各种方法优缺点和应用价值进行了比较分析;同时探讨了未来诊断技术发展趋势,以期为我国羊捻转血矛线虫病综合防控策略提供科学信息和技术参考。
1 临床诊断依据
临床症状和流行病学分析是进行寄生虫病初步诊断的重要依据。捻转血矛线虫在世界各地均有流行,与气候和季节有密切关系。我国牧区5~6月和8~10月为感染高峰期;此阶段适宜幼虫发育,哺乳期母羊及羔羊易于感染[3-4]。该病发病率和死亡率取决于L3幼虫的摄入量,临床表现为超急性、急性和慢性感染;最显着的特征是衰弱和贫血,伴随消瘦、皮下水肿、可视黏膜苍白、腹泻等症状,严重感染时可致死[10,12]。
2 贫血检测
捻转血矛线虫虫体负荷与宿主贫血存在显着的相关性[13];病羊一般在感染14 d之后出现明显贫血。国内外已报道通过测定血红细胞压积(PCV)、观察结膜颜色及检测粪便血红蛋白(haemoglobin,Hb)等快速评价羊群贫血的严重程度。
2.1 PCV测定
PCV下降表明动物有贫血风险,但无单一的PCV参考值。目前公认PCV值≤15%为捻转血矛线虫严重感染指标,需要进行驱虫治疗[14-15]。PCV值也不能单独作为诊断捻转血矛线虫的有效参数,常与其他方法联合使用。
2.2 FAMACHA卡片
贫血检测卡片(Faffa Malan chart, FAMACHA)是一种通过观察羊只结膜颜色评估贫血程度的简单临床工具,在热带或亚热带流行区应用较广。卡片按1~5进行评分,1和2(红色或粉红色)为无贫血;3(浅粉色)为轻度贫血;4(粉白色)为贫血;5(苍白)为严重贫血[14,16]。因FAMACHA和PCV有较好的相关性,国外学者多采用联合分析进行羊群感染状况调查[17];但标准设定对特异性和敏感性有影响,如设定卡片评分为3~5,不同PCV阈值下检测敏感性为91.2%~94.6%,特异性为30.1%~31.9%;而设定评分4~5,敏感性降低为30.8%~48.7%,特异性明显提高为77.6%~79.8%[18]。FAMACHA卡片实用性强,对绵羊和山羊贫血均有较好的检测效果,结合其他技术可在现场对病羊进行选择性驱虫治疗。缺点在于诊断羔羊贫血敏感性低,严重依赖于操作人员的经验,检测费力,需进行专门技术培训。
2.3 粪便潜血(fecal occult blood,FOB)检测
羊感染捻转血矛线虫11 d左右的粪便中出现FOB;因此,通过检测FOB可评估绵羊感染捻转血矛线虫的严重程度。Colditz和Le Jambre[19]使用拜耳潜血试剂盒检测绵羊粪便样本中FOB,当每克粪便虫卵数(EPG)>2 000,其敏感性和特异性分别达92.0%和94.2%;该方法可作为羊群严重感染发病的预警指标。Rodríguez等[20]用不同品牌试纸条检测羔羊感染11 d粪便中均含FOB,而PCV从感染18 d开始降低。FOB检测快速经济,对重度感染动物检测精确度高,检出时间较FEC提前至少7 d,可作为现场吸血线虫感染的初筛检测方法。但需与其他肠道出血性疾病鉴别。
2.4 光谱法
Kho等[21-22]证明近红外光谱(visible-near infrared spectroscopy,NIRS)能够检测和量化绵羊粪便中的Hb;设定驱虫治疗阈值为3 μg Hb·mg-1粪便时,建立的偏最小二乘回归模型预测精度良好,灵敏度57%~94%,特异性44%~79%,可成功区分健康与需要驱虫治疗的绵羊粪便样本。Santos等[23]用便携式NIRS仪采集了216只羔羊的血液光谱数据,建立了主成分分析-线性判别分析分类和诊断模型,灵敏度为93.3%,特异性为73.2%,准确度达82.8%。NIRS优点为快速便携和无损无创,准确性和敏感性较高;可用于羊群Hb实时监测、早期感染诊断和驱虫治疗的评价;但仍需进行相关多变量分析来提高粪便Hb的预测精度。
3 病原学检测
病原学检测是确诊捻转血矛线虫病或作为评价其他检测方法的“金标准”。通用的检测方法包括FEC、幼虫孵化和死后剖检等,在基层应用较为广泛。病原学检测相对费力耗时,诊断效果取决于虫体感染强度、流行率和样本制备质量。
3.1 虫卵检查
3.1.1 粪便虫卵计数(FEC) FEC为估计羊捻转血矛线虫感染强度、判断驱虫效果及耐药性的标准方法。通常在感染后21 d的羊粪中能检测到虫卵,该法适用于流行率高或感染强度高的地区使用。世界兽医寄生虫学促进协会(World Association for Advencement of Veterinary Parasitology,WAAVP)推荐检测方法为麦克马斯特法[24];即将羊粪与饱和盐水(比重1.2)混匀,吸取少量粪液注入计数室,在低倍镜下计数虫卵,以每克粪便虫卵数(eggs per gram,EPG)进行定量。镜下观察虫卵约(75~95)μm×(40~50)μm,椭圆形,内含16~32个胚细胞,一端或两端有新月形的空隙[3]。羔羊FEC与捻转血矛线虫成虫负荷有较好的相关性,国外相关指南确定每只羔羊粪便检出50~350 EPG为轻度感染;400~600 EPG为中度感染;650~1 000 EPG以上为严重感染;发生中度感染时须采取针对性驱虫治疗[25]。此外,WAAVP推荐采用粪便虫卵减少实验(faecal egg count reduction test,FECRT)作为线虫耐药性评价的标准方法;其主要依据驱虫前后粪便的虫卵减少率对阿苯达唑、伊维菌素等广谱驱虫药进行耐药性评价,一般以虫卵减少率<95%且置信域下限<90%判定存在耐药性[24,26]。虫卵检查简便易行,成本较低,结果可靠;但耗时费力,需要专业的实验室技术人员;诊断灵敏度低,不能鉴别毛圆科线虫虫种。
3.1.2 虫卵自动化分析技术 20世纪90年代初,新西兰研究者开发出名为“FECPAK”的便携式绵羊粪便虫卵计数系统;其原理与麦克马斯特方法相似,灵敏度可达30 EPG[27]。目前已更新为在线FECPAKG2远程诊断平台,主要基于数字成像捕获粪便虫卵图像并存储在互联网上,由专家进行远程分析和鉴定,提交后2 h内提供FEC结果;灵敏度为35 EPG;在欧美、澳大利亚、新西兰等羊场应用广泛[28-29]。该平台无需显微镜或专业技术人员及复杂培训,具有良好的检测准确性和较强的实用性等优点;但其诊断灵敏度有限,不适合在线虫中低流行区进行检测。
3.1.3 PNA结合试验 PNA特异性结合捻转血矛线虫虫卵表面的糖类物质[30];利用这一特性可快速对血矛线虫病进行风险评估。采用异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记PNA后染色虫卵进行鉴定,方法重复性较好;虫卵数量与幼虫培养相关性较高,与荧光值也高度相关,具有较高的特异性[31-32]。此外,也可用不同植物凝集素鉴别毛圆科线虫虫卵[33]。PNA法无需特殊鉴定技能;局限性为实验室要求配备荧光显微镜,染色之前虫卵需纯化,步骤繁琐、耗时,结果难以量化,不适于进行大量粪便样本检测。
3.2 幼虫鉴定
L3期幼虫培养和鉴定是流行病学研究和确定传播动态的一个重要方面[34]。主要对粪便中的线虫虫卵进行种水平的鉴别,常规方法是收集新鲜粪便样品,置于25 ℃的恒温箱内培养7 d,幼虫孵化后利用贝尔曼法收集L3期幼虫;加卢戈氏碘液致死后,观察其典型特征进行虫种鉴定。L3幼虫大小约(730±75)μm,尾鞘长,肠管由16个长方形肠细胞所构成[3,35]。此外,培养结果受多种因素的影响,如粪样冷藏可抑制捻转血矛线虫虫卵的孵化和发育[36]。该方法缺点是检出率低,操作费时费力,需7~10 d;还需专业人员分析幼虫形态差异,判定存在主观误差,不适于大规模调查和监测。
3.3 剖检法
剖检病死羊可快速、直观和准确地确诊线虫感染[7,10]。急性典型病例者有严重贫血,黏膜苍白,腹水和下颌水肿;胃黏膜水肿,有瘀点及血液渗出;皱胃表面可见大量毛发状成虫;体型很大,雄虫一般为2.5~3.0 cm,雌虫1.6~3.2 cm;雌虫有典型的麻花状外观,即吸血后的红色肠管与白色卵巢捻成红白相间,雄虫吸血后可呈淡红色[37]。严重感染羊体内成虫数量可达2 000~20 000条不等。林琳等[38]对福建省内221只送检山羊采取完全剖检法调查山羊捻转血矛线虫的感染率为65.6%。剖检法费时费力,仅用于羊只死后诊断。
4 免疫学检测
捻转血矛线虫感染的检测常采用ELISA、免疫印迹试验(Western blot)、胶体金检测试纸条及对流免疫电泳(counter immuno-electrophoresis, CIEP)等方法[39-41]。这些方法可以检测血清中的IgG、IgA和IgE等不同类型的抗体,以确定感染的时间和程度。其中ELISA一般在感染后7 d即可检出抗体,敏感性较高,是进行羊群早期感染大规模筛查的首选血清学诊断方法之一。
4.1 ELISA
4.1.1 血清IgG抗体检测ELISA 早期研究中,国内外学者主要采用捻转血矛线虫成虫粗抗原(crude somatic antigens,CSA)、可溶性抗原或代谢分泌产物(excretory secretory products,ESP)建立间接ELISA或斑点ELISA(Dot-ELISA),最早可检测出感染后4~7 d绵羊血清中的特异性抗体,敏感性介于80%~100%,特异性介于21.4%~82.7%[39,42-43]。张雪娟等[44]采用Dot-ELISA可检出荷虫量为1~338条的羊血清或羊血纸抗体,与剖检法检测符合率高达100%。此外,研究报道纯化的ESP检测敏感性高于粗制ESP;幼虫抗原优于成虫抗原,检测绵羊和山羊血清的敏感性分别为96.6%和100%,特异性分别为47.4%和71.2%[45-46]。基于天然抗原的ELISA主要缺点是虫体抗原不易质控,交叉反应严重等。
为克服以上问题,研究者又制备了ESP来源的重组抗原,如原肌球蛋白rHc-TpMy、黏附调节分子蛋白rHCADRM和Ras结构域蛋白rHcRas等,均可检测到感染后14 d的血清抗体,交叉反应大幅度降低或消失,特异性有所提高。据报道rTpMy ELISA敏感性为90%,特异性为100%[47]。rHcADRM ELISA和rHcRas ELISA敏感性分别为90.6%和87.5%,特异性分别为93.8%和90.6%;2种方法检测51份山羊血清的阳性率分别为19.6%和17.6%,均高于粪检结果;与剖检符合率分别达100%和98.0%[48-49]。重组抗原ELISA优势在于抗原容易获得和标准化,但目前仍处于实验室研究阶段,尚无商品化试剂盒。
4.1.2 IgA和IgE抗体检测ELISA IgA和IgE是羊只自然感染捻转血矛线虫的免疫标志物,对感染诊断、免疫效果评估及抗病育种具有参考意义。Kooyman等[50]建立了绵羊IgE夹心ELISA,检测感染14~28 d绵羊血清总IgE显着升高。此外,羊感染期间皱胃黏膜中可检测出较高水平特异性IgA,且与虫体负荷呈负相关[51]。Salgado等[52]利用L3期幼虫抗原ELISA检测自然感染14 d羔羊的唾液IgA水平与EPG呈显着负相关,可用以区分易感和抗病羔羊。虽然胃黏膜中IgE和IgA抗体水平高,测定可靠,但其受性别、品种等多种因素影响,对病羊生前诊断的意义不大,应用有限。
4.1.3 抗原检测ELISA 利用特异性抗体可从蠕虫或粪便悬液中捕获线虫特异性的抗原成分。Ellis等[53]利用单克隆抗体E2建立了抗原捕获ELISA,可特异识别虫体匀浆液抗原和中度感染捻转血矛线虫的绵羊粪抗原。我国学者也筛选出抗捻转血矛线虫BLAODA蛋白单抗1B2和5B4,并建立了双抗体夹心ELISA,检测山羊血清敏感性和特异性均为90.6%,与肝片吸虫、旋毛虫和弓形虫阳性血清无交叉反应,具有较好的特异性和敏感性[54]。抗原检测ELISA具有早期诊断及疗效考核价值,可作为诊断蠕虫感染常规实验方法推广应用,但目前市场上尚无商品化试剂盒。
4.2 Western blot
Western blot主要用于诊断标识分子的初步筛选。Meshgi和Hosseini[55]采用该法自捻转血矛线虫肠道和子宫蛋白中筛选出了35和40 u的潜在诊断抗原。严若峰等[56]通过Western blot评价了重组甲基转移酶12型蛋白(Mt12)的反应性,结果发现该方法可特异识别感染后7~61 d山羊血清抗体,且与肝片吸虫和包虫病阳性血清无交叉反应。此外,Western blot与ELISA联合使用可检测早期感染阶段山羊血清中捻转血矛线虫的特异性抗体,比镜检法灵敏可靠,具有早期诊断价值[47,57]。
4.3 胶体金试纸条检测技术
严若峰等[40]采用基因工程方法制备了捻转血矛线虫复合抗原Hc-5C,可特异性识别感染后7~61 d的山羊血清抗体,具有早期和长期感染诊断价值。以复合抗原Hc-5C作为胶体金标记抗原和检测线包被抗原,兔抗Hc-5C多克隆抗体包被质控线制备了胶体金试纸条检测方法;检测山羊阳性血清敏感性为73.4%,与剖检法符合率为84.2%;与旋毛虫、弓形虫及大片吸虫阳性血清无交叉反应。相较于镜检虫卵法,胶体金试纸条阳性检出率高且检出时间早,具有简便、快速、安全、无需特殊仪器等优点,在捻转血矛线虫流行病学调查中有较好的应用前景。
4.4 CIEP
CIEP通过电泳使抗原抗体在电场中相对泳动,特异性结合后可形成白色沉淀线。Javare Gowda[41]基于成虫抗原采用CIEP检测了100份山羊血清抗体,敏感性和特异性分别为100%和72.1%,与剖检法的总符合率为88%;检测150份放牧羊血清阳性率为62%。CIEP简单、廉价、快速,可在1.5 h内观察结果,特异性较高,缺点在于假阳性率高,需电泳仪。但可作为辅助诊断方法。
5 分子检测
捻转血矛线虫全基因组和线粒体基因组数据库的不断完善,为开展其核酸检测研究奠定了重要基础[58]。核酸检测常用靶基因有β-微管蛋白(β-tubulin)和rDNA内转录间隔区(internal transcribed spacer region,ITS)等[59-60]。已建立的各种核酸检测方法具有较高的灵敏度和特异性,在种属鉴别、基因进化分析、病原检测和耐药性鉴定等方面应用广泛[34,61]。
5.1 PCR技术
自Roos和Grant[59]首次报道利用PCR技术鉴定捻转血矛线虫以来,各种PCR方法不断建立用于检测虫卵DNA,其检出率均高于镜检法。国内邹敏等[62]建立了检测捻转血矛线虫的特异性PCR,检测灵敏度为0.298 pg·μL-1,扩增细颈线虫、粗纹食道口线虫等多种线虫虫卵DNA均为阴性;昭日格图等[63]基于β-tubulin建立了检测捻转血矛线虫耐阿苯达唑的直接PCR法,最低检测限度为19 ng,扩增32份样品的阳性率为97%,高于常规PCR法。Bisset等[64]建立的多重PCR(multiplex PCR,mPCR),可区分10种常见感染羊的圆线虫。而实时荧光定量PCR(real-time PCR, qPCR)法检测灵敏度达0.1 pg DNA,检测田间绵羊粪便DNA的特异性和敏感性分别为100%和98%;与幼虫培养技术具有良好的相关性[65-67]。微滴数字PCR(droplet digital PCR,ddPCR)检测绵羊样品结果与qPCR一致性高(r2=0.98),可在混合线虫感染样本中检测到低水平的捻转血矛线虫[68-69]。PCR技术灵敏特异,其中ddPCR可实现PCR产物的绝对定量测定,为一种高精度评估血矛线虫感染的实用工具。但成本高昂,通常需专门实验室及相对昂贵的仪器和试剂,限制了其现场使用。
5.2 核酸可视化技术
5.2.1 LAMP方法 该技术可恒温高效扩增,肉眼观察结果,已被广泛用于多种病原的快速检测。Melville等[70]设计了针对ITS1基因的LAMP引物,检测绵羊粪便中的捻转血矛线虫虫卵最低限为2 EPG;灵敏度为10-5ng·μL-1DNA,高于PCR法(10-4ng·μL-1DNA);与其他常见混合感染寄生虫无交叉反应。Yang等[71]基于ITS-2基因建立的LAMP法灵敏度为1 pg DNA,敏感性高于PCR法。Tuersong等[72]基于β-tubulin基因E198A SNP位点建立了LAMP法,检测我国内蒙古、云南等8个省区捻转血矛线虫丙硫咪唑耐药频率介于0%~87%。LAMP具有简单快速、灵敏特异、成本较低、不需昂贵设备等优点,但需在65 ℃条件扩增。
5.2.2 侧流层析试纸条(lateral flow strip, LFS)偶联分析 LFS是相对成熟的终点可视化检测技术,目前已有市售的通用型LFS,可独立检测LAMP和RPA的目标产物,特异性好。Khangembam等[73]采用FITC和生物素标记LAMP扩增引物,建立了捻转血矛线虫LF-LAMP核酸可视化方法,与LAMP比色法一致性为100%。Wu等[74]基于ITS-2基因建立了LFS-RPA方法,可在20 min完成RPA扩增产物的可视化检测;其灵敏度为10 fg DNA,高于PCR法(100 fg DNA);检测24份山羊粪便,LFS-RPA和PCR敏感性分别为95.8%和79.1%;且LFS-RPA与其他蠕虫无交叉反应,诊断准确性较高。LFS偶联核酸等温扩增技术可快速直观判读结果、操作简便、无需专门设备,适于现场即时检测及流行病学调查。
5.3 DNA宏条形码技术
该技术通过高通量测序平台,可获得更为详细可靠的物种相对丰度的统计数据。同时,线虫群落ITS-2序列参考数据库[75]对羊群重要胃肠道线虫物种鉴定和丰度检测提供了极大的指导作用。Queiroz等[76]利用ITS-2 rDNA宏条形码和粪卵计数方法,评估了加拿大西部羊群胃肠道线虫感染情况及驱虫治疗的有效性。结果显示羊群存在混合感染,虫卵数为17~3 915 EPG;其中捻转血矛线虫相对丰度为64%;经伊维菌素、芬苯达唑和阿苯达唑治疗后总体平均粪卵数分别减少41%、41%和59%。该方法在寄生虫大规模调查和高通量分析方面具有显着优势,对线虫物种鉴定、感染强度和耐药监测的准确性高。缺点是应用成本高,需专业人员进行数据分析。
6 总结与展望
捻转血矛线虫病仍是世界各地养羊业的一个主要威胁;快速准确的检测手段对该病有效监测和防控至关重要[2]。现有检测技术各有优缺点(表1),但尚可满足基层对捻转血矛线虫病的诊断和监测,如FEC是推荐的感染诊断和耐药监测方法;LAMP和LFS-RPA核酸可视化技术可用于现场快速检测等。为满足流行病学筛查和持续监测的需要,其未来发展方向可能集中于如下几个方面:1)实现早期诊断。因捻转血矛线虫对羔羊危害大,在潜伏期前发现感染,可掌握最佳驱虫时机,及时采取个体化驱虫等干预措施,提高羔羊生长性能。2)多种方法联用。在实际生产中,羊群存在多种胃肠道线虫的混合感染,比较理想的方法是将传统方法与新技术(如ITS-2 rDNA宏条形码)联合应用提升该病检测效力。3)自动化和智能化。近年来,数字化技术和智能化技术推动了新型技术发展,有望将各种检测方法集成为性能优良的智能化分子检测平台,提高数据的可靠性和检测性能。4)完善辅助技术。当前病羊生前诊断主要依赖于虫卵检查,虫卵DNA质量对各类分子诊断起决定性作用。因此粪便虫卵富集方法和DNA提取方法的改进等都利于基于核酸快速检测技术性能的提高。
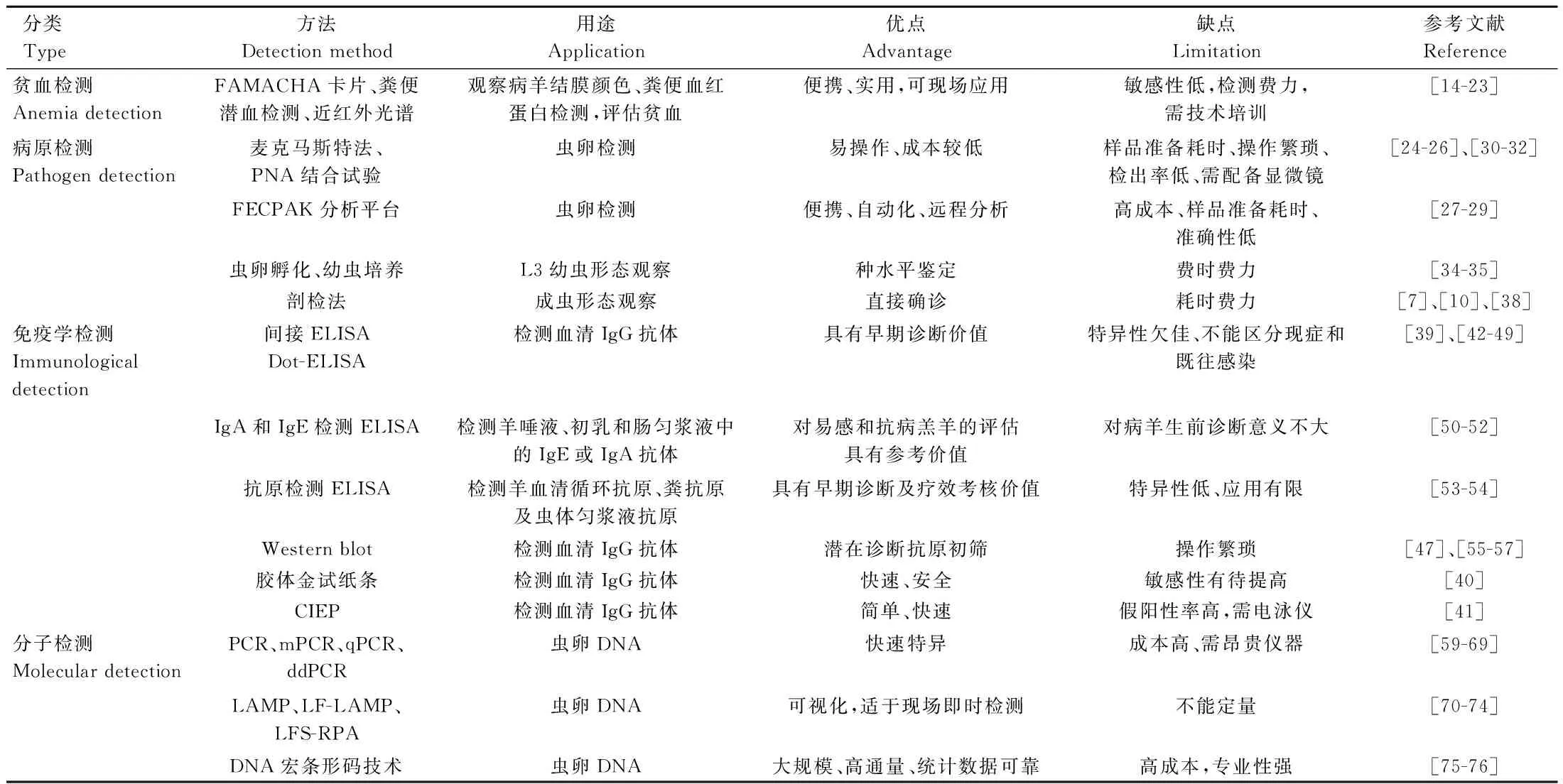
表1 羊捻转血矛线虫病现有检测方法及其优缺点Table 1 Advantages and limitations of the existing detection methods for ovine haemonchosis
综上所述,随着新兴技术的不断创新发展,羊捻转血矛线虫病检测技术的准确性、便携性和智能化等问题将会逐步得到改进和提高,以满足现场即时检测的需要,持续有效提升流行区羊群感染诊断、发病预警及耐药性监测等综合防控措施。此外,鉴于捻转血矛线虫感染和治疗的复杂性,快速推进长效疫苗、新型药物研发及抗病育种工作也是控制该病的有效措施。



