牛晓雨,邢媛媛,李大彪
(内蒙古农业大学动物科学学院 内蒙古自治区高校动物营养与饲料科学重点实验室,呼和浩特 010018)
肠道不仅是动物机体消化、吸收营养物质的主要场所,同时肠黏膜上皮屏障是机体发挥防御保护作用的重要组成部分之一,主要由机械、化学、免疫和微生物屏障组成[1],其完整性对维持动物正常肠道功能具有重要作用。然而,肠道黏膜的单层柱状上皮结构易受到外界环境的超常刺激发生病理变化,使脂多糖、组胺等有害代谢产物及部分病原体迁移至循环系统,引起肠内微生态失衡、肠道组织形态改变,导致“漏肠”的形成[2],严重影响动物的生长与生产,对养殖者的经济效益造成巨大冲击。在养殖端“限抗”,饲料端“禁抗”的背景下,天然植物活性成分(natural plant bioactive compounds,NPBCs)因其残留少、耐药性和毒副作用小、安全性高等优点,近年来在畜禽饲粮中添加适宜剂量的NPBCs逐渐成为调控畜禽肠道健康的主要手段之一。有关NPBCs对畜禽肠道屏障功能的影响研究较多,本文总结了近年来NPBCs对畜禽肠道健康调控的研究进展,重点阐释了NPBCs对畜禽肠黏膜形态、肠道菌群、肠道免疫功能的影响及其可能的作用机制,以期为天然绿色植物源性饲料添加剂的开发以及提高畜禽健康养殖水平提供思路与依据。
1 NPBCs的定义与理化性质
NPBCs通常指植物次级代谢产物和植物化学物质,包括黄酮、多酚、精油和生物碱等。黄酮类植物活性成分主要指基于母核2-苯基色原酮而衍生的,以C6-C3-C6为碳架的一类化合物,根据碳架种类、数目、连接位置和连接方式的不同,可分为黄酮类、黄酮醇类、异黄酮类、黄烷醇类、双黄酮类及其他黄酮类。黄酮类植物活性成分作为植物的次生代谢产物,其资源丰富、来源广泛,并具有较强的抗炎、抑菌、抗氧化和调节动物胃肠道健康等诸多生物学功能,且毒性相对较低,可以安全使用[3]。
精油类植物活性成分是从植物中提取和分离得到的含芳香分子的油状物质,在食品、医药和化妆品行业应用广泛。其种类多样、成分复杂,包括萜烯类、芳香类、脂肪类、含氮含硫类等化合物,具有易挥发、不稳定、不溶于水、含有特殊气味等特点。
多糖类植物活性成分是指植物提取物中含有10个以上糖基并以α/β-糖苷键连接的化合物,具有抗氧化、抗菌和免疫调节等多种生物学功能。关于植物多糖的抗氧化功能,一方面,多糖分子存在还原性半醛羟基和醇羟基,可与超氧离子自由基发生氧化还原反应或与金属离子螯合,减少细胞产生多余的ROS;另一方面,植物多糖可提高动物机体抗氧化酶活性。植物多糖也可增强肠道屏障功能和免疫功能、调节肠道菌群结构。
多酚类植物活性成分是一大类具有多元酚结构单元的植物次生代谢产物,广泛存在于植物的皮、根、叶和果实中[4]。目前, 人们已经鉴定出超过8 000余种的植物多酚类成分。一般认为,植物多酚指相对分子质量在500~3 000Da之间的单宁及其前体化合物和聚合物。根据化学结构的不同,单宁可分为水解单宁和缩合单宁两大类。水解单宁主要是聚棓酸酯类多酚,可进一步细分为棓单宁和鞣花单宁两大类物质;而缩合单宁主要是C6-C3-C6羟基黄烷醇类和C6-C2-C6的芪类单体的缩合物。植物多酚具有抗氧化、抗炎、抑菌、免疫调节、抗衰老、心血管保护等生物学活性,是人类获得药理活性成分及新药开发先导化合物的重要来源,对人类健康有积极意义。同时, 近年来越来越多的研究表明,植物多酚对于提高动物生产性能,缓解畜禽应激状态及维持肠道健康具有积极作用,是一类极具开发潜力的天然绿色抗生素替代物,具有广阔的开发前景[5]。
2 NPBCs对畜禽肠道屏障的影响及其机制
2.1 NPBCs对畜禽肠道机械屏障的影响及其机制
肠道机械屏障是由单层柱状上皮细胞构成的一个动态的、可渗透的屏障,可有效防止肠腔内的有毒物质自由通过细胞间隙而渗透进周围组织中。小肠绒毛是小肠组织形态发育的标志,其中绒毛高度(villus height,VH)、隐窝深度(crypt depth,CD)和绒毛高度/隐窝深度(V/C)是衡量小肠消化吸收功能及小肠健康状态的重要指标。完整而长的绒毛有利于营养物质的充分吸收和抵御细菌;CD与细胞的生成率呈负相关,隐窝越深,细胞生成率越低,分泌功能越弱;V/C综合反映了小肠的功能状态,V/C下降,表示消化吸收功能下降常伴随腹泻,V/C上升,说明肠内膜面积较大,消化吸收能力较强[6]。NPBCs对动物肠道VH、CD和V/C的影响见表1,黄酮、多糖等多种NPBCs均可通过改善小肠黏膜形态进而提高小肠对营养物质的吸收能力并维持正常肠道屏障功能。
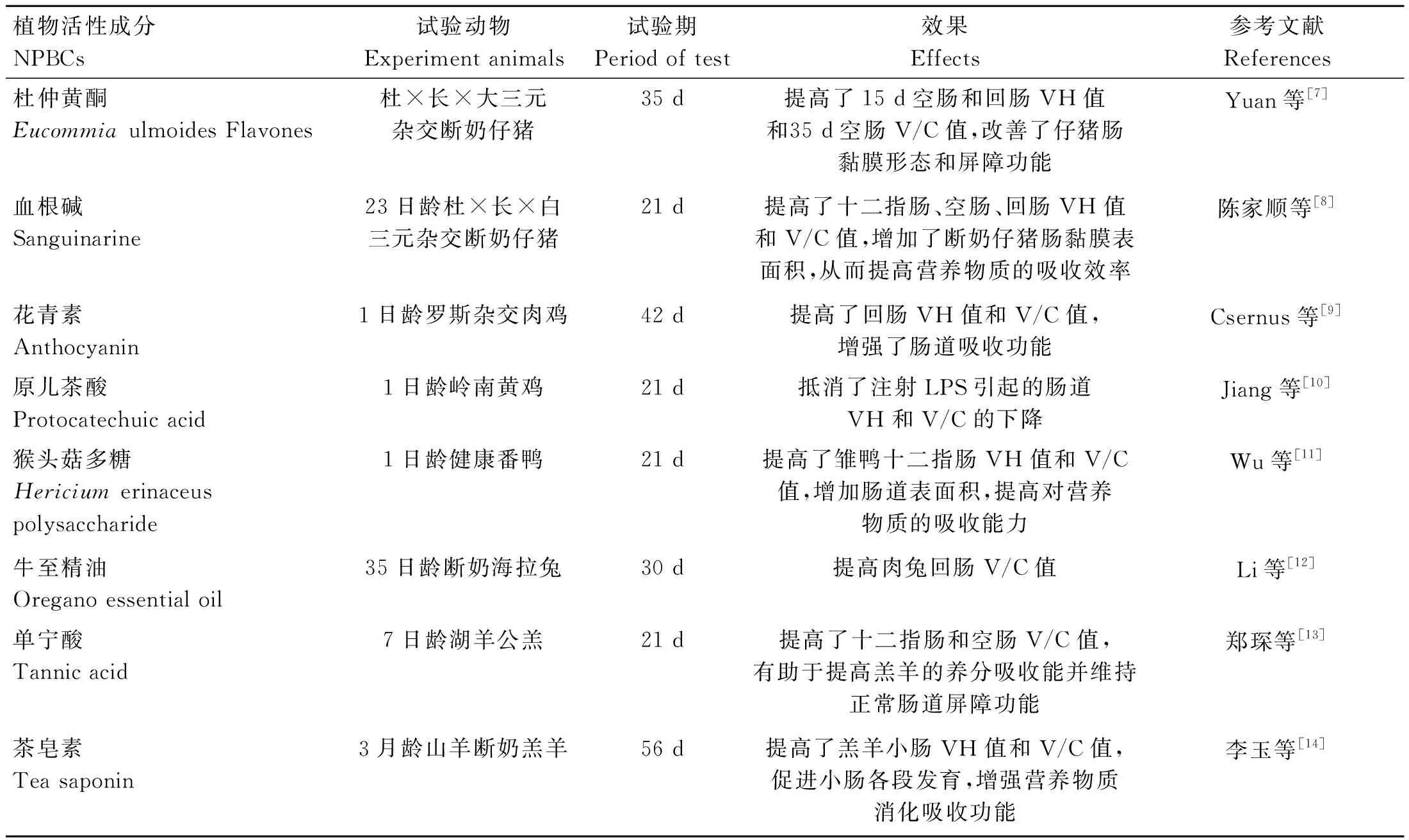
表1 NPBCs对动物肠黏膜形态结构的影响Table 1 Effects of NPBCs on intestinal morphology and structure in animals
紧密连接蛋白主要由闭合蛋白(claudin)、闭锁蛋白(Occludin)、闭合小环蛋白(zonaul occludens,ZO)和连接黏附分子(JAM)等胞质分子构成,连接相邻细胞并控制肠黏膜的通透性,是维持肠道屏障功能完整性的主要参与者之一[15]。其中Occludin调节小分子物质的胞旁和胞间扩散,claudin和ZO通过与细胞骨架连接控制肠道的选择通透性[16]。Wan等[17]报道,口服40 mg·kg-1的熊果酸可显着上调大鼠回肠Occludin和Claudin的基因表达,降低肠道通透性。此外,在肉鸡日粮中添加600 mg·kg-1的原儿茶酸很大程度上缓解了注射脂多糖(LPS)引起的肠道VH和V/C的下降,并显着上调了空肠黏膜JAM2和Occludin的mRNA表达[7]。玫瑰精油可修复葡聚糖硫酸钠诱导的小鼠结肠损伤继而保护肠道屏障,原因可能与玫瑰精油提高小鼠结肠ZO-1、Occludin和黏蛋白-2(Muc-2)的mRNA和蛋白表达有关[18]。Wang等[19]研究发现,热应激会使鸡回肠Occludin、Claudin-1和ZO-1水平降低,但是在日粮中添加600 mg·kg-1的鸡骨草多糖后可以减轻这种不利影响,并趋于恢复到正常水平,肠道屏障功能得以修复。
紧密连接蛋白受Toll样受体4(TLR4)和表皮生长因子受体(EGFR)两种受体信号通路的调控。前者介导先天免疫和炎症反应,并抑制紧密连接蛋白的启动子激活[20],后者可通过激活PI3K/AKT和AMPK信号通路加速紧密连接蛋白的合成,维持肠黏膜屏障的完整性[21]。以猪肠上皮细胞为模型的体外试验发现,LPS下调了肠上皮细胞中EGFR及其配体(EGF、hf-EGF、TGF-α)的表达,而添加马齿苋多糖(Portulacaoleraceapolysaccharide,POP)后EGFR表达升高。此外,当EGFR抑制剂ZD1839与POP共同作用时,POP对肠上皮屏障的保护作用消失[9]。这表明POP可通过激活EGFR信号通路和抑制TLR4/NF-κB信号通路调控紧密连接蛋白的表达,进而维持肠上皮机械屏障的完整性。
此外,小肠上皮杯状细胞数量与形态也是衡量肠道屏障功能的关键指标。研究发现,在肉鸡日粮中添加含有15 g·kg-1香芹酚的精油混合物可显着提高小肠杯状细胞数量与VH[22]。在对热应激大鼠小肠上皮细胞(IEC-6细胞)上的研究表明,厚朴酚可通过降低p21、p27 和Rb基因表达,提高细胞周期蛋白D1、细胞周期蛋白依赖性激酶4和E2F1的基因表达,进而抑制热应激诱导的细胞周期停止,缓解热应激对IEC-6细胞的细胞形态造成的损伤,最终促进IEC-6细胞增殖,这有利于增强肠道机械屏障完整性[23]。综上所述,NPBCs一方面调控肠道黏膜形态,另一方面增加紧密连接蛋白的基因和蛋白表达量,同时促进肠上皮细胞的增殖与分化来增强肠道机械屏障的完整性,进而维持肠道机械屏障功能。
2.2 NPBCs对畜禽肠道化学屏障的影响及其机制
肠道的化学屏障主要由胃肠道分泌的胆汁、消化酶和肠道杯状细胞分泌的黏蛋白(MUC)等化学物质和肠道中的抗氧化酶等组成,在维系肠道微生态平衡和肠道健康中发挥化学防御功能[24]。
胆汁是肠黏膜化学屏障的重要组成部分,其中的胆汁酸不仅可以缓解肠道炎症,还可以有效降低肠道pH。在动物消化系统中,适宜的肠道pH对于清除病原菌具有重要意义,pH升高会促进病原菌增殖,同时影响消化酶的活性。梅华迪等[25]报道,槲皮素可通过调节胆汁合成和分泌、肠碱性磷酸酶的蛋白表达量和抑菌物质的生成,从而影响肠黏膜稳态。熊筱娟等[26]以肝损伤大鼠为模型进行试验发现,给予30 mg·kg-1的熊果酸可显着增加大鼠的胆汁流量,增强肠道化学屏障功能。肠道杯状细胞分泌的MUC是化学屏障的主要组成部分,可以作为润滑剂减少肠道内容物对肠道上皮细胞的机械损伤,防止肠上皮遭受酸性食糜和肠道病原菌的侵害。在Caco-2/HT29-MTX细胞共培养试验中发现,槲皮素和表儿茶素均可促进MUC-17的基因表达,保护肠道或肠道细胞免受病原体和细菌侵扰[27]。
血清D-乳酸和二胺氧化酶(diamine oxidase,DAO)水平是胃肠道完整性的关键标志物,其中DAO是小肠黏膜上层绒毛中具有高度活性的细胞内酶,可通过调节细胞内的离子平衡促进细胞修复,对肠黏膜起到保护作用[28]。Liu等[29]研究发现,在肉鸡日粮中添加2 g·kg-1的栗木单宁可改善肠道屏障功能,表现为血清D-乳酸含量和DAO活性降低。上述研究表明,NPBCs可以通过调控胆汁、MUC及肠道屏障功能标志物的合成与分泌来改善肠道化学屏障功能。
NPBCs还可以与肠道内的消化酶作用,提高消化酶活性,改善肠道对营养物质的吸收功能。肉仔鸡日粮中添加300 mg·kg-1的山楂叶总黄酮可显着提高小肠胰蛋白酶和淀粉酶活性[30]。李华丽[31]通过肉鸡灌胃试验发现,0.06 g·kg-1BW的茶多酚可显着降低肉鸡小肠脂肪酶和胃蛋白酶活性,显着提高胰脂肪酶和胰蛋白酶活性。还有研究还发现,槲皮素可以促进肠绒毛细胞对寡肽的吸收[32]。
动物在应激状态下会产生过量的自由基造成肠道损伤。抗氧化酶是一种存在于细胞中的蛋白质,它具有清除体内自由基的作用。总抗氧化能力(T-AOC)是反映机体抗氧化能力的综合指标;超氧化物歧化酶(SOD)可以催化体内超氧化物到氧化物的转换;过氧化氢酶(CAT )可有效清除体内氧自由基(ROS、NO等);谷胱甘肽过氧化物酶(GSH-Px)在动物体内可以催化过氧化氢的分解;丙二醛(MDA)含量直接反映机体脂质过氧化程度,是评价脂质氧化损伤的重要指标,同时也可间接反映肠黏膜细胞的损伤程度[33]。NPBCs对动物肠道抗氧化酶的影响见表2。由表2可知,NPBCs可通过提高动物肠道抗氧化酶活性及其基因表达从而加强肠道抗氧化功能。核因子E2相关转录因子2(Nrf2)是近年来新发现的一种核转录因子,可调控下游一系列II相解毒酶如:血红素氧合酶-1(HO-1)、NAD(P)H醌氧化还原酶1(NQO-1)、谷氨酸-半胱氨酸连接酶催化亚基(GCLC)、谷氨酸-半胱氨酸连接酶调节亚基(GCLM)和抗氧化酶(如:SOD、CAT、GSH-Px)的基因表达来提高机体的抗氧化防御系统。
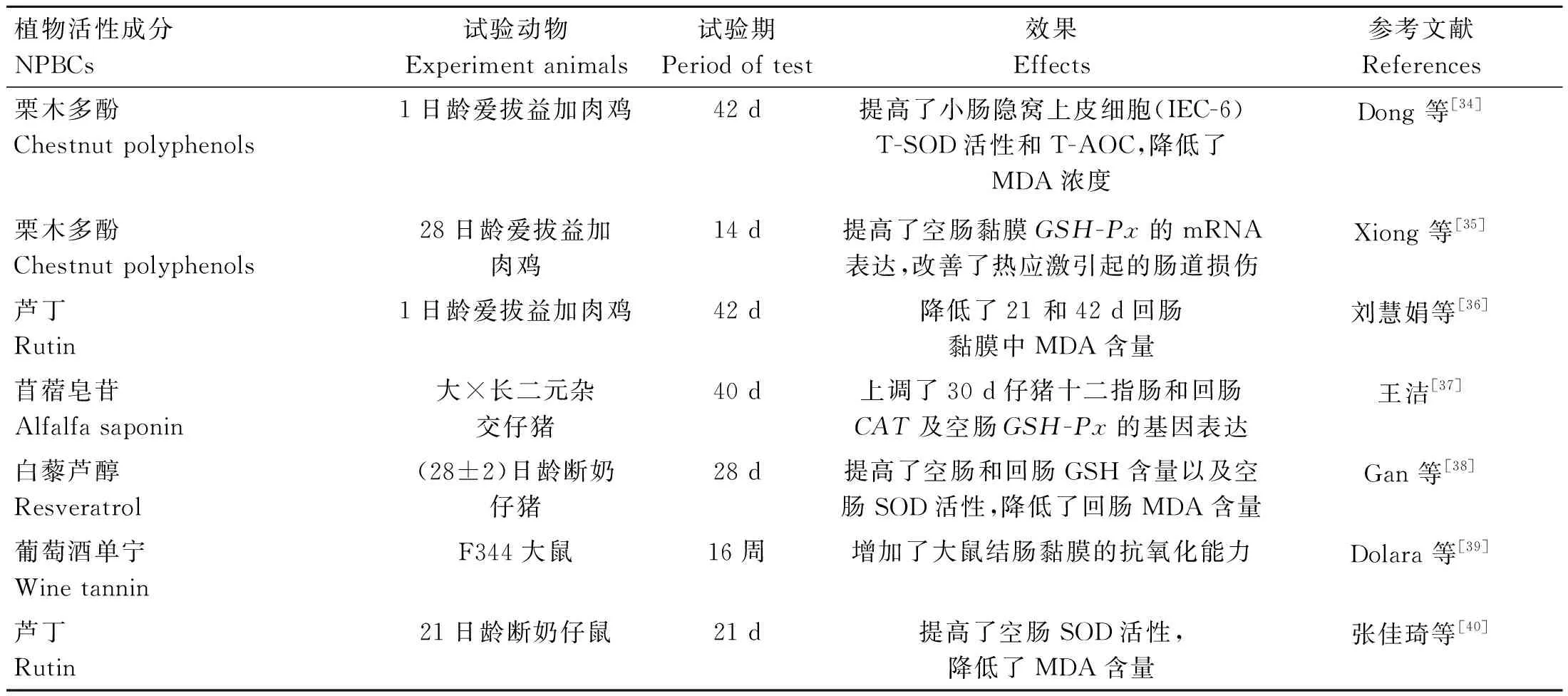
表2 NPBCs对动物肠道抗氧化酶的影响及其机制Table 2 Effects of NPBCs on antioxidant enzymes in animals intestinal tract
但近年来有研究报道,Nrf2途径不仅通过影响抗氧化酶活性进而调节机体抗氧化功能,还可通过增加紧密连接蛋白的表达增强肠道屏障完整性[41]。刘慧娟等[36]研究发现,500 mg·kg-1的芦丁可显着提高肉鸡回肠黏膜中Nrf2和HO-1 mRNA 的表达量,推测芦丁可能通过增强Nrf2/HO-1信号通路来调节肉鸡肠道的免疫屏障功能。综上可知,NPBCs可通过增加有利于肠道健康的短链脂肪酸含量,减少有害于肠道健康的含氮代谢产物含量以及调控肠道抗氧化酶活性等多种途径对肠道化学屏障发挥潜在的积极作用。
2.3 NPBCs对畜禽肠道免疫屏障的影响及其机制
肠道免疫屏障主要是由肠道相关淋巴组织及其分泌的一些抗体和细胞因子构成,这些因子不仅可以反应肠道的免疫状态,还可通过调节机体局部和全身免疫反应,进而调控肠道免疫功能。
2.3.1 NPBCs对畜禽肠道体液免疫的影响 以分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)为主的体液免疫在肠黏膜免疫系统中起主要作用,当肠黏膜上皮免疫活性细胞受到病原微生物刺激时,sIgA可阻止肠道微生物及其毒素分子对肠黏膜的攻击。免疫球蛋白A(immunoglobulin,IgA)可使抗原在细胞内被中和,同时将其产物返回肠腔,防止上皮细胞因细胞裂解而受损,免疫球蛋白G(immunoglobulin,IgG)在免疫应答中可活化补体,清除病原体[42]。有研究表明,在LPS攻毒小鼠日粮中添加2%的绿茶粉和20 mg·kg-1的茶多酚后,小鼠肠道sIgA含量显着增加,这表明绿茶粉和茶多酚可在小鼠发生免疫应激后,促进肠上皮局部产生sIgA,阻止细菌破坏肠道屏障[43]。
2.3.2 NPBCs对畜禽肠道细胞免疫的影响 NPBCs可能是畜禽发生肠道炎症反应的重要介质,近年来在疾病预防和治疗中得到了广泛的应用。以猪肠上皮细胞为模型的研究中发现,100和500 μg·mL-1的马齿苋多糖均可抑制由LPS引起的白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)的mRNA过度表达[15]。有学者发现,海带多糖可显着下调断奶仔猪结肠黏膜中炎症因子IL-6、IL-17、以及IL-1β的mRNA表达量,减轻肠道炎症反应[42]。以上研究表明,NPBCs可提高畜禽肠道细胞免疫功能,维持机体健康,进而保证动物肠道健康。
2.3.3 NPBCs对畜禽肠道炎症信号通路的影响 在动物机体内,许多生理和病理反应都是由特定的信号通路介导的,包括应激反应和炎症反应等。下文将论述NPBCs对决定肠道炎症期间组织损伤和修复的一些信号通路的影响,以阐明NPBCs对动物肠道的保护机制。
TLR是天然免疫细胞和其他细胞表面的识别受体,可识别LPS、病原微生物双链DNA、单链RNA和脂蛋白等刺激,在调节肠道先天性和适应性免疫中有着重要作用[44],所有的TLR活化最终都会激活NF-κB和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,它们控制着一系列细胞因子的转录和合成。NF-κB信号通路作为机体内免疫调节的经典通路,可以通过影响TNF-α、IL-1β和IL-6等促炎因子的表达,进而介导炎症反应[45]。研究发现,红枣多糖可以通过下调NF-κBp65蛋白的表达,抑制NF-κB通路的激活,从而调控黏膜内淋巴细胞中炎症因子的合成和释放,避免肠道过度的炎症反应,此外还能提高肠道免疫功能,保护肠道屏障[46]。另有研究显示,枸杞多糖可通过抑制TLR4/NF-κB信号通路,下调NF-κB、TLR2、TLR4和髓样分化因子88(MyD88)的mRNA表达,从而减轻炎症因子对肠道屏障的破坏[47]。LPS诱导的回肠炎大鼠试验中,厚朴酚可通过抑制NF-κB信号通路的激活,调节T细胞表达分泌因子的蛋白表达和分泌,提高IL-10的mRNA表达水平,减弱TNF-α、单核细胞趋化蛋白-1和诱导型一氧化氮合酶的基因转录,降低TNF-α、IL-6和IL-1β含量,以减轻肠道炎症反应[48]。
MAPK信号通路在调节动物肠道屏障功能及体内促炎介质的产生上都发挥重要作用,被认为是抗炎治疗的有效分子靶点。其中细胞外信号调节激酶(extracellular signal regulated kinase,ERK1)和p38在MAPK通路中发挥关键作用。ERK1/2和p38的磷酸化会促使炎症因子过度产生,从而引起肠道发生病理变化[49]。Sun等[50]研究发现,添加 250 mg·kg-1的槲皮素可以减轻由LPS引起的ERK、c-Jun氨基末端激酶和p38磷酸化。Ma等[51]研究发现,杏鲍菇多糖可以通过抑制磷酸化p38MAPK和ERK1/2的基因表达进而抑制MAPK信号通路的激活。以上结果表明,黄酮和多糖等NPBCs均可抑制炎症因子和趋化因子的过度产生,并通过介导MAPK信号通路调控LPS诱导的动物肠道炎症,改善肠道健康。此外,还有研究发现,部分NPBCs可通过调节Janus激酶/信号转导和转录激活因子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)和磷脂酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol-3-kinase/protein kinase B,PI3K/AKT)信号通路调节炎性细胞因子水平和其他参与肠道炎症发病机制介质的基因表达,降低肠道炎症水平,改善肠道屏障功能[52]。
NPBCs对动物肠道免疫屏障的影响见表3。综上可知,炎症发生时,炎症信号通路激活,动物肠道炎症水平提高,屏障功能被破坏。NPBCs可通过与细胞膜受体相互作用或被细胞吸收,调节细胞信号转导,调控炎症因子表达,发挥保护肠道免疫屏障的作用。此外,NPBCs对肠道免疫屏障功能的影响可能有利于增强宿主对微生物感染的防御能力。
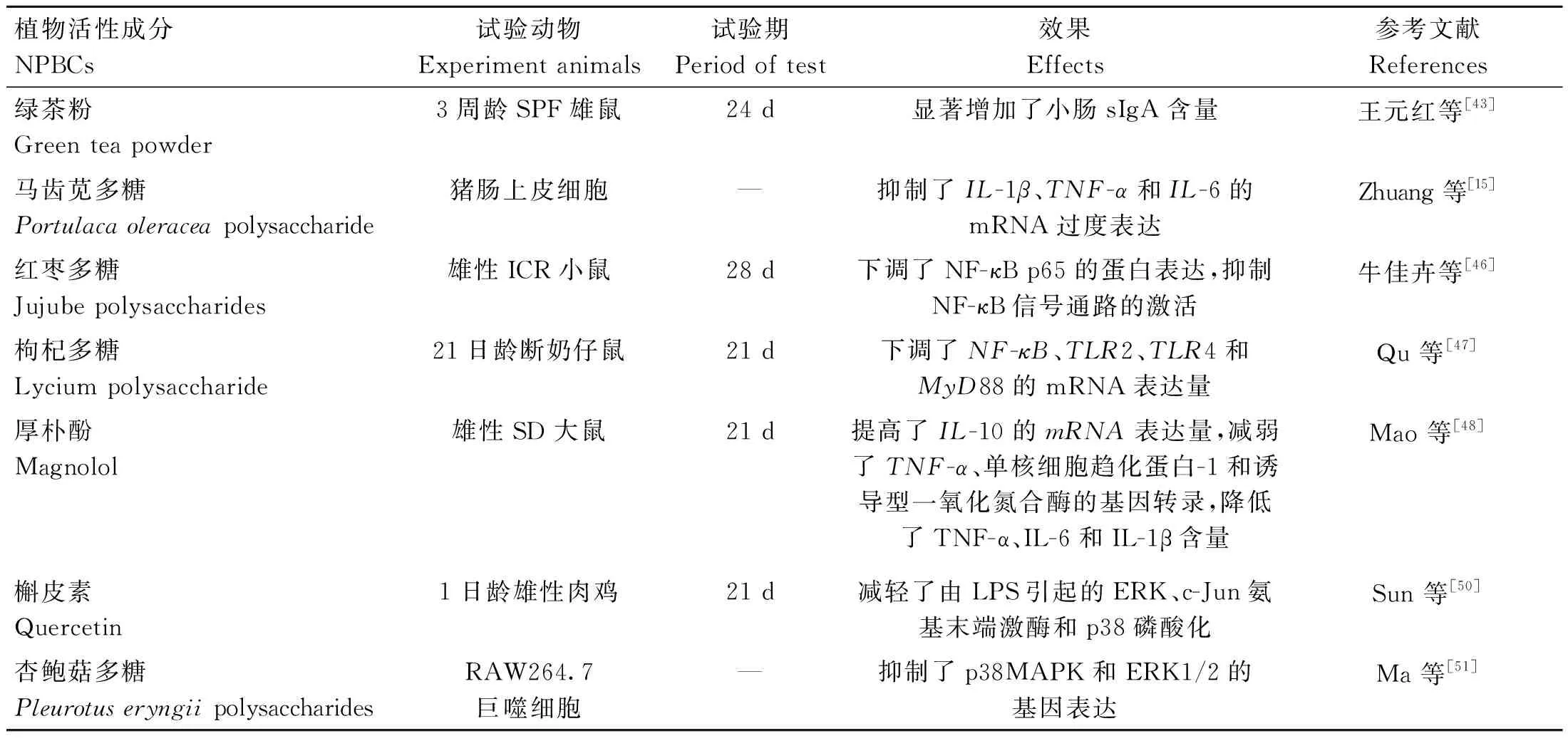
表3 NPBCs对动物肠道免疫屏障的影响Table 3 Effects of NPBCs on intestinal immune barrier in animals
2.4 NPBCs对畜禽肠道微生物屏障的影响及其机制
动物胃肠道内栖居着数以万计的微生物,它们形成了相互依存、相互制约的肠道微生物稳态系统。这些微生物大多数定植在黏膜层中形成一道微生物屏障,协助黏膜层抵御有害微生物入侵。在正常情况下,肠道黏膜表面会附着大量厌氧细菌,如双歧杆菌、乳酸杆菌等益生菌,它们可以通过黏附与肠上皮紧密结合,形成一层膜屏障,阻碍致病菌在肠道中的定植[53]。如果肠道微生物菌群失调,则定植抵抗力会下降,外源病原菌会黏附在肠黏膜上,诱发一系列肠道疾病,如肠道炎症、腹泻等。近年来诸多研究表明,NPBCs可通过选择性促进肠道有益菌的增殖,抑制有害菌在肠道的定植,优化肠道微生态环境,进而维持肠道的微生物防御系统稳衡,最终维系动物肠道乃至整个机体的健康。研究表明,慢性应激下盲肠菌群对宿主的不良影响可能与Alipipes的相对丰度有关[54]。Wang等[19]研究发现,在肉鸡日粮中添加600 mg·kg-1的鸡骨草多糖显着降低了盲肠Alipipes的相对丰度,同时本研究还发现,盲肠Alipipes的相对丰度与回肠SOD活性和ZO-1表达呈显着负相关,与回肠MDA浓度和IL-6的基因表达呈显着正相关,这提示,鸡骨草多糖缓解了热应激对机体肠道造成的负面影响。此外,有报道称白藜芦醇也可降低肠道Alipipes的相对丰度,降低LPS对微生物造成的负面影响,在预防肠道炎症方面有较大潜力[55]。这可能是因为NPBCs中的羟基与细菌细胞膜相互作用,破坏细胞膜结构,致使细胞内成分溢出[56]。Lee等[57]研究发现,从茶叶中提取的酚类成分对体外培养的产气荚膜梭菌、大肠杆菌、假单胞菌和沙门菌等病原菌有抑制作用,推测可能是因为酚类物质有较强的抑菌活性,可抑制细菌的拓扑异构酶活性,进而抑制细菌DNA复制,这种抑菌作用也可能与阻断菌体细胞养分转运、破坏细菌细胞膜结构有关。此外,菌群结构的改变可能增加了乙酸、丁酸等有益短链脂肪酸的含量,从而改善肠道健康。产芽孢菌纲是厚壁菌门的一个纲,有研究证实产芽孢菌纲能诱导动物采食高脂日粮,促进肠道健康,增强肠道吸收功能[56]。研究发现,在安徽白山羊日粮中添加2.5 g·kg-1的茶皂素可显着增加山羊小肠产芽孢菌纲的相对丰度[14]。乳酸菌作为常见益生菌之一,在猪肠道菌群构建的早期便处于优势地位,其相对丰度增加不仅可以降低粪便pH和氨氮水平,还可以阻止病原菌在肠道中定植,改善肠道健康[58]。Yuan等[7]研究发现,在不含抗生素的仔猪日粮中添加0.01%杜仲黄酮可显着增加乳酸菌数量,并显着降低了大肠杆菌数量,这表明杜仲黄酮具有较强益生元活性,可起到保护肠道健康的作用。此外,短链脂肪酸大多是微生物的代谢产物,其作为肠上皮细胞和肠道微生物的重要能量来源,在促进肠上皮细胞增殖、分化的同时,还可改善肠黏膜形态、维护肠黏膜屏障功能,被认为是具有抗炎和调节肠道免疫功能的有益代谢产物。其中,乙酸既能作为外周组织的能量基底,又具有良好的抗炎和免疫调节作用[59]。据报道,400 g·kg-1的厚朴酚可通过刺激仔猪肠道微生物代谢进而提高肠道乙酸和总短链脂肪酸含量,对肠道黏膜屏障起到保护作用[60]。
NPBCs对动物肠道微生物屏障的影响见表4。这些发现均反映了NPBCs在调节肠道微生物上的优良作用和潜在价值,其可通过提高有益菌的相对丰度或数量,抑制潜在致病菌的增殖,同时增加肠道微生物的多样性,进而增强肠道微生物屏障功能,最终维系动物肠道乃至整个机体的健康。
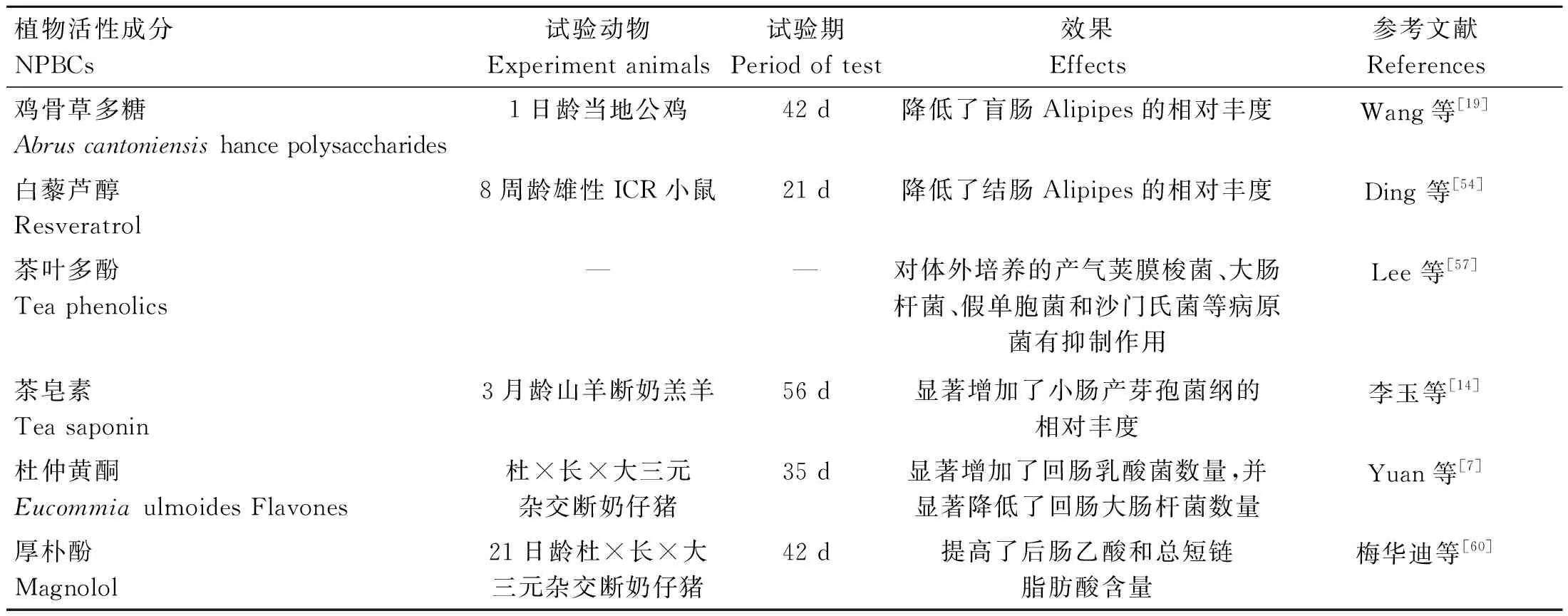
表4 NPBCs对动物肠道微生物屏障的影响Table 4 Effects of NPBCs on intestinal microbial barrier in animals
3 小 结
在畜禽生产中,由肠道黏膜损伤引起的动物肠道疾病常危害到机体健康,寻找适宜的药物或者添加剂成为畜禽健康养殖的重点。NPBCs以其绿色、环保、多效等特点逐渐成为了饲用抗生素的潜在替代品,且大量研究已证实,NPBCs可通过维持肠道屏障、改善肠道菌群、缓解肠道炎症和氧化应激造成的不利影响以及促进肠道消化吸收调控动物肠道健康(图1)。然而,目前NPBCs调控动物肠道屏障功能的研究主要集中在模式动物和单胃动物上,关于其在反刍动物上的研究还较少。此外,由于大多数NPBCs含有多种化合物成分,相互协同作用强,对肠道功能的调节机制尚不清楚。因此,在此基础上,还需补充研究工作,进一步深入探究NPBCs在不同动物、不同生理状况下的吸收与代谢及对肠道黏膜屏障具体的调控机制和信号转导通路,同时有针对性地提高各类NPBCs的分离纯化技术,进行更多的标准化试验对其功效加以验证,确定其在不同动物不同生长阶段的适宜添加剂量等,以期为NPBCs作为畜禽饲料添加剂的开发应用和维护动物肠道健康提供科学依据。
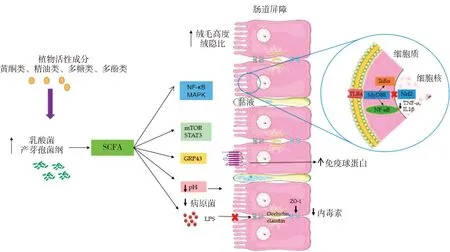
图1 NPBCs对动物肠道屏障功能的影响机制[5]Fig.1 Proposed mechanisms of action of NPBCs on intestinal barrier function[5]



