曹玉珠,邢雨欣,马乘霖,管宏波,贾其辉,康相涛,2,3,田亚东,2,3,李转见,2,3,刘小军,2,3*,李 红,2,3*
(1.河南农业大学动物科技学院,郑州 450046;2.河南省家禽育种国际联合实验室,郑州 450046;3.河南省鸡种质资源创新与利用重点实验室,郑州 450046)
成纤维细胞生长因子6(fibroblast growth factor 6,FGF6)是成纤维细胞生长因子家族(FGFs)的成员之一,主要通过与成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)1和4结合后发挥其生物学活性[1-2]。有研究表明,FGF6是血管新生诱导因子之一,它可以促进血管内皮细胞的生成[3]。沉默FGF6会抑制膀胱癌(BC)细胞系有氧糖酵解,从而调节PI3K/Akt和MAPK信号通路抑制其血管生成[4]。FGF6基因可调节人舌头发育过程中的肌源性分化和成肌细胞融合[5]。Cai等[6]通过构建肌母细胞和周围神经损伤的体内模型,发现FGF6在去神经支配的大鼠肌肉中增强了MyHC-IIb肌纤维表型,减少了肌肉萎缩,进而促进神经支配后再生骨骼肌的功能恢复。Xu等[7]通过对男性骨骼肌样本进行甲基化DNA免疫沉淀测序(MeDIP-Seq)和RNA测序(RNA-Seq)发现FGF6基因表达下调,骨骼肌中过表达FGF6能够改善胰岛素抵抗,增加骨骼肌的AMPK活性,进而增加全身葡萄糖量和脂质代谢。Shamsi等[8]发现,FGF6作为一种脂肪因子可独立于脂肪生成机制调节解偶联蛋白1(uncoupling protein 1,UCP1)的表达,并调节全身能量代谢。Liu等[9]研究表明,FGF6是脂肪细胞祖细胞(APC)维持脂肪稳态和胰岛素敏感性的增殖因子。Hu等[10]研究发现,重组人FGF6蛋白能够通过抑制Hippo途径改善心肌梗死(MI)小鼠的心脏功能并促进其心脏的修复能力。Creighton等[11]通过对非裔美国人前列腺癌(Pca)转录组学和表观基因组学全DNA甲基化的综合分析,发现了与Pca唯一相关的包括FGF6在内的12个候选基因。
上述关于FGF6基因的报道主要集中在哺乳动物上,表明该基因在血管形成、骨骼肌再生、葡萄糖代谢、脂肪生成及稳态、心肌发育和肿瘤细胞的发育等生理和病理过程中具有重要作用。在鸡上,Kumar和Chapman[12]对鸡FGF6基因进行了克隆,并通过原位杂交发现其在雏鸡的头部、咽部和内脏中胚层广泛表达。先前研究发现FGF6基因在固始鸡的十二指肠高表达[13]。除此之外,有关鸡FGF6基因的相关研究鲜有报道。
综上,FGF6基因在哺乳动物的细胞增殖、肌肉发育过程中发挥重要作用,在鸡上对其研究较少,尚未见对FGF6基因多态性及与鸡经济性状的关联分析。本研究旨在通过对鸡FGF6基因进行生物信息学分析,并对鸡FGF6基因的SNPs与鸡的生长、屠体、肉品质和血清生化指标性状进行关联分析,筛选与鸡经济性状关联的重要SNPs及单倍型组合,为进一步研究其生物学功能及调控机制提供理论基础,为鸡分子育种提供数据支撑。
1 材料与方法
1.1 试验材料
本研究以河南省家禽种质资源创新工程研究中心构建的固始鸡×安卡鸡F2资源群768个个体为研究对象(该群体按F2远缘半同胞设计方案,有正反交7个家系)[14]。所有鸡饲养在同一环境,自由采食饮水,饲喂至第84天时,颈静脉采血,血液置于含/不含EDTA的抗凝管中,用于制备DNA/血清。768只鸡简化基因组测序(genotyping-by-sequencing, GBS)数据[15]及个体所对应的表型数据库由实验室保存。
1.2 测定表型指标
固始鸡×安卡鸡F2资源群所有个体从孵化起,每隔2周称体重,每隔4周测定体尺指标。体重指标包括出生重(birth weight, BW0)、2周体重(BW2)、BW4、BW6、BW8、BW10和BW12。体尺指标包括0、4、8和12周龄的胫长(shank length, SL)、胫围(shank girth, SG)、胸深(chest depth, CD)、胸宽(chest width, CW)、胸骨长(breast bone length, BBL)、胸角(breast angle, BA)、体斜长(body slanting length, BSL)和骨盆宽(pelvis breadth, PB)等32个指标[14]。
84日龄屠宰后测定屠体、肉质和血清生化相关指标。屠体性状包括肝脏重(liver weight, LiW)、胸肌重(breast muscle weight, BMW)、腿肌重(leg muscle weight, LMW)、腿重(leg weight, LW)、腹脂重(abdominal fat weight, AFW)、屠体重(carcass weight, CW)、半净膛重(semi-evisceration weight, SEW)、全净膛重(evisceration weight, EW)及其对应的比率等16个指标[15]。肉质性状包含腿肌剪切力(leg shear force, LSF)、胸肌剪切力(breast shear force, BSF)、胸肌失水率(water loss rate of breast muscle, WLRB)和腿肌失水率(water loss rate of leg muscle, WLRL)4个指标[16]。血清生化指标包括谷丙转氨酶(alanine transaminase, ALT)、胆碱酯酶(choline esterase, ChE)、高密度脂蛋白(high density lipoprotein, HDL)、低密度脂蛋白(low density lipoprotein, LDL)、总胆固醇(total cholesterol, CHO)、甘油三酯(triglyceride, TG)等15个指标[17,18]。
1.3 生物信息学分析
从NCBI数据库中下载人(NP_066 276.2)、鼠(NP_571 983.1)、鸡(XP_001 232 071.1)、火鸡(XP_003 202 616.1)、绿海龟(XP_007 055 701.1)、热带爪蟾(NP_001 136 295.1)和斑马鱼(NP_001 001 398.2)FGF6的氨基酸序列进行相似性比对,利用MEGA10.0软件构建系统进化树。利用生物信息学在线软件对FGF6蛋白理化性质及功能进行分析和预测。相关分析项目及对应的工具见表1。
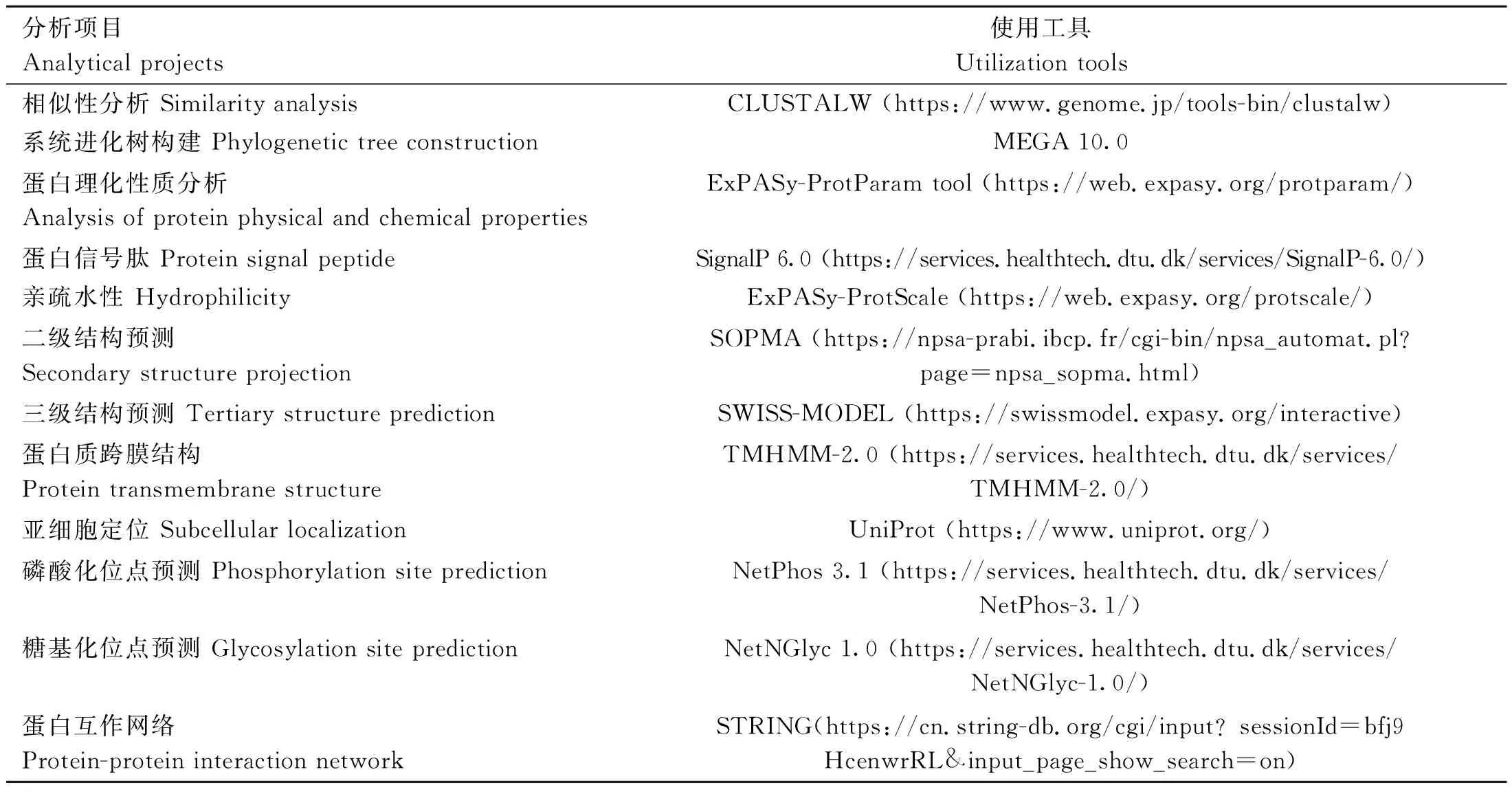
表1 生物信息学分析在线软件Table 1 The bioinformatics analysis online softwares
1.4 数据处理与统计分析
使用POPGENE Version32构建单倍型并计算SNPs位点的基因型频率、等位基因频率、有效等位基因数(Ne)、杂合度(He)、多态信息含量(PIC),并检验Hardy-Weinberg平衡。
利用SPSS24.0软件的混合线性模型(最小二乘分析)对FGF6不同基因型和单倍型组合与F2资源群经济性状进行关联分析,数据的多重比较使用邦弗伦尼(Bonferroni)校正。关联分析模型如下:
Yijklm=μ+Gi+Sj+ Hk+fl+eijklm。
式中:Yijklm为个体性状的表型值;μ为性状总体均值;Gi为基因型的固定效应(1~3);Sj为性别的固定效应(1, 2);Hk为批次的固定效应(1, 2);fl为家系的随机效应(1~7);eijklm为随机误差。P<0.05表示差异达到显着水平。
2 结 果
2.1 FGF6系统进化树和保守性分析
从NCBI数据库获得FGF6不同物种的氨基酸序列并进行分析(图1),利用CLUSTALW将获得的鸡FGF6基因序列与其他6个物种对比发现,鸡FGF6氨基酸序列与人、鼠、火鸡、非洲爪蟾、斑马鱼和绿海龟的序列相似性分别为65.05%、66.02%、91.26%、63.59%、68.29%、85.44%。不同物种FGF6氨基酸序列利用MEGA10.0软件进行多序列比对后构建系统进化树,结果显示鸡FGF6与火鸡亲缘关系最近,其次为绿海龟,与斑马鱼亲缘关系最远(图1A)。FGF6保守性分析表明FGF6在不同物种中保守性较高,拥有相同的motif1~4、6基序(图1B)。

A. 不同物种间FGF6系统进化树;B. 不同物种FGF6保守性分析A. Phylogenetic tree of FGF6 among different species; B. Conservativeness analysis of FGF6 among different species 图1 不同物种间FGF6氨基酸序列分析Fig.1 Amino acid sequence analysis of FGF6 among different species
2.2 鸡FGF6蛋白理化性质、信号肽、亲水性/疏水性和高级结构分析
利用Expasy-Protparam在线软件对鸡FGF6基因编码的氨基酸序列进行理化性质分析,结果显示FGF6蛋白分子式为C1023H1617N287O298S9,分子量为22 993.38 u,等电点(pI)为9.28,其蛋白不稳定系数(Ⅱ)为35.68,说明该蛋白为稳定蛋白。脂肪系数为89.47,总平均亲水性系数为-0.163,说明FGF6蛋白是亲水性蛋白。信号肽预测结果显示FGF6在第36~37位存在信号肽序列,概率为62.74%,推测其为分泌蛋白(图2A)。Expasy-ProtScale在线软件计算FGF6蛋白的疏水性,疏水性最大值为3.011(第27位氨基酸),最小值为-2.400(第70位和71为氨基酸),该蛋白为亲水性蛋白(图2B)。FGF6蛋白二级结构分析显示无规则卷曲占比44.17%,α螺旋占26.70%,β转角为8.74%,延伸链为20.39%(图2C)。FGF6蛋白三级结构预测结果与二级结构预测一致(图2D)。
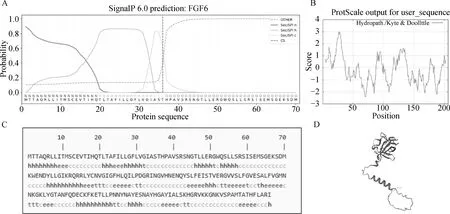
A.鸡FGF6蛋白质信号肽分析;B.鸡FGF6蛋白质疏水结构预测;C.鸡FGF6蛋白质二级结构分析(h.α-螺旋;t.β-转角;c.无规则卷曲;e.延伸链);D.鸡FGF6蛋白质三级结构预测A. Chicken FGF6 protein signal peptide analysis; B. Chicken FGF6 protein hydrophobic structure prediction; C. Chicken FGF6 protein secondary structure analysis (h.α-helix; t.β-turns; c.irregular coiling; e.elongated strand); D. Chicken FGF6 protein tertiary structure prediction图2 鸡FGF6蛋白质信号肽、亲疏水性及二、三级结构预测Fig.2 The prediction of chicken FGF6 protein signal peptide, hydrophilicity, potential secondary and tertiary structure
2.3 鸡FGF6跨膜域、亚细胞定位、磷酸化和N-糖基化分析
利用TMHMM-2.0进行蛋白质跨膜结构预测,结果显示,FGF6第21~40位氨基酸处存在一个跨膜区域(图3A)。利用UniProt进行亚细胞定位,GO注释显示FGF6位于细胞质和细胞外空间(图3B)。利用NetPhos 3.1进行磷酸化预测,结果显示,FGF6蛋白有12个丝氨酸、5个苏氨酸和5个酪氨酸位点发生磷酸化(图3C)。利用NetNGlyc 1.0进行糖基化预测,结果显示FGF6蛋白第44位氨基酸处有一个N糖基化位点,可能性为74.42%(图3D)。
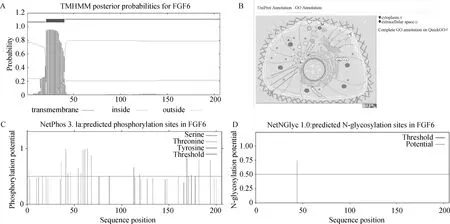
A.鸡FGF6蛋白质跨膜分析;B.鸡FGF6蛋白质亚细胞定位预测;C.鸡FGF6蛋白磷酸化位点预测;D.鸡FGF6蛋白糖基化位点预测A. Chicken FGF6 protein transmembrane analysis; B. Prediction of subcellular localization of chicken FGF6 protein; C. Prediction of chicken FGF6 protein phosphorylation sites; D. Prediction of chicken FGF6 protein glycosylation sites图3 鸡FGF6蛋白质跨膜结构、亚细胞定位、磷酸化、糖基化位点预测Fig.3 Predicted transmembrane structure, subcellular localization, phosphorylation and glycosylation sites of chicken FGF6 protein
2.4 鸡FGF6蛋白互作分析
利用STRING在线软件对FGF6的互作蛋白进行预测分析,结果显示FGF6与FGFR1、FGFR2、FGFR3、FGFR4和表皮生长因子(Epidermal growth factor,EGF)等5个蛋白可能存在相互作用(图4)。
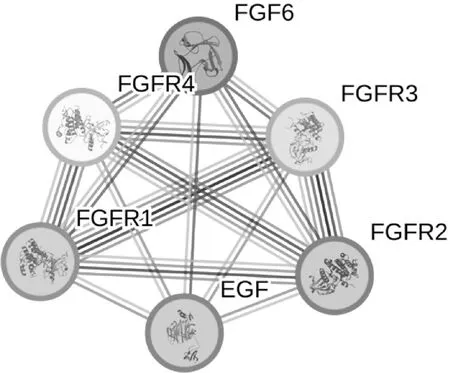
图4 鸡FGF6蛋白与其他蛋白相互作用网络分析Fig.4 Network analysis of chicken FGF6 protein interaction with other proteins
2.5 鸡FGF6基因遗传变异位点的筛选
根据GenBank公布的鸡FGF6基因序列(XM_001 232 070.4),下载获取FGF6基因组启动子区域2 kb(73397575-73410291(-))序列,基于实验室保存的固始鸡-安卡鸡F2资源群的GBS数据(GRCg6a版本)[17],筛选FGF6基因组包含启动子区域2 kb序列在固始鸡-安卡鸡F2资源群GBS数据中存在的所有SNPs位点,共得到6个遗传变异位点,均位于第1内含子上,见表2。
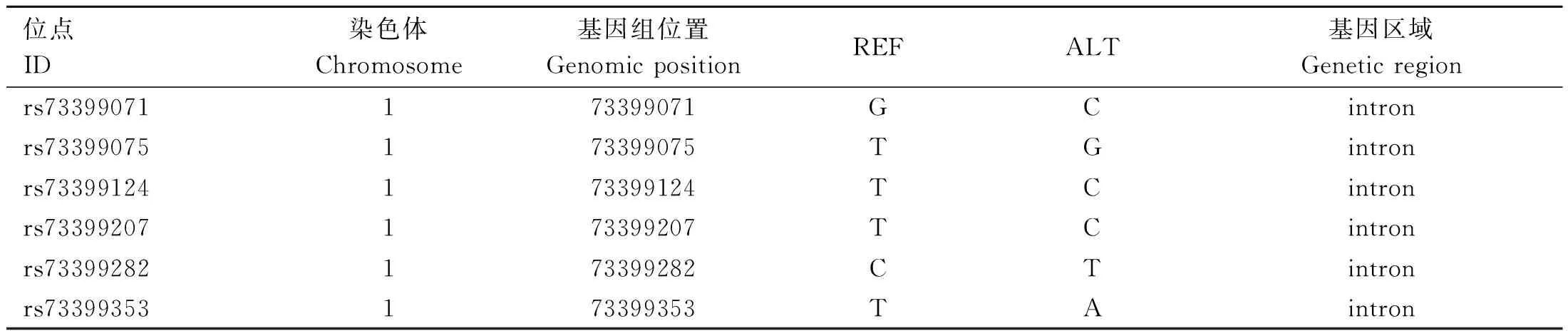
表2 鸡FGF6基因上SNPs信息Table 2 SNPs information on chicken FGF6 gene
2.6 群体遗传学分析
对鸡FGF6基因的多态性进行群体遗传学分析表明,在F2资源群中,6个SNPs位点均存在3种基因型,其中rs73399071位点的优势基因型为GG(n=467),基因型频率为0.650;rs73399075位点的优势基因型为TT(n=590),基因型频率为0.821;rs73399124位点的优势基因型为CC(n=541),基因型频率为0.752;rs73399207位点的优势基因型为TT(n=367),基因型频率为0.510;rs73399282位点的优势基因型为CC(n=438),基因型频率为0.609;rs73399353位点的优势基因型为TA(n=313),基因型频率为0.435。除rs73399353外,其余5个位点均处于Hardy-Weinberg平衡状态(P<0.001)。6个多态位点的有效等位基因数(Ne)介于1.419 3~2.853 2,杂合度(He)介于0.295 4~0.649 5,多态信息含量(PIC)介于0.484 9~1.073 4。各位点的等位基因频率,Ne、He、PIC等群体遗传学指标统计结果见表3。
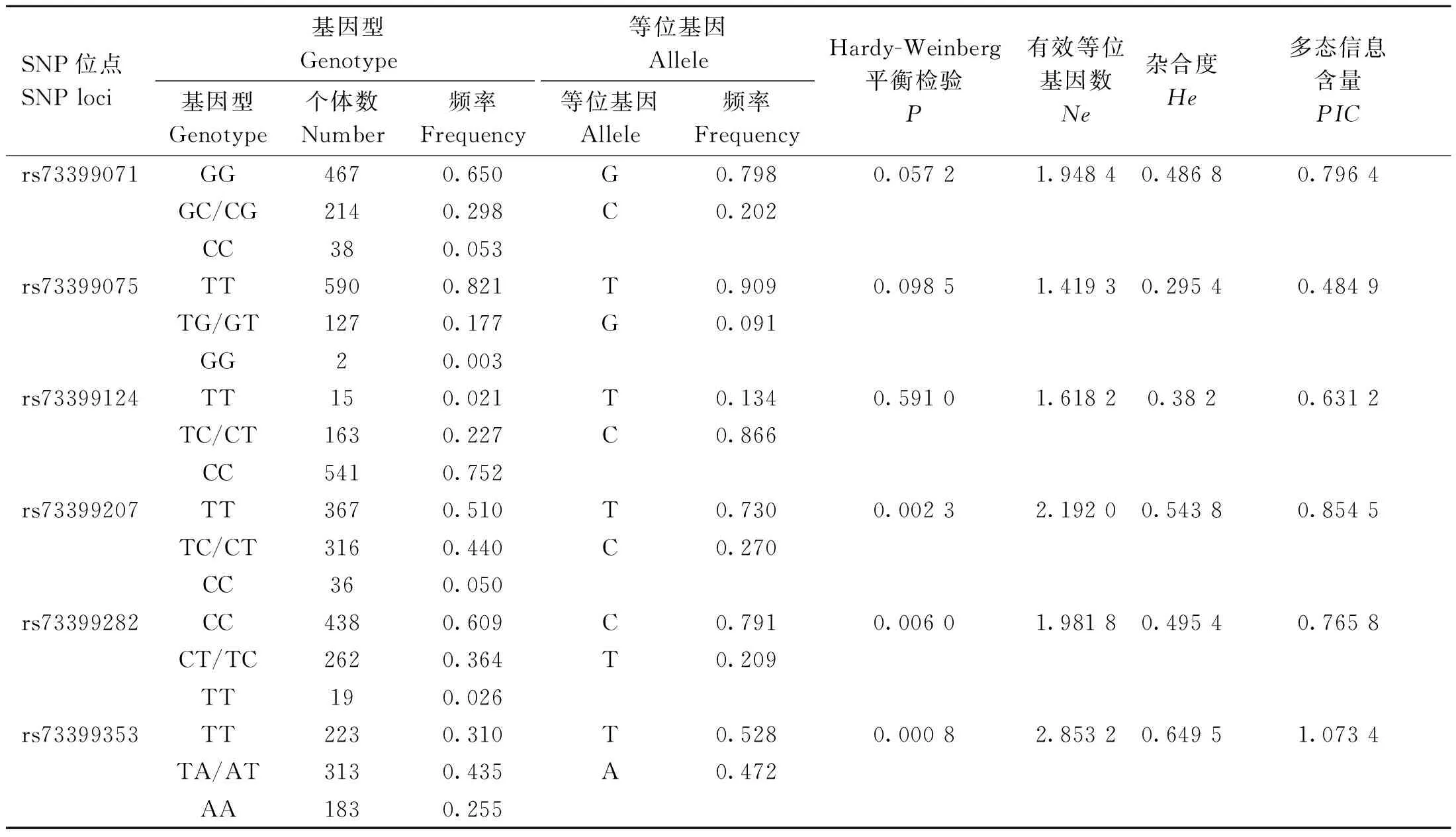
表3 F2资源群FGF6基因SNPs位点的遗传特性Table 3 Genetic characterization of the SNPs loci of the FGF6 gene in the F2 resource population
2.7 连锁不平衡分析
利用Haploview 4.2软件对rs73399071、rs73399075、rs73399124、rs73399207和rs73399282这5个处于哈代-温伯格平衡位点进行连锁不平衡(LD)分析(图5),结果显示,这5个位点之间完全连锁(D′=1,r2=1)(图5A),后续使用rs73399071位点进行关联分析;存在6种单倍型,其中GTCCC是主要单倍型,比例为0.257,其次是GTCTT和GTCTC,比例分别是0.202和0.199(图5B)。
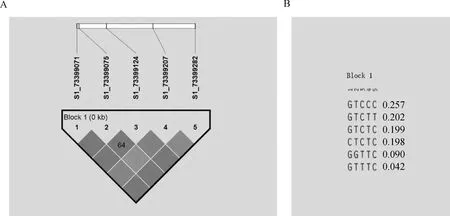
A.SNPs连锁不平衡分析;B.单倍型模块分析。颜色越深表示D′越高,数字表示R2A. SNPs linkage disequilibrium analysis; B. Haplotype module analysis. Darker colors indicate higher D′, numbers indicate R2图5 鸡FGF6基因5个位点连锁不平衡分析Fig.5 Linkage disequilibrium analysis of 5 loci of chicken FGF6 gene
2.8 单倍型分析
由表4可知,鸡FGF6基因5个处于哈代-温伯格平衡的SNPs位点共存在28种单倍型组合,其中以GCTTCCTCCC组合的频率最高(0.134 9),GGTTCCTCCT组合的频率(0.126 6)次之,GCTGTCTTCC、GCTTCCCCCC、GCTTCCTCCT、GG-GGTTTCCC、GGGGTTTTCC、GGTGTCTCCT和GGTTTTTCCC组合的频率最低(0.001 4)。为避免因个体数太少引起的误差,单倍型关联分析时剔除个体数少于30的单倍型组合。
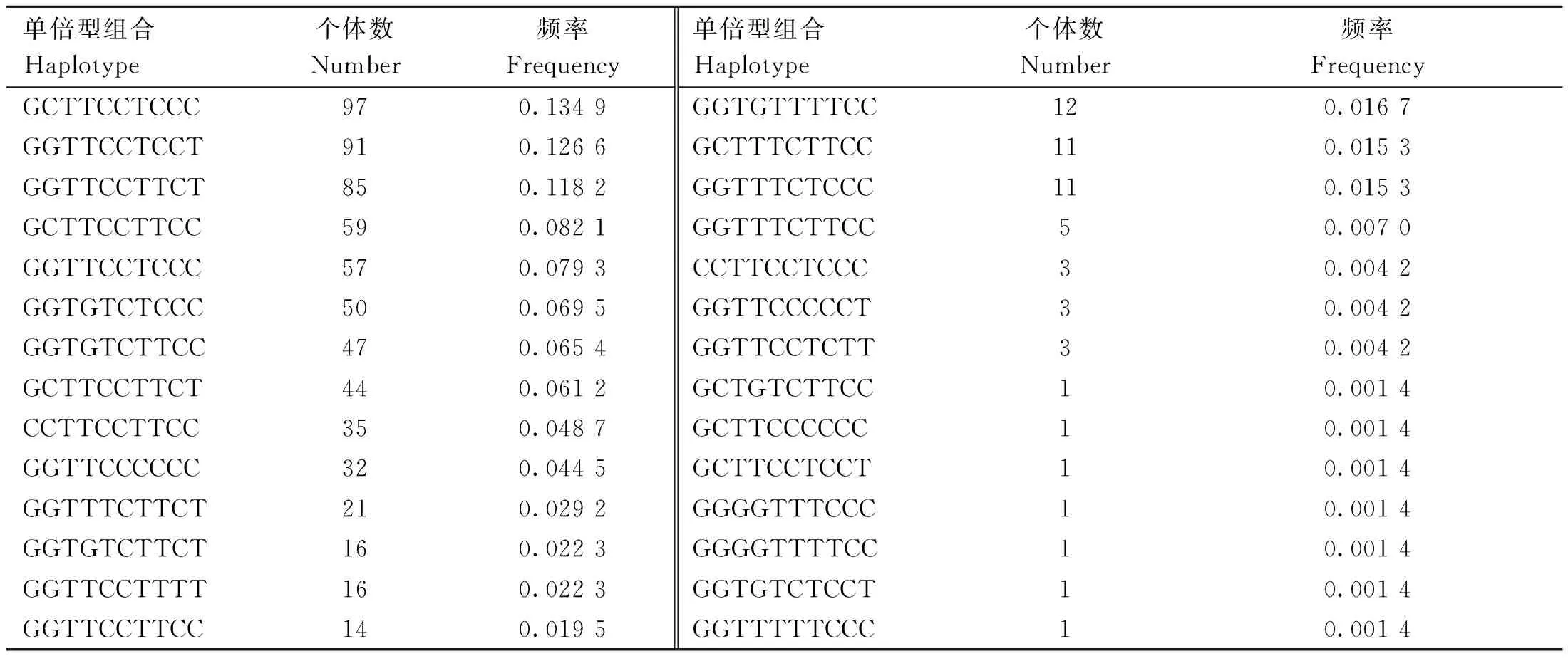
表4 单倍型组合及其频率Table 4 Haplotype combinations and their frequencies
2.9 rs73399071位点与F2资源群生长性状的关联分析
LD分析结果显示5个位点之间强连锁,且属于Block1中,因此仅对rs73399071位点的不同基因型与F2资源群体相关经济性状进行了关联分析。如表5~8所示,rs73399071位点与鸡0周龄胫长、2周龄体重、4周龄体重、胫围、胸骨长、体斜长、骨盆宽、6周龄体重、8周龄体重、胸宽、胸骨长、胸角、10周龄体重和12周龄体重在内的17个性状显着相关(P<0.05);且大部分CC突变基因型个体的表型均值普遍高于野生基因型GG(表5)。与其他生长性状关联不显着(数据未显示)。
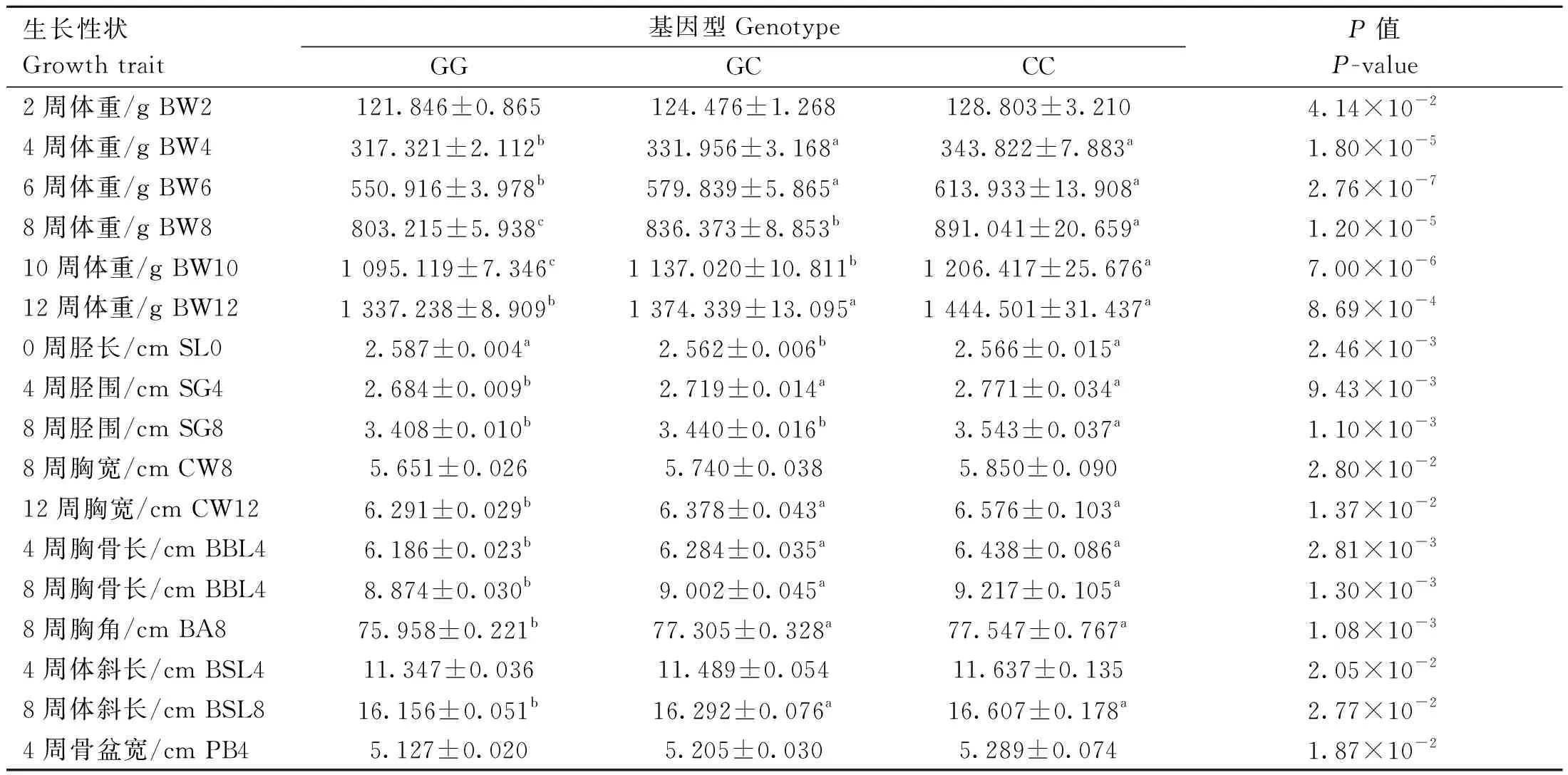
表5 鸡FGF6基因遗传变异位点rs73399071与F2资源群生长性状的关联分析Table 5 Association analysis of genetic variant locus (rs73399071) of chicken FGF6 gene with growth traits in F2 resource population
2.10 rs73399071位点与F2资源群屠体性状的关联分析
rs73399071位点与鸡胸肌重、腿重、腿肌重、屠体重、半净膛重、全净膛重、肝脏率、腿肌重率、半净膛率和全净膛率10个屠体性状显着相关(P<0.05)。除腿肌重率外,该位点与其他9个表型性状极显着相关(P<0.01)。且突变基因型CC型个体表型均值普遍显着高于GG基因型(表6)。与其他屠体性状关联不显着(数据未显示)。
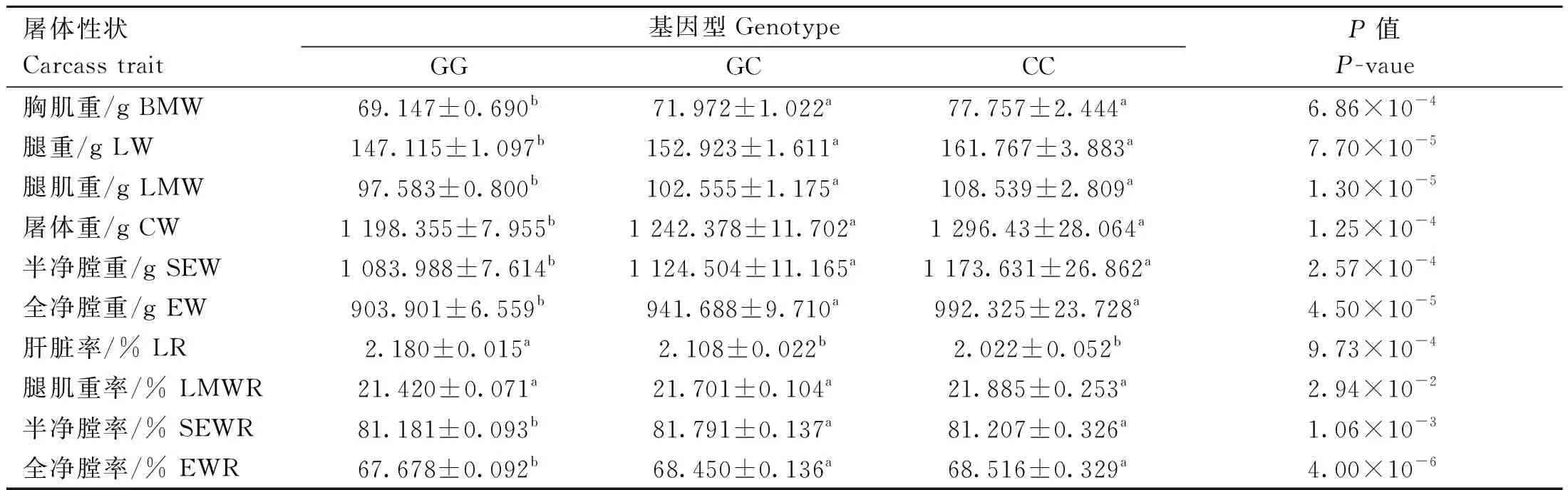
表6 鸡FGF6基因遗传变异位点(rs73399071)与F2资源群屠体性状的关联分析Table 6 Association analysis of genetic variant locus (rs73399071) of chicken FGF6 gene with carcass traits of F2 resource population
2.11 rs73399071位点与F2资源群肉质性状的关联分析
rs73399071位点与肉质性状的关联分析结果显示,如表7所示,该位点与腿肌剪切力、胸肌剪切力、胸肌失水率和腿肌失水率的关联均未达到显着水平(P>0.05)。
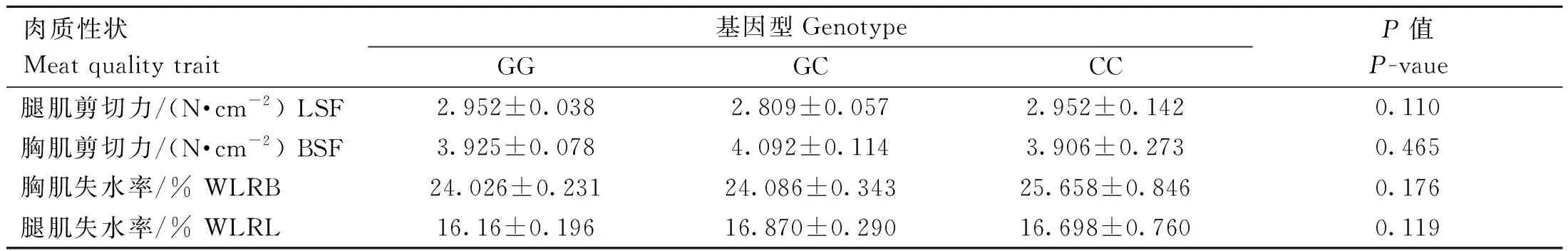
表7 鸡FGF6基因遗传变异位点(rs73399071)与F2资源群肉质性状的关联分析Table 7 Association analysis of genetic variant locus (rs73399071) of chicken FGF6 gene with meat quality traits in F2 resource population
2.12 rs73399071位点与F2资源群血清生化指标的关联分析
rs73399071位点与F2资源群血清生化指标的关联结果分析如表8所示,该位点与胆碱酯酶和高密度脂蛋白显着相关(P<0.05),其中GG基因型和CC基因型普遍高于GC基因型。与其他血清生化指标关联不显着(数据未显示)。
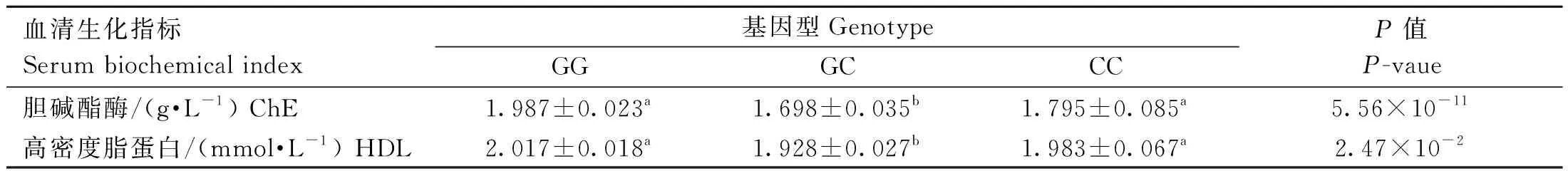
表8 鸡FGF6基因遗传变异位点(rs73399071)与F2资源群血清生化指标的关联分析Table 8 Association analysis of genetic variant locus (rs73399071) of chicken FGF6 gene with serum biochemical indexs of F2 resource population
2.13 不同单倍型组合与鸡生长性状的关联分析
不同单倍型组合与生长性状关联分析结果如表9和表10所示,CCTTCCTTCC单倍型组合个体的4周体重、胸骨长,6周体重,8周体重、胫围,10周体重和12周体重、胸宽均最高,4周胫围、8周胸宽和胸骨长以GGTTCCCCCC组合最高,4周体斜长以GCTTCCTTCT组合最高;与其他体重性状关联不显着(数据未显示)。
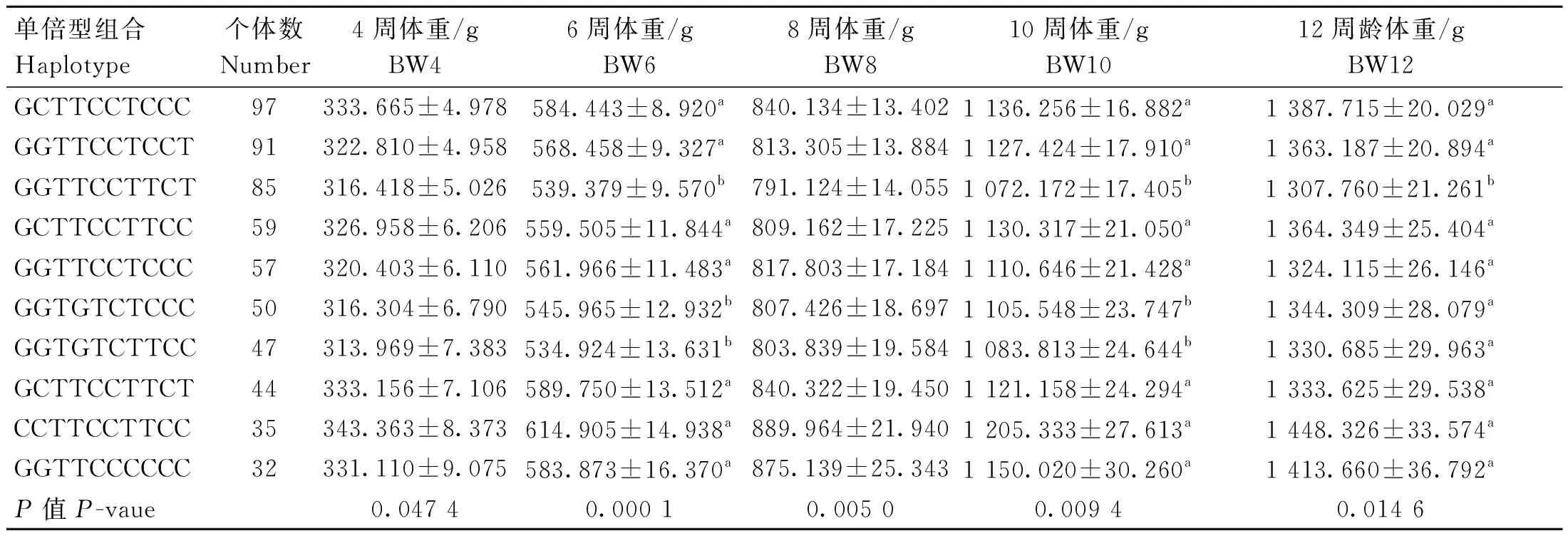
表9 SNPs位点单倍型组合与鸡不同阶段体重的关联分析Table 9 Association analysis of haplotype combinations at SNPs loci and chicken body weight at different stages
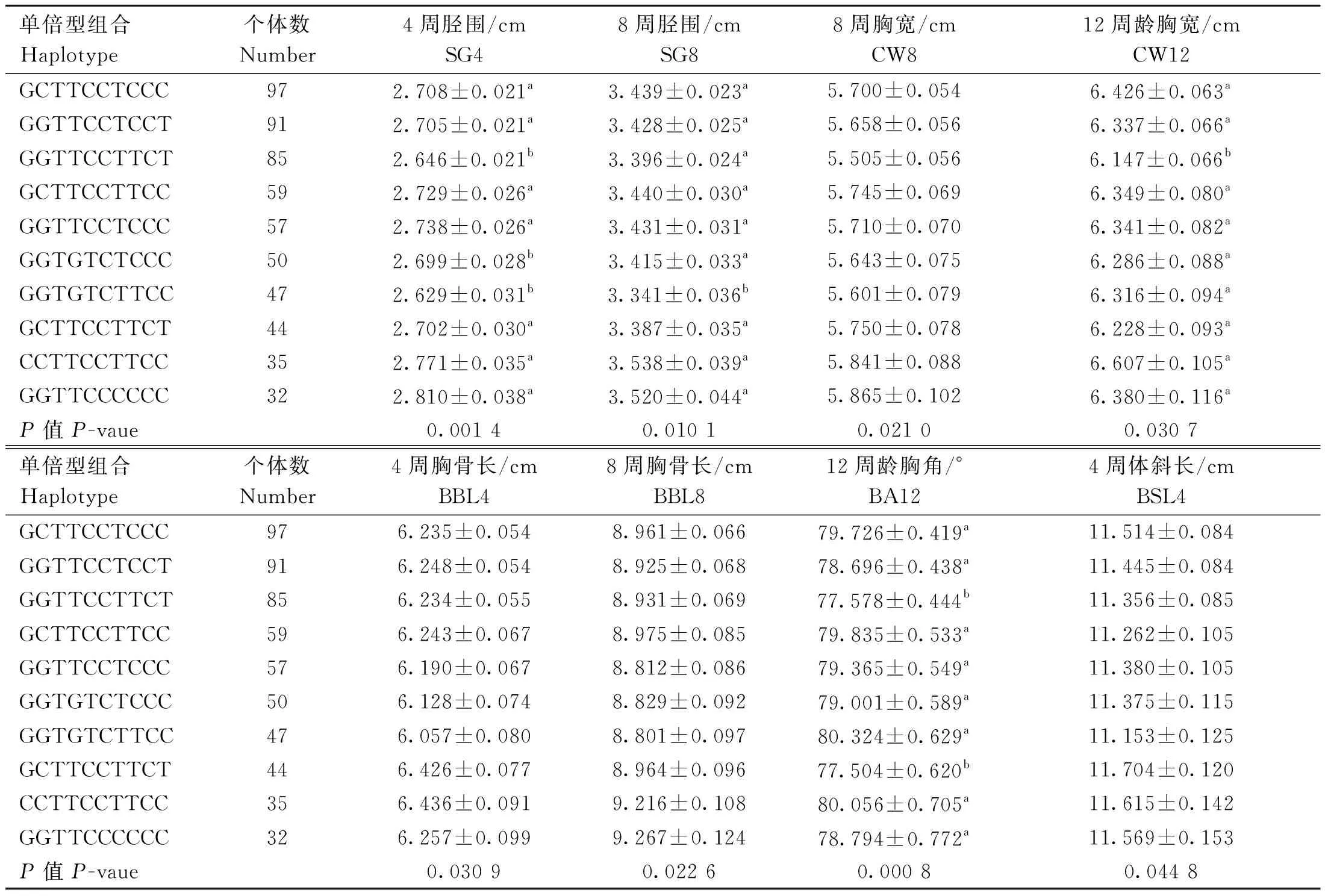
表10 SNPs位点单倍型组合与鸡不同阶段体尺的关联分析Table 10 Association analysis of haplotype combinations at SNPs loci and chicken body size at different stages
3 讨 论
本研究对不同物种FGF6基因编码的氨基酸序列进行同源性比对,结果显示,鸡与火鸡的同源性达91%以上,与非洲爪蟾同源性较低,表明FGF6基因在鸟类中的保守性较高。同源性在一定程度上反映亲缘关系的远近,通过构建系统进化树显示鸡FGF6与火鸡亲缘关系较近,与爬行类(绿海龟)和两栖类(热带爪蟾)次之,与鱼类(斑马鱼)最远。由于鸡FGF6基因能够与其他脊椎动物聚集在一起,说明这些物种的FGF6基因可能由同一祖先进化而来。同时经过序列比对发现,鸡FGF6与其他6个物种存在相同的5个motif基序,推测其可能是在鸡FGF6执行主要生理功能的蛋白片段。通过分析其疏水性和跨膜结构得知鸡FGF6蛋白表现为亲水性蛋白,存在跨膜区。鸡FGF6蛋白的高级结构(二级、三级结构)主要由无规则卷曲和α-螺旋组成。
蛋白质磷酸化是一种广泛的蛋白质翻译后修饰(post-translational modifications,PTMs)方式,也是一种最有效的调控途径,是由蛋白质激酶催化的磷酸基转移反应,在调控细胞周期、信号传导和影响肉品质变化等生物过程中发挥重要作用[19-21]。鸡FGF6蛋白存在12个丝氨酸、5个苏氨酸和5个酪氨酸磷酸化位点,这些磷酸化位点对于FGF6的转运、接收和表达可能具有重要意义。鸡FGF6蛋白有1个N-糖基化位点。糖基化也是一种重要的蛋白质翻译后修饰方式,能够通过调控蛋白质的电荷态、结构及分子间相互作用影响其功能[22],参与细胞免疫、信号传导、细胞壁的合成、蛋白质的翻译调控和蛋白降解等生物过程[23-24]。通过蛋白互作分析发现,鸡FGF6蛋白与FGFR1、FGFR2、FGFR3、FGFR4等成纤维细胞生长因子受体家族蛋白均有互作关系,有研究表明FGF成员的生物学活性是通过与FGFR1~4受体结合,启动MAPK(有丝分裂原激活的蛋白激酶)信号通路,从而刺激纤维细胞的生长、分裂增殖[25],这也说明鸡FGF6蛋白与其受体存在互作,具有一定的研究价值。
相关研究表明,FGF6基因会对骨骼肌发育、修复再生等方面产生一定影响[26-28]。FGF6基因多次被鉴定为影响经济性状的候选基因[29-31],但目前国内外在鸡FGF6基因多态性上未有相关研究报道。杂合度(He)、有效等位基因数(Ne)和多态信息量(PIC)常用来衡量一个群体的遗传变异程度,其数值越大,表明试验群体遗传变异度越高,遗传丰富度越高[32]。本研究对鸡FGF6基因遗传特性分析发现,6个SNPs位点均处于高等多态性、5个SNPs处于Hardy-Weinberg平衡。可能是本试验中所用群体处于闭锁的生长繁育环境,导致了这种动态平衡。单位点分子标记通常适用于大规模群体的遗传分析,如种质资源的遗传多样性评估、品种鉴定和遗传改良中的辅助选择[33-34]。本研究通过对鸡FGF6基因多态性与经济性状进行关联分析,发现rs73399071位点(G>C)与F2资源群不同阶段的体重、胫长、胫围、体斜长等17个生长性状表型指标显着相关(P<0.05),与全净膛重、半净膛重、屠体重等10个屠体性状表型指标显着相关(P<0.05),但与肉质性状的关联未达到显着水平(P>0.05),总体来看,CC基因型(突变型)普遍优于GG基因型(野生型),故在生产实践上rs73399071位点可以作为鸡生长性状和屠体性状的候选分子标记,选留CC基因型个体用于辅助育种,提高经济效益。
在之前的研究中,一般认为基因突变发生在内含子区域不会直接改变蛋白质的氨基酸序列,故不会对其生物学特性产生影响[35]。但随着研究的深入,人们发现内含子可能潜在地影响剪切、mRNA加工、转录和表达调控等各种细胞过程,内含子的变异可能导致剪切准确性或效率的变化,从而导致氨基酸编码的变化,最终改变真核生物的表型[36-38],如紧密蛋白2(TJP2)基因内含子突变(9q21.11位点)通过改变TJP2基因的表达和促进经表皮水分流失而赋予特应性皮炎(AD)易感性[39]。本研究在FGF6基因上共筛选到6个位于内含子区域的SNPs(rs73399071、rs73399075、rs73399124、rs73399207、rs73399282、rs73399353),其中rs73399071突变位点与经济性状相关表型关联显着,该位点是否对FGF6基因的表达产生影响,以及如何调控基因来影响动物表型后续还需进一步验证。
动物的表型受单个突变位点和多个突变位点组合效应的影响,其后者影响较为重大[40]。因为在研究遗传变异对表型的影响时,单个SNP分析作用较小,单倍型分析可以提供更丰富的信息[41-43]。单倍型组合分析通常适用于复杂性状的遗传研究,例如复杂疾病的关联分析和数量性状的QTL定位[44]。本研究发现,FGF6基因的CCTTCCTTCC单倍型组合个体的BW4、BW6和BW10均高于其他9种单倍型组合;GGTTCCCCCC单倍型组合个体的SG4、CW8和BBL8高于其他9种单倍型组合,而其SG8和CW12低于CCTTCCTTCC单倍型组合;GCTTCCTTCT单倍型组合的BBL4和BSL4高于其他组合;GGTGTCTTCC单倍型组合的BA12高于其他单倍型。不同单倍型组合对不同阶段体重和体尺指标的关联效果不同。考虑到该研究的样本量,有些单倍型个体数较少,产生的试验结果具有一定的误差,后续还需要进一步扩大样本量来验证和探讨。
4 结 论
本研究发现,鸡FGF6氨基酸序列与火鸡亲缘关系最近,与斑马鱼亲缘关系最远;不同物种间保守性较高且其与FGFR1、FGFR2、FGFR3、FGFR4、EGF共5个蛋白可能存在相互作用。鸡FGF6基因内含子6个遗传变异位点均表现出高度多态性(PIC≥0.5),且存在强连锁,GTCCC是主要单倍型;FGF6基因遗传变异位点rs73399071与固始鸡-安卡鸡F2资源群的生长性状、屠体性状和血清生化指标显着相关,且CCTTCCTTCC单倍型组合个体具有较高的体重。相关结果显示,rs73399071位点可以作为改良鸡生长性状的分子标记用于辅助选择,表明FGF6基因可能在鸡生长发育中发挥着重要的作用。本研究为进一步深入研究FGF6基因在鸡上的生物学功能提供重要的参考。



