杨 杨,余 乾,刘昱成 ,杨 华,赵 卓,王立民 ,周 平,杨庆勇,2* ,代 蓉*
(1.新疆农垦科学院,省部共建绵羊遗传改良与健康养殖国家重点实验室,石河子 832000;2.华中农业大学信息学院,武汉 430070)
新疆是传统养殖大省也是牛羊肉消费大省。统计局公布数据显示,2022年底新疆羊肉产量60.72万吨占全国的11.58%,羊胴体重平均16 kg以上,高出全国平均水平,但与美国、澳大利亚等畜牧业发达国家还存在较大差距。影响羊肉用性能的因素很多[1],其中品种是肉用性能提升的基础,而携带优良肉用性能基因是产肉能力提升的核心[2]。
骨骼肌的生长发育与绵羊产肉性能密切相关,肌纤维直径的大小和肌内脂肪含量多少是评价肉品质的重要指标[3]。肌球蛋白是肌原纤维的组成单位,由两条重链和四条轻链组成。肌球蛋白轻链(myosin light chain,MYL)是由基础性轻链(essential light chain,ELC)和调节性轻链(regulatory light chain,RLC)组成的多基因家族[4],在维持重链构象、调节骨骼肌发育和肌纤维活性中发挥作用[5-6]。人基因组中已鉴定出 13 个MYL基因,其中MYL1、MYL3、MYL4、MYL6和MYL6B 是 ELC 型,其他属于 RLC 型[7]。有研究发现,MYL家族成员对羊肌细胞的生长发育也有调节作用[8-10]。Zhan等[11]分析了增殖和分化阶段的山羊骨骼肌卫星细胞表达谱,发现MYL2 基因参与调控山羊骨骼肌生成。MYL2 基因不仅参与产前肌肉纤维的产生,还涉及与肌肉发育相关的信号通路[12]。Xie 等[13]分析了内蒙古绒山羊不同部位的肌肉组织蛋白谱,鉴定出MYL3 基因在股二头肌中显着高水平表达,推测其表达水平与肌肉韧性有关。Noce 等[14]利用表达谱芯片分析了西班牙5个品种的肉用绵羊骨骼肌转录组,确定MYLPF在调节肌肉收缩上发挥重要作用。
综上所述,MYLs在肌肉发生发育和功能形成方面有重要作用,但该基因家族在绵羊基因组中的成员及特性等缺乏系统全面的了解。因此,本研究利用生物信息学方法在绵羊基因组水平筛选MYL基因家族成员,并分析其理化性质、基因结构、染色体分布、选择压力和蛋白互作,比较MYLs在绵羊与山羊和牛基因组上的进化关系,确定MYLs在不同品种绵羊中的组织表达模式,为深入探讨绵羊MYLs基因调控肌肉生长发育的作用机制奠定基础。
1 材料与方法
1.1 试验动物
试验羊均来自石河子市新疆农垦科学院华宇基地种羊场。随机选取饲养环境一致的军垦白肉羊(n=3)、新疆细毛羊(n=3)和湖羊(n=3)成年公羊,屠宰后立即取骨骼肌(腿)、大肠、小肠、背最长肌、心、肝、瘤胃、脾、肺、肾等组织样品,放入-80 ℃液氮中保存,以备提取 RNA。
1.2 主要试剂
动物组织总 RNA 提取试剂盒(DP431)、凝胶回收试剂盒(DP219)和SuperReal 荧光定量预混试剂增强版(SYBR Green、FP205)都购自天根生化科技(北京)有限公司,pMD19-T 载体、cDNA 第一链合成试剂盒(RR047A)购自 TaKaRa 公司,大肠杆菌 DH5α 感受态细胞、T4 DNA 连接酶购自生工生物工程(上海)股份有限公司。
1.3 数据来源
研究中的参考基因组数据及相关基因的编码序列和氨基酸序列均从公共数据库中获得。NCBI(https://www.ncbi.nlm.nih.gov/)中下载绵羊参考基因组(GCA_016 772 045.1),从 Ensemble(http://asia.ensembl.org/index.html)获得绵羊(Ovisaries)、山羊(Caprahircus)、人(Homosapiens)、鼠(Musmusculus)、猪(Susscrofa)和牛(Bostaurus)MYLs 的氨基酸序列。基于省部共建绵羊遗传改良与健康养殖国家重点实验室杨庆勇团队构建的多物种全组织表达谱数据库 HTIR(http://yanglab.hzau.edu.cn/HTIR#/)获取成年湖羊脑、心、肝、脾、肺、结肠、骨骼肌等 17 个组织的表达量数据。
1.4 方法
1.4.1 引物设计与合成 根据 NCBI 公布的绵羊MYL1、MYL6B 和MYLPF的 CDS 序列,利用 PrimerPremier 5.0 软件设计基因克隆引物和荧光定量 PCR 引物(表1)。引物由赛默飞世尔科技公司合成。
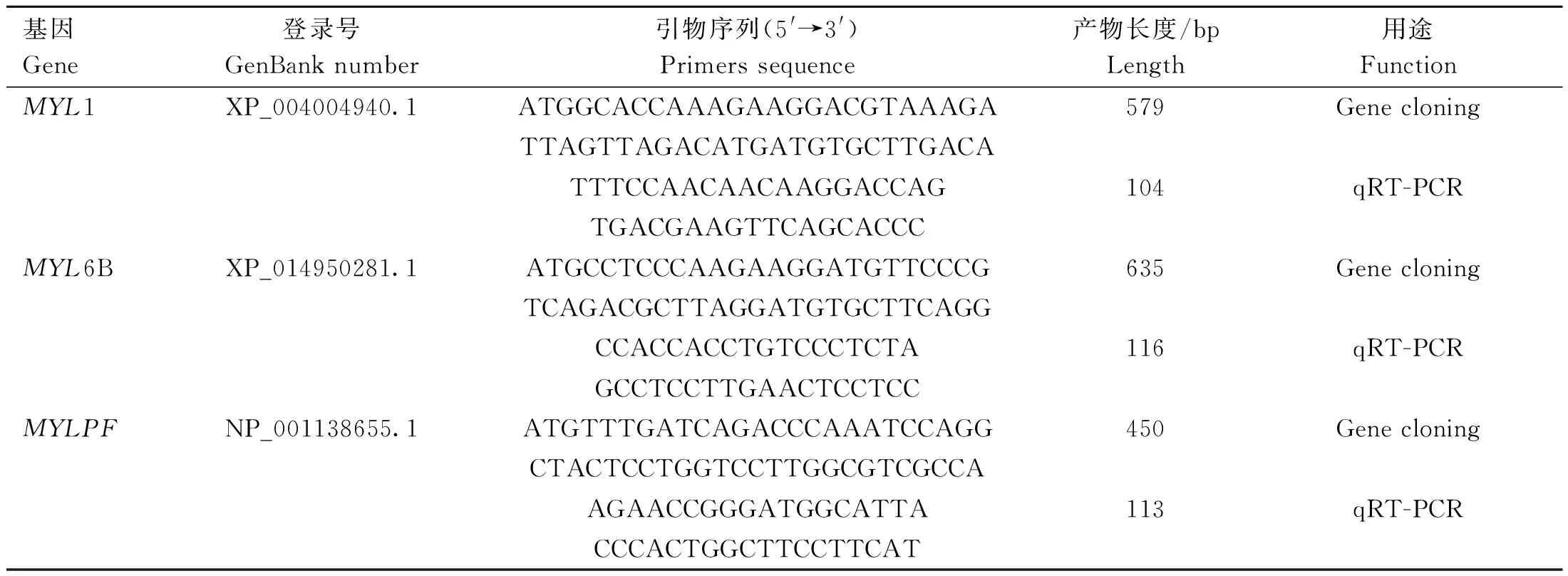
表1 引物信息Table 1 Primers information
1.4.2 RNA 提取和 cDNA合成 根据 RNA 提取试剂盒提取各组织样的总 RNA。取 1 μL提取的总 RNA 用核酸蛋白检测仪测定 RNA 的质量浓度,取 5 μL用 0.8% 琼脂糖凝胶电泳检测 RNA 完整性。检测合格的 RNA 反转录为 cDNA,-20 ℃ 保存备用。
1.4.3MYL1、MYL6B 和MYLPF基因克隆与测序 以军垦白肉羊背最长肌 cDNA 为模板,扩增 3 个目的基因完整的 CDS 区,扩增体系(15 μL):模板 cDNA 1.0 μL,上、下游引物(10 μmol·L-1)各0.5 μL,2×taq PCR MasterMix Ⅱ 7.5 μL,ddH2O 5.5 μL。反应程序:94 ℃预变性8 min;95 ℃ 30 s,59 ℃ 30 s,72 ℃ 1 min,共 35 个循环;72 ℃延伸 10 min;4 ℃ 保存。产物经 1.5% 琼脂糖凝胶电泳检测后,使用胶回收试剂盒回收目的片段,随后将目的片段和载体 pMD19-T 连接、进行转化及鉴定,挑取阳性克隆送至生工生物工程(上海)股份有限公司测序。
1.4.4 qRT-PCR 按照试剂盒推荐方法,qRT-PCR 采用 20 μL 反应体系:2×SuperReal PreMix Plus 10 μL,cDNA 1 μL,上、下游引物各 0.6 μL,补足 RNase-free ddH2O 至终体积20 μL。PCR 程序:95 ℃ 15 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 30 s,共 40 个循环。循环结束后通过熔解曲线检测引物的特异性。以GAPDH作为内参基因,每个样品3次重复,采用 2-ΔΔct法计算基因相对表达量,使用 GraphPad Prism 8 软件分析作图。
1.5 MYL 基因家族的生物信息学分析
1.5.1 绵羊MYL基因的鉴定、染色体定位和理化性质分析 利用在线数据库 Pfam 检索绵羊 MYLs 蛋白保守结构域。以绵羊 MYLs 蛋白序列作为查询序列,在绵羊蛋白质序列数据库进行 Blastp 比对,通过 NCBI 的 CD-search 在线工具进行验证,并利用绵羊参考基因组的MYL基因信息进行注释校正[15]。使用 TBtools(v1.09)软件[16]的 Gene Location Visualize(Advanced)绘制染色体定位图。通过在线软件 ExPASy 分析绵羊 MYLs 的氨基酸数目、等电点、分子量和亲疏水性均值等信息。采用 WOLF PSORT 在线工具研究蛋白亚细胞定位。利用 SignalP 和 TMHMM sever 2.0 在线平台预测MYLs基因家族蛋白质的跨膜结构域等[17]。
1.5.2 基因结构和保守基序分析 利用 MEME 在线平台预测 MYLs 的蛋白保守基序(Motif),基序数量参数为 10,其他参数默认。采用 TBtools 软件对绵羊MYLs的进化关系、蛋白保守结构域、基因结构和 Motif 进行可视化分析。
1.5.3 系统进化树的构建 利用 MEGA7.0 软件内置的 Clustal W 程序对绵羊、山羊、人、鼠、猪和牛的 MYL 蛋白质序列进行序列比对,分析结果用 Neighbor-joining 方法构建系统发生树[18],选用泊松模型,校验参数 bootstrap 设置为1 000次重复,其他参数默认[19]。利用在线工具 iTOL(https://itol.embl.de)渲染系统发育树。
1.5.4 共线性分析 在 TBtools 软件的 MCScanX 功能界面分析绵羊MYL基因的复制事件,并分析绵羊和山羊(GCA_001 704 415.1)牛(GCA_002 263 795.3)之间的同源性,随后利用 Advanced Circos 和 Dual Systeny Plot 进行可视化。提取绵羊、山羊和牛的MYLs基因 CDS 序列,通过 Simple Ka/Ks Calculator(NG)计算其非同义(Ka)和同义(Ks)替换。
1.5.5 蛋白质二级结构预测及互作网络分析 利用 SOPMA 在线软件预测绵羊 MYLs 的蛋白质二级结构。使用 STRING(https://string-db.org/cgi/input?sessionId)构建蛋白质互作网络,蛋白质来源设置为绵羊(Ovisaries),其他参数默认,分析绵羊 MYL 与其他蛋白质及家族成员间的相互作用。
1.5.6 羊MYL家族基因表达模式分析 在本实验室构建的 HTIR 数据库中下载湖羊全组织转录组数据,从基因表达量数据(TPM)文档中提取各组织MYLs 表达数据,利用 TBtools 软件的 Heatmap界面绘制湖羊MYLs在 17 个组织的表达量热图[20]。
2 结 果
2.1 绵羊 MYLs 的鉴定及其在染色体上的分布
基于蛋白质保守结构域和系统进化关系,在绵羊基因组中鉴定到 12 个MYLs家族成员。根据基因注释文件命名为MYL1、MYL2、MYL3、MYL4、MYL6、MYL6B、MYL7、MYL9、MYL10、MYLPF、MYL12A 和MYL12B。12个MYLs基因分布在9条染色体上(图1),其中MYL6 和MYL6B 位于 3 号染色体,MYL3 和MYL12A 位于 19 号染色体,MYL10 和MYLPF位于 24 号染色体,剩余6个成员分布在 2、4、11、13、17 和 23 号染色体。
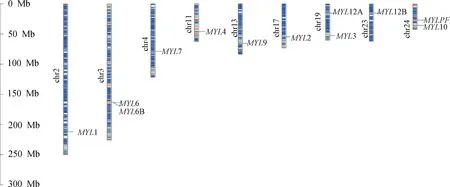
图1 绵羊 MYLs 在染色体上的分布Fig.1 The chromosomes distribution of the MYLs in sheep
ExPASy 对蛋白质理化性质分析的结果显示,绵羊MYLs基因编码蛋白质的氨基酸数量在147个(MYL10)~211个(MYL6B)之间,相对分子质量在 16 695.86(MYL7)~23 388.92(MYL6B)之间,等电点范围为 4.37(MYL7)~5.40(MYL6B),脂肪指数为 52.27(MYL9)~82.18(MYL6B),不稳定系数在 24.73(MYL10)~56.48(MYL4)范围内(表2),无信号肽和跨膜结构域。亲疏水性指数结果显示,12 个成员均为亲水性蛋白。MYL6B 和 MYLPF 蛋白亚细胞定位在线粒体,其他成员均在细胞质中。
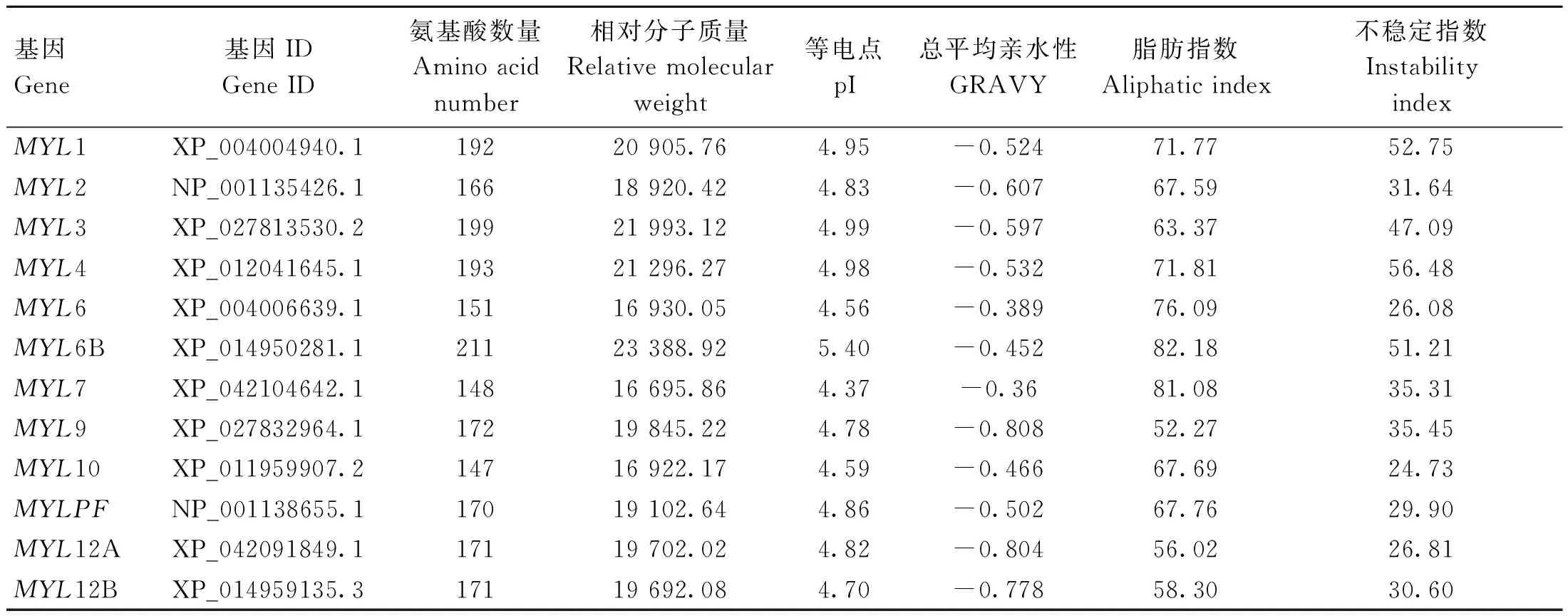
表2 绵羊 MYL 基因家族的理化性质Table 2 Physicochemical properties of MYL gene family in sheep
2.2 绵羊 MYLs 基因结构、结构域和保守基序分析
参考人MYLs的划分类型[5],结合系统进化树结果(图2),以基因结构为参考将绵羊MYL家族成员分成 3 组,其中MYL2、MYL7、MYL10 和MYLPF在组 Ⅰ,MYL9、MYL12A 和MYL12B 在组 Ⅱ,组 Ⅰ 和组 Ⅱ 同属于 RLC 型;组 Ⅲ 包括MYL1、MYL3、MYL4、MYL6 和MYL6B 是 ELC 型。EF-hand 结构域(PF13405)是MYLs家族成员共有的保守结构域。MYLs的外显子数目在 1~8个之间,其中MYL1 和MYL7 包含 8 个外显子,有 6 个外显子的基因最多,占 50%。
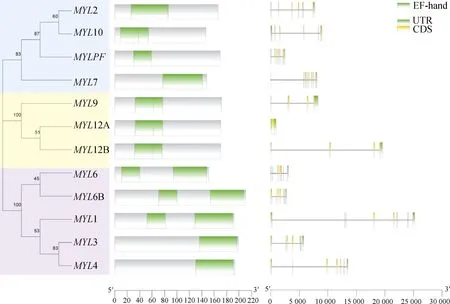
图2 绵羊 MYL 基因家族结构与进化Fig.2 Gene structure and evolution of MYL gene family in sheep
同一组基因的 Motif 种类、数量和位置较为一致,每个基因包含 3~6个 Motif(图3),Motif1 和 Motif2 是家族成员共有,RLC 型均有 Motif3,Motif4 和 Motif5 只在 ELC 型中出现。利用 Pfam 在线数据库进行注释,发现 Motif1 包含 EF-hand 结构域,这是MYL基因家族成员共有的保守结构域[5]。

图3 绵羊 MYL 基因家族保守基序Fig.3 Conserved motifs of MYL gene family in sheep
2.3 绵羊 MYL 基因家族系统进化分析
利用 MEGA7.0 比对分析了人(13个)、鼠(13个)、牛(13个)、猪(12个)、山羊(12个)和绵羊(12个)6种哺乳动物的 MYL 蛋白质序列,构建系统进化树(图4)。结果显示,与蛋白和基因结构构建的系统发育树结果一致。绵羊 RLC 型的 MYLs 进化关系与山羊较近,ELC 型与山羊和牛亲缘关系较近。
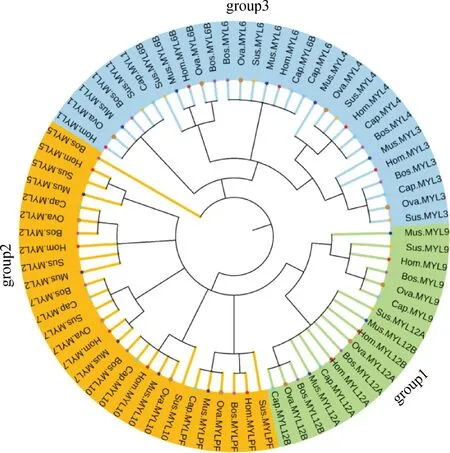
图4 人、鼠、猪、牛、山羊和绵羊 MYL 基因家族发育树Fig.4 The phylogenetic tree of MYL gene family in Homo sapiens(Hom.), Mus muscμlus(Mus.), Sus scrofa(Sus.), Bovidae(Bos.), Capra hircus(Cap.) and Ovis aries(Ova.)
2.4 绵羊 MYL 基因重复事件和共线性分析
根据绵羊基因组注释文件,对MYLs进行物种内和物种间共线性分析。12个MYLs中有 2 对基因,MYL2 和MYL10、MYL2 和MYLPF,存在片段复制现象(图5),选择压力 Ka/Ks 值分别是 0.08 和 0.11,表明在进化过程中受到的纯化选择较强。物种间共线性分析结果显示,绵羊(12个MYLs)、山羊(12个MYLs)和牛(13个MYLs)MYL基因家族高度保守。绵羊与山羊、绵羊与牛基因组之间分别存在 12 对(图6a)和 14 对(图6b)共线性关系。同时也发现一个基因同时和多个基因呈现共线性关系,其中绵羊MYL2 基因与牛MYL2、MYL10 和MYLPF同源。
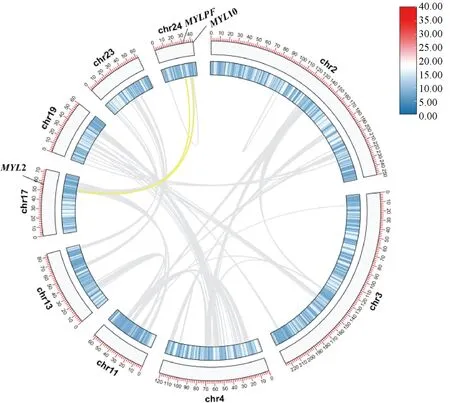
灰色线表示绵羊基因组中的所有共线性区块,而黄色线表示发生复制的 MYL 基因对The gray line represents all the collinearity blocks in the sheep genome, while the yellow line represents the MYL gene pairs in which replication occurs图5 绵羊 MYL 基因家族成员共线性分析Fig.5 Collinear distribution of MYL family members
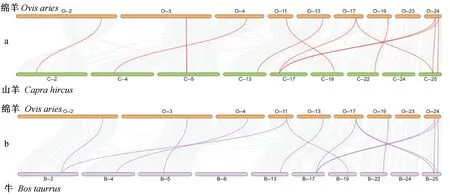
绵羊与山羊(a)和牛(b)MYL 基因的共线性分析,背景中的灰色线表示绵羊与山羊、牛基因组中的共线性区块,而红色和紫色的连接线则突出显示了 MYL 相关的共线性基因对Synteny analysis of MYL genes between sheep and goat(a), sheep and cattle(b). The gray lines in the background indicate the collinear blocks within sheep and other animal genomes, while the red and purple lines highlight the syntenic MYL gene pairs图6 绵羊与山羊和牛 MYL 的同源性分析Fig.6 Synteny analysis of MYL family members between sheep and goat, cattle
2.5 MYL 基因家族蛋白结构和蛋白互作网络分析
绵羊 MYLs 氨基酸序列的二级结构由 α-螺旋、无规则卷曲、β-转角和延伸链组成(表3)。家族成员与肌球蛋白重链10(myosin heavy chain 10,MYH10)、骨骼肌肌动蛋白 A1(actin alpha 1,ACTA1)和肌动蛋白 γ1(actin gamma 1,ACTG1)等 33 个蛋白质互作,其中 MYH10 与各成员都有互作关系(图7)。
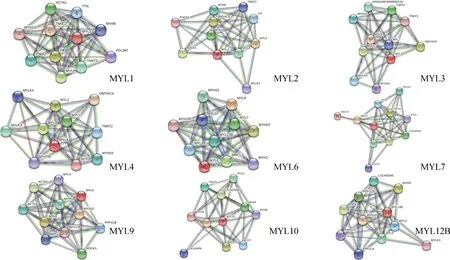
图7 绵羊 MYLs 蛋白互作网络Fig.7 Proteins interaction network of MYLs in sheep

表3 绵羊 MYL蛋白的二级结构Table 3 Secondary structure of MYL protein in sheep
2.6 绵羊 MYL 基因家族组织表达分析
基于本实验室搭建的多物种全组织转录组数据库中基因表达量数据(TPM),建立湖羊MYLs的组织表达模式(图8)。结果显示MYL1、MYL2 和MYLPF在长斜方肌、胸肌、腹外直肌、三角肌、腹外斜肌和背阔肌等骨骼肌中的表达水平显着高于其他组织。MYL3 在骨骼肌组织中表达水平相对较高。MYL4 和MYL7 特异在心脏组织中极显着地高表达。MYL6、MYL6B、MYL9 和MYL12B 在各组织中都有表达,其中MYL6、MYL9 和MYL12B 在非骨骼肌组织中的表达水平要高于各骨骼肌组织。MYL10 和MYL12A 在各组织的表达水平较低,或不表达。
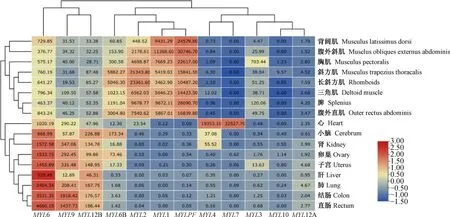
数字代表表达量的值;颜色刻度条代表基因表达量The number represents the value of expression. The color scale bar represents the amount of expression图8 绵羊 MYLs 基因组织表达模式Fig.8 Tissues expression pattern of MYLs gene family in sheep
2.7 MYL1、MYL6B 和 MYLPF 基因 CDS 克隆
PCR 扩增结果显示(图9),扩增产物条带明亮且清晰,大小在 400~600 bp之间,与MYL1、MYL6B 和MYLPF基因 CDS 的全长(579、635和 450 bp)相比大小一致。测序结果表明,扩增片段为目的基因序列。

M.DNA相对分子质量标准;1~3.MYL1、MYL6B 和 MYLPF 基因;4.空白对照M.DNA Marker; 1-3. MYL1, MYL6B and MYLPF genes of sheep; 4. Blank control图9 MYL1、MYL6B 和 MYLPF 基因全长 cDNA 扩增结果Fig.9 Full length cDNA amplification of MYL1, MYL6B and MYLPF
2.8 MYL1、MYL6B 和 MYLPF基因表达分析
以军垦白肉羊为对象,运用 qRT-PCR 技术分析MYL1、MYL6B 和MYLPF基因在心、肝、肺和肾等10个组织的表达情况(图10)。结果显示,MYL1、MYL6B 和MYLPF基因在军垦白肉羊背最长肌和骨骼肌中表达量极显着高于其他组织(P<0.000 1)。MYL1 和MYLPF均在瘤胃、脾和肺低水平表达。MYL6B 基因在瘤胃和脾脏中的表达量高于在小肠、大肠、肝脏、肺部和肾脏中的表达水平。

以心脏组织的表达水平作为对照,****代表差异极显着(P<0.000 1)The heart tissues was used as a control, **** represents an extremely significant difference (P<0.000 1)图10 MYL1、MYL6B 和 MYLPF 在绵羊 10 个组织的表达Fig.10 Expression of MYL1, MYL6B and MYLPF in 10 tissues of sheep
比较了军垦白肉羊、湖羊和细毛羊的心脏、肝脏和骨骼肌3种组织中MYL1、MYL6B 和MYLPF基因的表达差异(图11)。结果显示,MYL1、MYL6B 和MYLPF均表现出骨骼肌中高水平的特异表达。在这3个品种之间,MYL1、MYL6B 和MYLPF的骨骼肌表达差异非常显着(P<0.000 1),且在军垦白肉羊中的表达显着高于湖羊和细毛羊。在不同品种的绵羊肝脏组织中,MYL1 的表达在细毛羊中极其显着高于湖羊和军垦白肉羊(P<0.000 1),而MYL6B 在湖羊中的表达水平则极显着高于细毛羊和军垦白肉羊(P<0.000 1)。

以心脏表达水平作为对照。图柱上标字母表示不同品种绵羊同一组织中基因表达量差异极显着(P<0.000 1)。相同的大写字母表示基因在骨骼肌组织中表达量差异极显着,相同的小写字母表示基因在肝脏组织中表达量差异极显着Heart expression levels were used as a control. The letters on the bars in the figure indicate extremely significant expression differences of the same gene in the same tissue of different sheep breeds (P<0.000 1). The same capital letter indicates extremely significant expression differences of the gene in the skeletal muscle tissue, while the same lowercase letter indicates extremely significant expression differences of the gene in the liver tissue图11 MYL1、MYL6B 和 MYLPF 基因在不同绵羊品种和不同组织中的表达量Fig.11 Expression of MYL1, MYL6B and MYLPF in different breeds and tissues of sheep
3 讨 论
MYLs在人[7]、鸡[21]和猪[22]肌肉生长发育中发挥重要的调节作用。有研究表明,该基因家族成员与羊肉用性能密切相关[13,23],但对绵羊中MYL家族成员缺乏全面系统的认识。本研究在绵羊基因组中共鉴定出12个MYL基因,它们共有 Motif1和 Motif2,其中 Motif1 包含 EF-hand 保守结构域,该结构域是钙传感器,Ca2+是骨骼肌兴奋收缩耦联的桥梁,当 EF-hand 与 Ca2+结合时发生构象改变,完成与下游靶点的相互作用[24]。含有 EF-hand 结构域的蛋白功能多样[25],如细胞质中的钙缓冲,细胞区室之间的信号转导和肌肉收缩等。
MYH10 是调控肌纤维组成和肌内脂肪含量的候选基因[26-27]。岳彩娟等[28]分析了湖羊与滩羊的差异甲基化基因,发现MYH10 富集在与肌肉相关的功能调控通路中,与肌肉发育分化,肌纤维组成等密切相关。本研究发现 MYH10 是绵羊MYL基因家族共有的互作蛋白。由此推测,MYH10 与绵羊 MYLs 之间的蛋白互作,可能是调节绵羊骨骼肌收缩和发育的重要因素,但是具体调控方式有待进一步研究。
位于同一系统发育进化分枝上的蛋白可能具有相似的结构和功能[29]。本研究中, MYL1、MYL3、MYL4、MYL6 和 MYL6B 位于同一组,属于 ELC 型。ELC 型肌球蛋白主要参与调节肌肉的受力和力学性能,它的变化可以影响肌肉纤维的收缩速度和力量[3]。研究发现,MYL1、MYL3 和MYL6B 与内蒙古绒山羊的肉质特性形成相关,免疫组化分析结果显示,MYL3 的表达比例可能作为肌肉韧性的潜在分子标记[13]。MYL1 和MYL3 在骨骼肌中的表达水平较高,此外发现MYL1 基因具有 2个 TATA box,推测MYL1 是绵羊骨骼肌组织特异性表达的基因[30]。MYL3 主要在牛肌原纤维的粗肌丝中表达,编码蛋白的表达水平随生长月龄的变化呈现递增趋势[23],主要与调控肌肉生长发育的相关蛋白相互作用[31]。MYL4 与肌动蛋白单体结合相关,是控制大鼠心房收缩、电性和结构完整性的关键基因[32],其功能障碍会导致严重的遗传性心房心肌病[33]。本研究发现,MYL4 在绵羊心脏组织中特异性高表达,推测该基因在绵羊心脏功能维持中具有重要作用。
RLC 型肌球蛋白主要参与肌肉纤维的结构稳定和肌肉功能的调节,它的变化可以影响肌肉的适应性和功能[4]。RLC 型家族成员有MYL2、MYL7、MYL10、MYLPF、MYL9、MYL12A 和MYL12B。其中,MYL9 和 MYL12B 蛋白质互作网络相似。研究发现,猪肌生成抑制素基因(myostatin,MSTN)敲除后,MYL9 mRNA 和蛋白的表达水平显着上调,表明MYL9 在猪骨骼肌的生长和发育中起着重要作用,并推测MYL9 可能通过控制 ATP 酶活性来调节肌肉能量代谢,或者与肌凝蛋白相互作用间接参与骨骼肌生长发育的调控[10]。Deeg 等[34]证明了MYL12A 是维持鸡外周血单个核细胞和溶菌酶细胞完整性所必需的基因。MYL12B 是细胞骨架的重要组分[35],作为肌球蛋白的调节性轻链,可通过调节轻链的磷酸化与去磷酸化来参与调节细胞信号传导。MYL9 和MYL12B 在湖羊各个组织中广泛表达,表现出相近的调控网络和作用机制。
MYL2 和MYLPF在湖羊胸肌等骨骼肌中高表达,MYL10 在各组织中低表达。MYL2 是肌纤维再生的敏感标记物[36],与MYL10 编码的蛋白共同调控形成紧密连接、黏着斑和肌动蛋白细胞骨架[37]。MYL7 表达水平的变化与唐氏综合征患者的先天性心脏病密切相关[5],本研究发现MYL7 在湖羊心脏中呈现特异性高表达。MYLPF在山羊背最长肌、腓肠肌和腹肌中表达水平高,而在肝、脾、肺和肾中表达水平低,且骨骼肌中MYLPF的表达量随着年龄增长而逐渐减少,说明MYLPF在骨骼肌的生长和分化发育中具有重要作用[3]。绵羊种内共线性分析揭示了 2 对(MYL2-MYL10、MYL2-MYLPF)基因片段复制现象。生物进化过程中,片段复制和串联重复有助于加速基因家族的扩张,为获取新的基因功能提供机会[38]。基因在复制过程中发生遗传变异,引起功能分歧,随后纯化选择,这些功能被保留下来[39]。
基因的表达在一定程度上揭示了基因的潜在功能[40],为进一步挖掘与绵羊肌肉发育相关的基因,本研究根据湖羊MYLs的多组织表达模式分析结果,挑选出在肌肉中高水平表达的家族成员。利用 qRT-PCR 技术,检测了处于育种过程中的军垦白肉羊各组织的基因表达变化,并与湖羊各组织的检测对比结果相似,其中MYL1、MYL6B 和MYLPF在军垦白肉羊肌肉中的表达水平也显着高于其他组织(P<0.000 1)。军垦白肉羊是新疆农垦科学院选育的、适应工厂化养殖的良种肉羊群体,其产肉性能和肉品质优良。本研究比较了MYL1、MYL6B 和MYLPF基因在军垦白肉羊、湖羊和细毛羊这3个不同品种绵羊的表达差异,发现以上基因在军垦白肉羊骨骼肌中的表达显着高于湖羊和细毛羊(P<0.000 1)。同时,还比较了3个品种绵羊肝脏中MYL1、MYL6B 和MYLPF的表达情况,发现MYL1 在军垦白肉羊和湖羊的表达水平显着低于细毛羊(P<0.000 1),而MYL6B 在军垦白肉羊和细毛羊的表达水平显着低于湖羊(P<0.000 1)。肝脏是脂肪分解代谢的重要器官。推测MYL1 和MYL6B 在军垦白肉羊肝脏中的低水平表达,可能影响脂肪沉积,有利于肌内脂肪的形成。这些发现对于深入了解绵羊肉质形成的分子机制具有重要意义,并为今后通过遗传改良提高绵羊的肉质提供了新的候选基因。
4 结 论
本研究利用生物信息学技术在绵羊基因组中鉴定出了 12个MYLs基因,并对该家族成员进行理化性质、遗传进化和表达模式分析,发现MYL家族基因在绵羊不同组织表达具有特异性,其中MYL1、MYL6B 和MYLPF在肌肉中表达水平显着高于其他组织,研究结果为进一步探讨MYL基因家族与绵羊肌肉生长发育的关系提供了科学基础。



