张阳春,杨桂莲,伍永旭,李 旭,雷俊芳,刘兆辉
(遵义医科大学附属医院 耳鼻喉科,贵州 遵义 563000)
头颈部肿瘤是全球第七大常见肿瘤,占所有肿瘤的3%,每年约有90万新病例和50万人死亡[1]。头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是头颈部肿瘤中最常见的病理类型,在所有头颈肿瘤中约占90%[2]。目前头颈部鳞状细胞癌预后差,且仍有部分头颈鳞癌在治疗后出现转移和复发[3]。因此,寻找对头颈部鳞状细胞癌早期诊断具有特异性的生物标志物,是目前头颈鳞癌研究中的重要任务。同源盒(homeobox,HOX)基因在器官和肿瘤发生中具有重要作用,HOX基因的异常表达扰乱了正常细胞内的信号稳态,从而引发细胞功能障碍和肿瘤免疫监控下降,进而发生细胞异常生长、细胞周期改变和细胞增殖信号通路激活等,为肿瘤生长创造了有利的微环境[4-5]。越来越多的证据显示,同源盒C6基因(homeobox C6,HOXC6)在癌症中高表达并可调控癌细胞的恶性进展,例如HOXC6可促进在胃癌、前列腺癌、宫颈癌的增殖,并在宫颈癌中发挥抑制凋亡的作用[6-8],但尚不知HOXC6基因在头颈鳞癌中的具体表达和临床意义。因此,本研究分析HOXC6在头颈鳞癌中的表达,探讨了它与患者临床预后的关系,并通过细胞实验检测其对头颈鳞癌细胞增殖与凋亡的影响,为头颈部鳞状细胞癌的诊断和治疗提供新的思路与方向。
1 材料与方法
1.1 组织标本收集 2021年10月至2022年11月就诊于遵义医科大学附属医院耳鼻喉科的头颈鳞癌患者30例,癌组织与癌旁组织配对收集。所有患者在手术切除肿瘤前均未接受化疗或放疗,且均签署知情同意书,获得遵义医科大学医学伦理委员会的批准(NO:KLLY-2021-164)后进行。所有标本离体后30 min内浸入RNA later溶液中,置于-80 ℃冰箱保存,用于后续RT-qPCR(reverse transcription quantitative real-time polymerase chain reaction,RT-qPCR)实验。
1.2 细胞来源、主要试剂及仪器 头颈鳞癌细胞株FaDu购自美国ATCC细胞库;头颈鳞癌细胞株TU-212购自上海酶研生物科技有限公司;胎牛血清、DMEM高糖培养基、1640培养基、Opti-MEM培养基、PBS溶液以及0.25%胰蛋白酶购自美国Gibco公司;LipofectamineTM 3 000转染试剂盒购自美国Thermo Scientific公司;shRNA-HOXC6质粒(5′-TTGCCCAGAACCGGATCTACT-3′)、NC阴性质粒(5′-CAGGAAGAGGGCCTATTTCCC-3′)购自上海合生生物;RNA提取试剂盒、逆转录试剂盒及实时荧光定量PCR试剂盒均购自日本Takara公司;RT-qPCRHOXC6及GAPDH引物购自北京擎科公司;CCK-8细胞增殖试剂盒购自北京索莱宝公司;Transwell小室(24孔,孔径8 μm)购自美国CORNING公司;一抗HOXC6购自英国Abcam公司;一抗GAPDH购自杭州华安公司;一抗Caspase3、Caspase9购自武汉博士德公司;二抗辣根过氧化物酶标记山羊抗兔IgG购自杭州华安公司;细胞培养箱、酶标仪(型号:BB150-2TCS、MKK3)均购自美国Thermo Scientific公司;荧光定量PCR仪、凝胶成像仪(型号:CFX96、Gel Doc EZ)均购自美国BIO-RAD;倒置荧光显微镜(型号:IX71)购自日本olympus公司。
1.3HOXC6在头颈鳞癌和癌旁组织的表达差异 头颈部鳞状细胞癌的RNA-seq转录组数据和临床信息由癌症基因组图谱(TCGA)(https://portal.gdc.cancer.gov/)下载,不包括临床信息不完整的患者[9]。本研究有504例头颈部鳞状细胞癌病例及44例癌旁邻近组织RNA-seq转录组数据。使用R 3.6.3版本(https://www.r-project.org/)及R包“ggplot2”包(http://bioconductor.org/)分析比较头颈部鳞状细胞癌和正常组织之间HOXC6的差异表达,可视化表达水平。
1.4HOXC6临床预后分析和临床特征相关性分析 头颈部鳞状细胞癌的RNA-seq转录组数据和临床信息由癌症基因组图谱(TCGA)(https://portal.gdc.cancer.gov/)下载,不包括临床信息不完整的患者。用总体生存期(overall survival,OS)作为预后指标,通过Kaplan-Meier方法分析HOXC6与头颈鳞癌患者预后的相关性,分析HOXC6的表达与临床特征的相关性[10-11]。
1.5 细胞培养、转染及验证转染效率 头颈鳞癌细胞株FaDu、TU-212分别采用DMEM培养基(含10 %胎牛血清)和RPMI-1640培养基(含10 %胎牛血清),在37 ℃、5 % CO2恒温孵箱中培养。待细胞汇合度达90 %时,胰酶消化并计数细胞,以2.0×105个/孔的数量接种于六孔板中,待培养至汇合度70 %时,开始转染操作。转染分组:不做任何处理的空白对照组(NC)、阴性质粒对照(shNC)及HOXC6敲减组(shHOXC6);转染试剂配置:A液:125 μL无血清培养基(opti-MEM)+3.75 μL lipofactmineTM3000转染试剂,B液:125 μL无血清培养基(opti-MEM)+5 μg shRNA质粒+10 μL P3000转染试剂,将制备好的A液室温静置5 min,然后与B液混合,得到C液,C液室温静置15 min。从细胞培养箱中取出培养板,每孔加入250 μL上述C液,将C液与培养瓶内的完全培养基轻轻混匀。将培养板放回细胞培养箱中继续培养48 h后进行荧光拍照,初步观察转染效果,随后采用RT-qPCR及蛋白免疫印迹(Western blot,WB)进一步验证HOXC6敲减效果,敲减效率合格的细胞进行下一步细胞表型实验。
1.6 RT-qPCR实验 通过实时RT-qPCR检测细胞及组织标本中HOXC6表达量。组织或细胞破碎匀浆后,使用RNA提取试剂盒提取总RNA,反转录得到cDNA,反应程序为:37 ℃ 15 min;85 ℃ 5 s,4 ℃ ∞;对cDNA样品进行荧光定量检测,反应程序为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃ 5 s,50 ℃ 30 s。采用2-ΔΔCt法计算HOXC6的相对表达量。
引物序列:HOXC6-F为5′-GCGGAAAAGAGGAAAAGCGG-3′,HOXC6-R为5′-AAGAGAGAGTTGTGCGGGTAGG-3′,GAPDH-F为5′-GGAGTCCACTGGCGTCTTCA-3′,GAPDH-R为5′-GTCATGAGTCCTTCCACGATACC-3′。
1.7 蛋白免疫印迹实验 HOXC6蛋白在FaDu、TU-212细胞里的表达用WB进行检测。取转染48 h后的头颈鳞癌细胞,加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液裂解细胞,12 000 r/min 4℃离心15 min,取上清液,BCA试剂盒进行总蛋白定量。各组取10 μL蛋白溶液点加于SDS-PAGE凝胶孔中,以恒压70 V进行电泳,待蛋白跑至下层胶后调整至110 V电压继续电泳,直至Marker条带均匀分离。将电泳后的SDS-PAGE凝胶采用85 V电转60 min,使蛋白转移至PVDF膜上,根据蛋白分子大小进行裁剪,室温下用10 %的脱脂牛奶封闭1~2 h,一抗HOXC6(1∶2 000)、GAPDH(1∶2 000)、Caspase3(1∶1 000)、Caspase9(1∶1 000),4 ℃孵育过夜,二抗辣根过氧化物酶标记山羊抗兔IgG(1∶2 000)室温孵育2 h后,用ECL化学发光试剂对PVDF膜上的蛋白印迹进行曝光。曝光后用Image J软件进行目的基因相对灰度值计算。
1.8 CCK-8增殖曲线 取对数生长期FaDu、TU-212细胞,胰酶消化后细胞计数,以2.0×103个/孔的数量接种于96孔板中,用于CCK-8试验,每孔加入100 μL含有细胞悬液的完全培养基,分别于接种后第0、1、2、3天测细胞每孔OD值。向每孔加入10 μL CCK8试剂,37 ℃孵育2 h后,使用酶标仪测450 nm波长下吸光度值,绘制细胞生长曲线。
1.9 克隆形成实验 取对数生长期FaDu、TU-212细胞,将NC组、shNC组、shHOXC6组细胞胰酶消化后细胞计数,吹打使细胞分散,以500个/孔的数量种于6孔板中,每孔加入2 mL含细胞悬液的完全培养基,放入孵箱培养14 d,期间每3天进行1次换液。14 d后取出6孔板,弃去培养基,PBS洗涤1次,每孔加入4%多聚甲醛溶液1 mL固定细胞15 min,弃去固定液,PBS洗涤1次,0.1%结晶紫染液0.5 mL染色细胞10 min,PBS洗去多余染液,将培养板置于光源上,数码相机拍照。
1.10 流式检测细胞凋亡 Annexin V-APC/7AAD双染色法:将NC组、shNC组、shHOXC6组细胞用胰酶(不含EDTA)消化后,收集至EP管中,1 000 r/min离心5 min,弃上清,PBS洗涤细胞1次,计数细胞后取2.5×105个细胞重悬,PBS洗涤1次,弃上清后加入100 μL Annexin V Binding Buffer工作液重悬细胞,细胞悬液中加入2.5 μL的Annexin V-APC和2.5 μL的7-AAD染色液,轻柔涡旋混匀后,室温避光孵育15 min后上机检测。
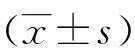
2 结果
2.1HOXC6在TCGA数据库及临床标本中的表达差异 在TCGA数据库中下载的504例头颈部鳞状细胞癌和44例癌旁组织转录组数据中,HOXC6在癌组织中明显高表达(P<0.001,图1A)。临床收集30例头颈鳞癌及配对癌旁组织中,HOXC6在癌组织中明显高表达于癌旁组织(P<0.001,图1B)。
A:TCGA数据库中504例头颈鳞癌组织与44例癌旁组织中HOXC6分子表达差异;B:临床30例头颈鳞癌标本及配对癌旁组织标本中HOXC6分子表达差异;***:P<0.001。图1 HOXC6在TCGA数据库及临床标本中的表达差异
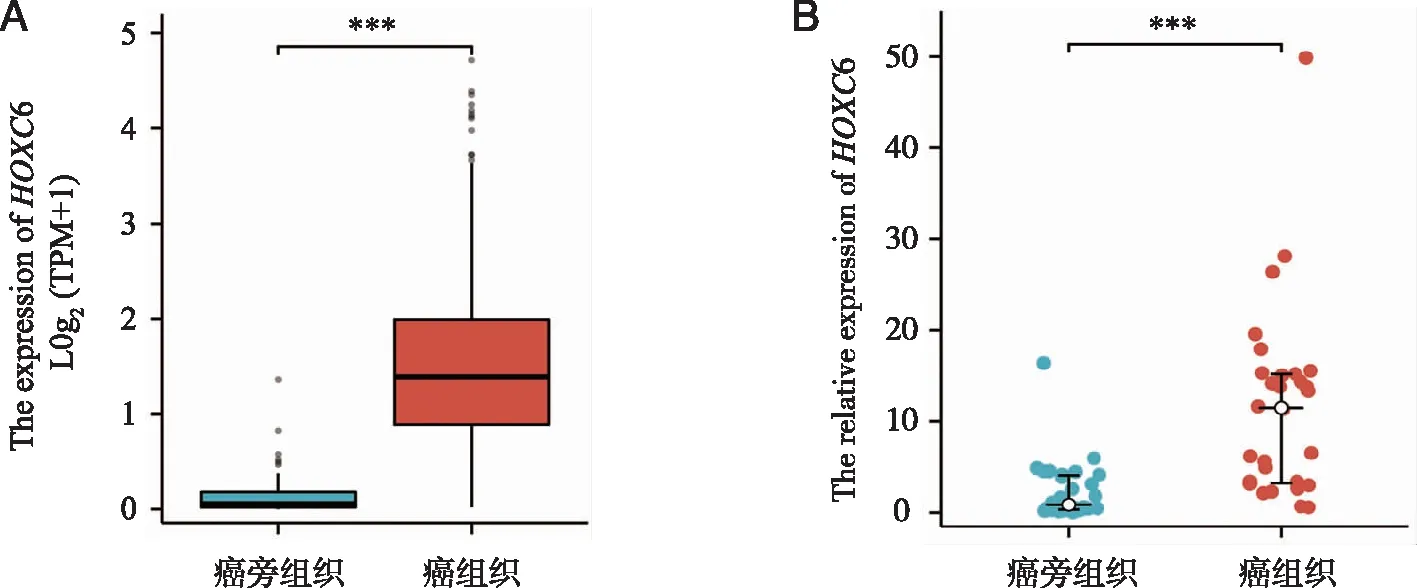
2.2 HOXC6临床预后分析和临床特征相关性分析 在TCGA数据库中下载头颈鳞癌患者临床信息,通过Kaplan Meier法分析了HOXC6表达与总生存期OS的关系,结果发现,HOXC6高表达组的OS明显下降,且风险因子提高了0.42倍(P=0.01)。通过TCGA头颈部鳞状细胞癌非配对样本预后分析得出,HOXC6高低表达组在肿瘤的组织分级上有差异(P<0.001)、在是否有淋巴结侵犯上有差异、在总体生存期上有差异(P<0.01,图2A~D)。
A:头颈鳞癌中HOXC6分子高、低表达组的生存曲线;B:HOXC6分子与头颈鳞癌患者总体生存期OS的关系;C:HOXC6分子与头颈鳞癌患者组织学分级的关系;D:HOXC6分子与头颈鳞癌患者淋巴结侵犯的关系;*、**、***:P<0.05、P<0.01、P<0.001。图2 TCGA头颈鳞癌数据集中HOXC6相关预后分析及临床特征相关性分析
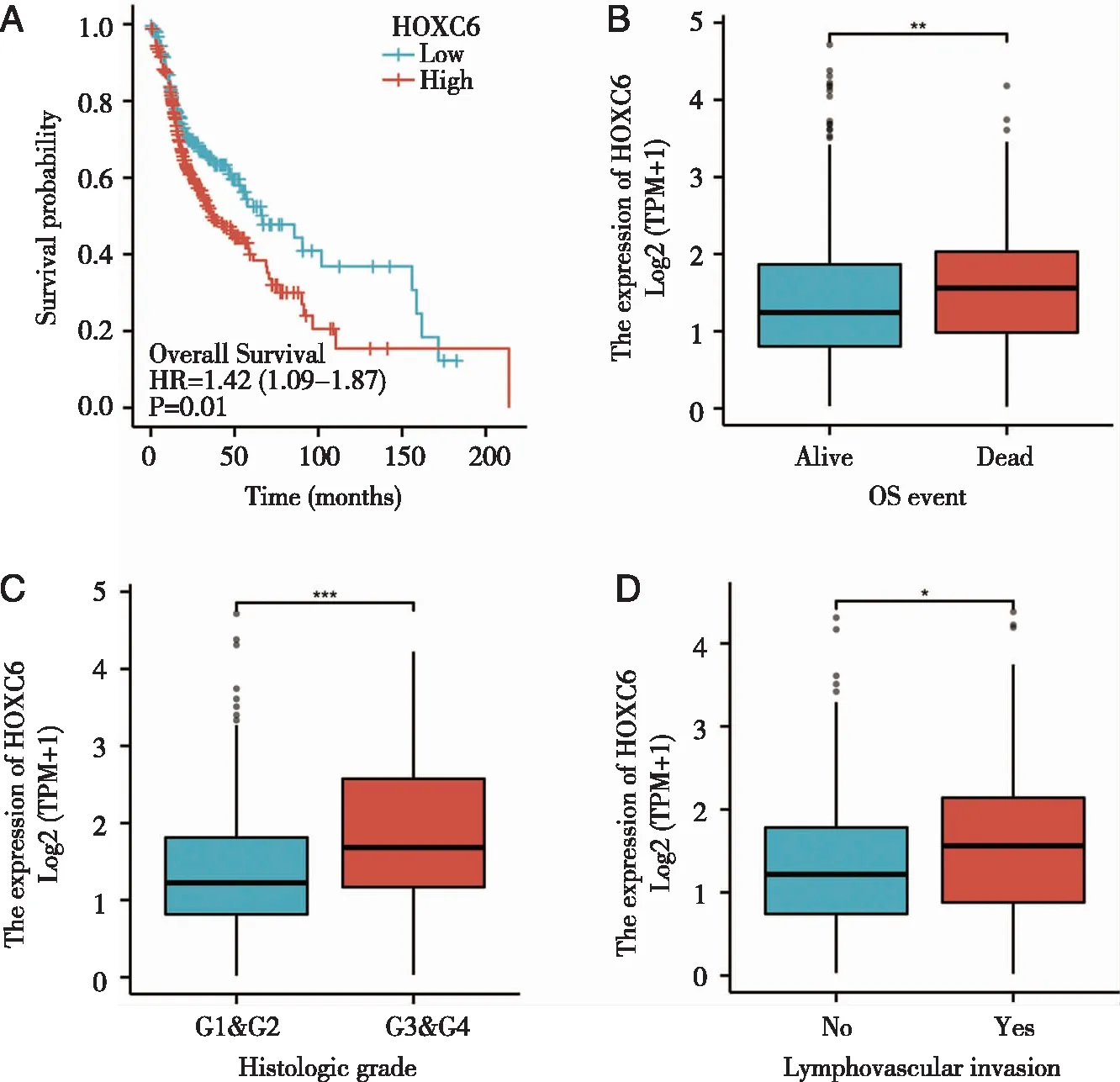
2.3 细胞转染效率检测结果 FaDu、TU-212细胞转染后荧光显微镜拍照,在蓝色激发光下,细胞呈现绿色荧光(见图3A)。RT-qPCR验证转染shHOXC6质粒的细胞相对于转染shNC质粒的细胞,HOXC6 mRNA表达量明显下降(P<0.01,图3B~C)。WB显示转染shHOXC6质粒的细胞相对于转染shNC质粒的细胞HOXC6蛋白的表达量明显下降(P<0.01,图3D~F)。
A:转染shNC质粒、shHOXC6质粒后FaDu、TU-212细胞荧光;B:RT-qPCR检测FaDu细胞转染后HOXC6 mRNA表达;C:RT-qPCR检测TU-212细胞转染后HOXC6 mRNA表达;D:WB检测FaDu、TU-212细胞转染后HOXC6蛋白表达;E:WB检测FaDu细胞转染后HOXC6蛋白表达情况;F:WB检测TU-212细胞转染后HOXC6蛋白表达情况;ns:差异无统计学意义;**、***:P<0.01、P<0.001。图3 RT-qPCR及Western blot检测细胞转染效率
2.4 细胞增殖能力测定结果 CCK-8测得FaDu、TU-212细胞增殖曲线,shHOXC6组细胞生长速度明显低于NC组和shNC组(P<0.05,图4A、B)。克隆形成实验测得FaDu、TU-212细胞shHOXC6组的细胞克隆数明显少于NC组和shNC组(P<0.05,图4C、D)。
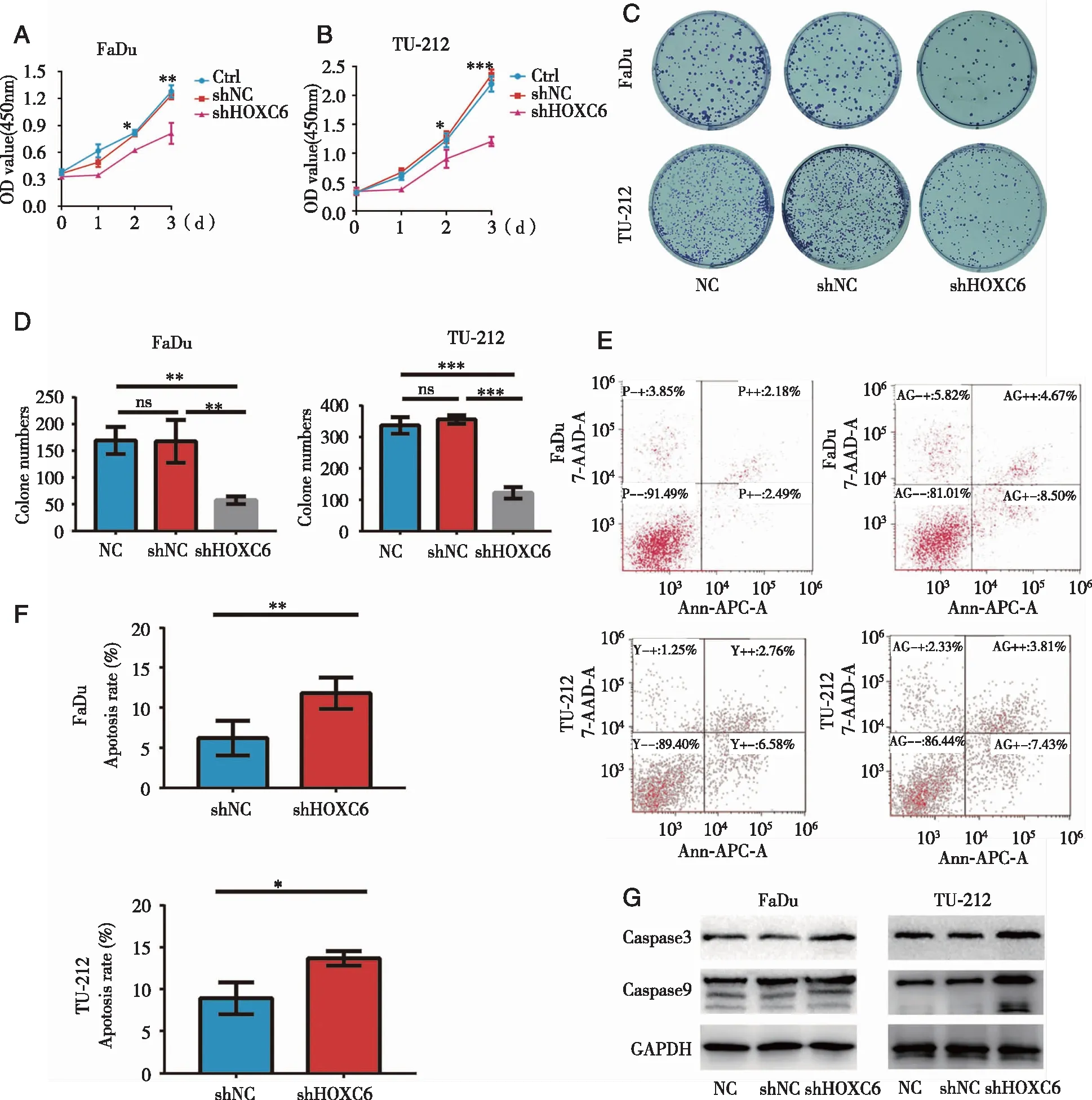
A:CCK8法测FaDu细胞转染后NC组、shNC组、shHOXC6组增殖曲线;B:CCK8法测TU-212细胞转染后NC组、shNC组、shHOXC6组增殖曲线;C:FaDu、TU-212细胞NC组、shNC组、shHOXC6组克隆形成情况;D:FaDu、TU-212细胞NC组、shNC组、shHOXC6组克隆形成情况;E:流式细胞术检测FaDu、TU-212细胞转染后shNC组、shHOXC6组凋亡情况;F:流式细胞术检测FaDu、TU-212细胞转染后shNC组、shHOXC6组凋亡情况;ns:无统计学差异;G:FaDu、TU-212细胞转染后NC组、shNC组、shHOXC6组凋亡蛋白表达;ns:无统计学差异;*、**、***:P<0.05、P<0.01、P<0.001。图4 敲减HOXC6分子后头颈鳞癌细胞增殖及凋亡变化情况
2.5 细胞凋亡实验结果 流式检测结果提示,FaDu、TU-212细胞shHOXC6组相对于shNC组,早期凋亡和晚期凋亡的细胞比例均增多(图4E、F,P<0.05和P<0.01),提示抑制HOXC6表达后细胞凋亡增加。WB结果提示FaDu、TU-212细胞shHOXC6组相对于阴性组和空白对照组,Caspase3表达增多,Caspase9剪接体表达增多,提示shHOXC6组细胞凋亡蛋白的表达较多(见图4G)。上述结果提示HOXC6的高表达可能抑制头颈鳞癌细胞的凋亡。
3 讨论
头颈部鳞状细胞癌是威胁中老年男性健康的重要疾病,主要危险因素是吸烟和酗酒以及人类乳头瘤病毒感染[12]。目前头颈部鳞状细胞癌的主要治疗是手术辅以放化疗的综合治疗,但仍有部分头颈部鳞状细胞癌在治疗后出现转移和复发[3]。因此,寻找合适的诊断及治疗分子标志物仍是重要任务。HOX基因与癌症的发生和发展密切相关,HOX基因是一类编码高度保守的含有同源结构域的转录因子家族,具有调控细胞形态发生、器官发生和分化等功能,是机体重要的调控基因家族[5]。既往研究证明,HOXC6可广泛调控癌细胞的恶性进展,例如在胶质母细胞瘤、胃癌、前列腺癌、宫颈癌、结直肠癌等的生长、转移等方面发挥着重要的影响[6,8,13-16],为探究HOXC6在头颈鳞癌中的具体作用,本研究从TCGA数据库头颈鳞癌数据集入手,分析了HOXC6基因的差异表达,并通过临床标本验证其表达,最后通过细胞实验探究HOXC6分子对头颈鳞癌细胞的增殖和凋亡的影响。
HOXC6基因位于染色体12Q13.3,该基因高度保守,参与胚胎发育、细胞形态发生和分化调控的许多过程,包括细胞凋亡、受体信号转移、分化、运动和血管生成[13]。Jung等[17]通过RT-qPCR和原位免疫杂交证明胃癌组织中HOXC6高表达,并发现晚期胃癌中HOXC6 mRNA的表达量显着高于早期胃癌,且通过Kaplan-Meier分析显示,HOXC6 mRNA的高表达与不良的临床预后显着相关。Luo和Zhou等[7,18]通过对前列腺癌组织的HOXC6的相对表达分析得出,HOXC6在前列腺癌组织中显着高表达且与PSA浓度成正相关并与前列腺癌的TNM分期明显相关,HOXC6高表达患者预后不良。在非小细胞肺癌和宫颈癌中,HOXC6在癌组织中也有显着高表达,并参与癌细胞的恶性进展[19-20]。而对于HOXC6分子在头颈鳞癌的作用尚未清晰认知,因此,本研究首先从生物信息学分析入手,通过TCGA下载的头颈部鳞状细胞癌转录组数据可得,头颈鳞癌中HOXC6分子表达明显较高(P<0.001),为此,通过组织标本PCR验证,头颈鳞癌组织中HOXC6分子的表达显着高于癌旁组织。进一步预后分析提示,HOXC6是头颈部鳞状细胞癌中相对危险度较高的风险因子,其高表达与肿瘤的组织学分级、是否淋巴结侵犯和总体生存率密切相关。这一结论与Jung、Luo等[17-18]相一致,证明了HOXC6在头颈鳞癌中高表达且提示预后不良的特性并可能成为头颈鳞癌的预后标志物。
既往研究显示,HOXC6在促进非小细胞癌、前列腺癌、口腔鳞状细胞癌干细胞的增殖方面具有重要作用,在宫颈癌和三阴性乳腺癌中还有加速细胞周期的作用[7,19-22]。为进一步验证HOXC6基因在头颈鳞癌中的作用,本研究通过质粒转染的方式,下调头颈鳞癌细胞株HOXC6的分子表达并检测头颈鳞癌细胞增殖的变化。CCK8实验和克隆形成实验均提示HOXC6分子在促进头颈鳞癌细胞的增殖与克隆形成方面具有重要意义。这一结论与HOXC6在其它癌症中的作用相似,而细胞增殖与细胞凋亡往往存在相依相伴又互相制约的作用,细胞增殖可能是由于细胞凋亡的减少才使表观上出现增殖能力增强的表现,但仍需检测细胞凋亡率,用来区别单纯的细胞增殖增强还是合并有细胞凋亡能力的减弱。为此,本实验通过流式细胞术检测了各组细胞的凋亡率,并通过WB检测了各组细胞凋亡蛋白Caspase3和Caspase9的表达量,结果证明抑制HOXC6可促进头颈鳞癌细胞的凋亡,促进凋亡蛋白的表达。而Xu与 Wang等[20,23]证明HOXC6分子不仅促进宫颈癌的增殖还有抑制其凋亡的作用,这与本实验得出的结论HOXC6的表达不仅对头颈鳞癌细胞有促进增殖的作用还有抑制凋亡使其无限生长的作用相符,更加证明HOXC6在头颈鳞癌中促增殖和抑制凋亡的结论可靠性。
寻找头颈鳞癌的诊断标志物和治疗靶点依然在头颈鳞癌的诊疗中不可或缺,本研究证明HOXC6在头颈鳞癌中高表达并提示不良预后,通过细胞实验发现HOXC6促进头颈鳞癌的增殖、抑制头颈鳞癌的凋亡,这证明HOXC6分子有望成为头颈鳞癌的诊断标志物,可能成为区分头颈鳞癌的疾病进展程度的关键分子。而在肿瘤治疗方面,既往研究表明,HOXC6可在上游分子的作用下表达受抑制进而改善非小细胞肺癌、结肠癌细胞和多药耐药癌细胞的化疗药物耐药性[24-26]。因此,HOXC6分子有望成为头颈鳞癌逆转化疗耐药的关键分子,这有待于后续进一步研究。同时本研究也稍有不足,如本实验未建立HOXC6基因过表达组,HOXC6基因对头颈鳞癌的影响的具体作用机制还需要进一步完善,HOXC6基因的体内实验尚未完成等,后期本课题组将继续深入研究,细化实验内容,为头颈鳞癌临床研究提供实践依据。总而言之,HOXC6在头颈鳞癌组织中高表达,并且提示头颈鳞癌的不良预后,下调后能够降低头颈鳞癌细胞株FaDu及TU-212细胞的增殖能力并加速了头颈鳞癌细胞的凋亡,这提示HOXC6可作为头颈鳞癌的诊断及预后分子标志物。



