胡晶晶 周伟 胡笑容
(1.钟祥市人民医院心内科,湖北 钟祥 431900;2.武汉大学中南医院,湖北 武汉 430071)
心肌梗死后再灌注治疗是治疗心梗最有效的方法,而再灌注损伤很大程度地限制了再灌注治疗的疗效。心梗后自主神经失衡,表现为交感神经过度激活,迷走神经活性相对减弱是加重心肌损伤和恶性心律失常的重要原因,而再灌注治疗不能降低交感神经活性。研究[1]证实,迷走神经刺激可以通过增加迷走活性,相对抑制交感神经活性减轻心肌缺血再灌注(ischemiaandreperfusion,IR)损伤。因此抑制交感活性可能是治疗心肌缺血再灌注损伤的可靠手段。肾交感消融(renalsympathetic denervation,RSD)是降低心脏交感活性的有效方法[2],与左侧星状神经节消融为目前临床研究最多的心交感神经消融方法,二者均可治疗高血压和特定类型的室性心律失常,如儿茶酚胺敏感型室速。RSD与心肌损伤研究鲜有报道,前期的研究[3]证实,RSD可以显着抑制心梗模型中心交感活性和心肌氧化应激水平。本研究主要探讨RSD对大鼠IR损伤的影响及可能机制。
1 材料与方法
1.1实验分组与动物模型建立 18只18~20周龄雄性SD大鼠,体质量180~200 g,购于湖北省疾控中心。根据随机数字表分为3组:假手术组,(SO组):大鼠开腹暴露双侧肾脏,45 min后开胸、前降支下穿线不结扎;缺血再灌注组(IR组):大鼠麻醉后开腹暴露双侧肾脏,45 min后开胸,结扎LAD 30 min,再灌注4 h;RSD+IR组:大鼠麻醉后开腹,暴露双侧肾脏,行RSD,RSD成功后等待30 min开胸,结扎LAD 30 min,再灌注4 h。
1.2RSD 暴露双侧肾脏后,剪断肾门和肾动脉所有可见神经纤维,为保证RSD效率,用棉签蘸取10%乙醇苯酚溶液湿敷肾门和肾动脉15 min。
1.3建立动物模型 大鼠采用2%苯巴比妥钠腹腔麻醉(45 mg/kg),将大鼠仰卧位固定于恒温板上,剔除颈部、胸部和内侧腹部毛发,在环状软骨下2节气管插管(70 bpm,吸呼比1∶1.5,潮气量1 mL)。沿腹部切口分离双侧肾脏,后沿左侧胸部切口暴露心脏,剪开心包膜,在左心耳下2 mm处将LAD与中空带凹槽的乳胶管结扎,结扎后远处心肌变白表明结扎成功,缺血30 min后,剪断结扎线,再灌注4 h。
1.4ELisa 检测血清肌钙蛋白I(cardiac troponin I,cTnI)和肌酸激酶同工酶(creatine kinase-MB,CK-MB)评价心肌损伤情况,检测心肌组织间NE(interstitial norepinephrine,iNE)浓度,评价交感神经活性。经大鼠颈静脉采血,离心(3 000 r×15 min)后取上清检测。采用Elabscience公司试剂盒,严格按照说明书操作。检测范围:CK-Mb:31.25~2000 pg/mL;cTnI:31.25~2000 pg/mL;iNE:0.31~20 ng/mL。
1.5生物化学检测法 检测缺血区心肌(梗死心肌周围5 mm内)超氧化物歧化酶(SOD)、丙二醛(MDA)和总抗氧化能力(T-Aoc),评价心肌组织氧化应激水平和抗氧化能力。选用南京建成生物工程研究所试剂盒,严格按照说明书操作。
1.6Western blot法 检测缺血区心肌Beclin-1、LC3- Ⅱ评价心肌细胞自噬水平。匀浆后测定总蛋白浓度,每孔上样量为40 μg,跑胶、转膜后,与一抗(Beclin-1:1∶500稀释,Abcam;LC3:1∶500稀释,北京博奥森生物技术有限公司)4℃孵育过夜,与相应的二抗孵育后,ECL法显色。
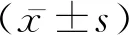
2 结 果
2.1心肌损伤 与SO组比较,IR组血清CK-Mb和cTnI表达均显着增加。与IR组比较,RSD可以显着降低血清CK-Mb和cTnI的表达。见表1。
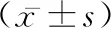
表1 血清CK-Mb、cTnI及心肌组织iNE的表达
2.2心肌组织NE浓度 与SO组比较,IR组心肌组织中NE浓度显着增加;与IR组比较,RSD组中NE浓度显着降低。见表1。
2.3心肌氧化应激水平 与SO组比较,IR组缺血区心肌组织氧化应激水平(MDA)显着增加,抗氧化能力(SOD,T-Aoc)显着减弱;与IR组比较,RSD可以减轻缺血区心肌组织氧化应激水平,增加抗氧化能力。见表2。
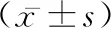
表2 心肌MDA表达以及SOD和T-Aoc活性
2.4心肌自噬水平 与SO组比较,IR组中Beclin-1表达水平(0.75±0.11 VS 0.18±0.024,P<0.05)和LC3-Ⅱ(0.32±0.048 VS 0.087±0.0068,P<0.05)显着增加;与IR组比较,RSD可以显着抑制Beclin-1的表达(0.47±0.051,P<0.05)和LC3- Ⅱ(0.21±0.032,P<0.05)的表达。见图1,表3。
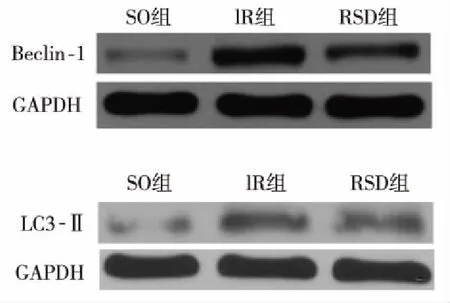
图1 Beclin-1和LC3-Ⅱ相对表达量

表3 心肌组织Beclin-1和LC3-Ⅱ相对表达
3 讨 论
RSD为心交感消融的有效方法,前期大量研究[4-5]表明,RSD可以通过抑制心交感过度激活降低患者血压以及缺血后房性、室性心律失常以及心衰的发生。RSD可以通过下丘脑室旁核,延髓头端腹外侧,双侧星状神经节支配心脏交感活性。我们前期研究证实,RSD可以显着抑制心梗后左侧星状神经节活性,即心交感活性,抑制室性心律失常的发生。本研究发现,RSD可以显着抑制心肌组织NE水平,进一步印证了RSD为心交感消融的有效方法,可以显着抑制IR中心交感过度激活。
交感过度激活是加重心肌IR损伤的重要因素,前期B.Buchholz等[6]研究证实,通过长时间低强度迷走神经刺激可以激活交感神经,进而加重心肌IR损伤,而这种作用可以完全被倍他乐克阻断。组织中过高浓度的NE也是加剧IR损伤的重要因素,血清中NE浓度的过高也提示了不良预后[7-8]。本研究发现RSD可以显着抑制心肌IR损伤,降低组织NE浓度,因此我们推测,RSD可以通过抑制交感活性和NE浓度减轻心肌IR损伤
心肌缺血时,氧供中断、ATP耗竭,为保证机体所需,交感激活,增加心肌收缩力和心率,进一步加剧耗氧,导致心肌抗氧化能力耗竭,再灌注时富氧血流再通,引起局部心肌氧化/抗氧化失衡,氧化应激水平激增。过高的氧化应激水平可以持续开放线粒体膜通透性转换孔,诱导线粒体肿胀破裂,呼吸链中活性氧大量释放,进一步加重氧化应激。有研究表明,离断交感神经可以减轻肝脏IR中氧化应激水平[9]。NE可以通过NADPH途径诱导外周血单核细胞产生活性氧[10]。RSD减轻脑中氧化应激水平[11],肾盂积水模型中,肾脏的氧化应激水平[12]。结合本研究结果我们推测,RSD可以通过抑制交感过度激活和组织中NE表达减轻大鼠心肌氧化应激水平,增加抗氧化能力。
自噬是心肌IR损伤的重要机制,目前普遍认为在缺血期自噬可以清除受损蛋白和细胞器,促进细胞存活,为保护机制,而再灌注时,由于自噬过度激活,可以促进细胞凋亡,为损伤机制。自噬可分为巨自噬、微自噬和分子伴侣介导的自噬,其中巨自噬为自噬的主要形式,损伤的细胞器或者大分子蛋白被双层质膜包裹形成自噬小体,与溶酶体结合降解。目前认为VPS34-VPS15-Beclin-1复合物是激活自噬小体形成的关键酶复合物,其参与了磷脂酰肌醇(PI)磷酸化形成PI3P,而PI3P为形成自噬小体的必需物质。LC3-Ⅱ泛素化复合物是自噬小体形成的另一个重要介质,LC3-Ⅱ分布在自噬小体上,与溶酶体结合后降解,因此LC3-Ⅱ反应了自噬的水平。本研究发现RSD可以显着抑制心肌组织Beclin-1的表达,降低LC3-Ⅱ的表达即抑制细胞巨自噬的水平。氧化应激可以通过多种途径调节自噬水平,研究表明,过量活性氧可以通过抑制PI3K-Akt-mTOR通路、激活AMPK通路、抑制Atg活性等引起细胞内Beclin-1和LC3-Ⅱ的聚集,激活自噬[13]。因此我们推测RSD可以通过抑制氧化应激减轻心肌自噬水平。
综上所述,RSD为心脏交感神经消融的有效方法; RSD可以通过抑制交感神经活性减轻大鼠心肌氧化应激和自噬水平,进而减轻大鼠心肌IR损伤; RSD减轻大鼠心肌自噬可能与抑制氧化应激有关。



