曾成英,郭遂群,魏清柱,肖小敏,蒋惠萍
(1.南方医科大学第三附属医院妇产科,广州510630;2.南方医科大学第三附属医院病理科,广州510630;3.暨南大学医学院附属第一医院妇产科,广州510632)
目前,国内大多数地区计划生育法规中规定的中孕引产方式为依沙吖啶引产和水囊引产,随着米非司酮配伍米索前列醇引产在国际上的应用,近年来国内亦有不少文献报道使用米非司酮配伍米索前列醇用于中孕引产的有效性及优越性。但引产后出血时间长、清宫率高仍是各种方式引产中备受关注的问题,胎盘粘连是发生上述问题的主要原因。有研究认为,血管生成素-Ⅰ(angiopoietin-Ⅰ,Ang-Ⅰ)、血管生成素-Ⅱ(angiopoietin-Ⅱ,Ang-Ⅱ)与胎盘植入的发生有关[1-2]。现将本研究3种不同引产方式引产后胎盘粘连与胎盘Ang-Ⅰ和Ang-Ⅱ表达的关系报道如下。
1 资料与方法
1.1 一般资料 选择2010年6月至2011年9月孕14~24周自愿到南方医科大学第三附属医院要求终止妊娠的孕妇86例,入院后按知情同意原则将孕妇分为3组:A组38例,米非司酮100 mg口服,6 h后重复一次,服药前后2 h禁食,用药第3天上午米索前列醇0.4 mg阴道给药,出现规律宫缩后每隔3h阴道后穹隆放置米索前列醇0.4 mg,不超过4次。B组30例,入院当天予100 mg依沙吖啶羊膜腔内注射(14~16周必要时在B超引导下)。C组18例,根据孕周羊膜腔外注入生理盐水,妊娠4个月注入400 mL,5~6个月注入500 mL。胎儿娩出后1 h胎盘未排出者,行钳刮术。所有孕妇入院时均行全面体检及必要的辅助检查,排除内科严重合并症、瘢痕子宫等。3组孕妇在年龄、孕产次、孕周等方面比较差异无统计学意义(P>0.05)。
1.2 胎盘标本的取材与免疫组织化学测定 胎盘排出后或钳刮出后取脐带附着部位胎盘母体面组织1 cm×1 cm×1 cm,避开出血、梗死区,生理盐水冲洗后,迅速用10%甲醛固定48 h,包埋在石蜡中用于进一步的免疫组织化学检测。试剂盒购自武汉博士德生物工程有限公司,具体操作方法严格按说明书进行。本研究随机选取5个高倍镜下视野观察与判定实验结果。光学显微镜下观察,阳性反应物可见棕黄色颗粒。免疫组织化学结果判定[3]采用H-score法[H-score=Σpi(i+1)],该判断方法综合考虑了切片中阳性细胞占所观察同类细胞数的百分比(Pi)和阳性细胞着色强度(i)两项标准。半定量判断结果,着色强度分为4级,无着色为阴性,记0分;浅黄色为弱阳性,记1分;棕黄色为中度阳性,记2分;棕褐色为强阳性,记3分。
1.3 统计学处理 应用SPSS16.0软件进行统计学数据分析,计量资料以±s表示,组间比较采用t检验、单因素方差分析F检验和χ2检验;以P<0.05为差异有统计学意义。
2 结 果
3组患者引产成功率及胎盘粘连率、胎盘粘连与非粘连孕妇胎盘及孕妇引产后3组胎盘中Ang-Ⅰ、Ang-Ⅱ表达,见表1~3和图1~2。
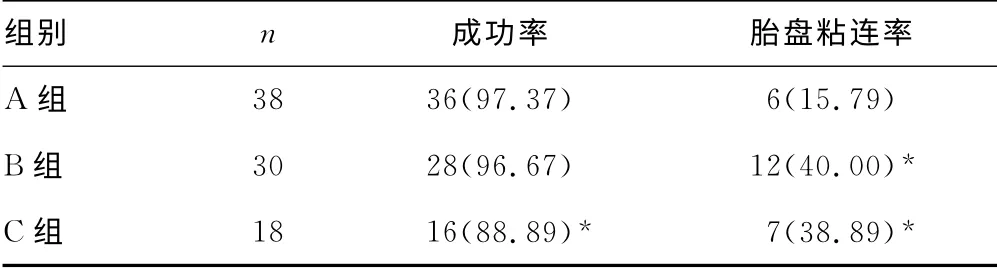
表1 3组中孕产妇引产成功率及胎盘粘连率比较[n(%)]
表2 3种方式中孕妇引产后各组胎盘中Ang-Ⅰ、Ang-Ⅱ表达(±s)

表2 3种方式中孕妇引产后各组胎盘中Ang-Ⅰ、Ang-Ⅱ表达(±s)
*:P<0.05,与A组比较。
组别nAng-Ⅰ Ang-ⅡA组38 9.12±0.67 9.02±0.57 B组 30 10.81±0.33*7.81±0.55*C组 18 10.71±0.47*7.92±0.56*
表3 3组引产后孕妇胎盘Ang-Ⅰ、Ang-Ⅱ表达比较(±s)

表3 3组引产后孕妇胎盘Ang-Ⅰ、Ang-Ⅱ表达比较(±s)
*:P<0.05,与同组胎盘粘连比较。
组别nAng-Ⅰ胎盘粘连 非胎盘粘连Ang-Ⅱ胎盘粘连 非胎盘粘连A组 38 10.03±0.77 8.91±0.56*7.32±0.47 9.31±0.52*B组 30 11.47±0.83 9.29±0.82*6.15±1.42 9.72±1.21*C组 18 11.22±0.93 9.03±0.73*6.47±1.12 9.62±1.29*
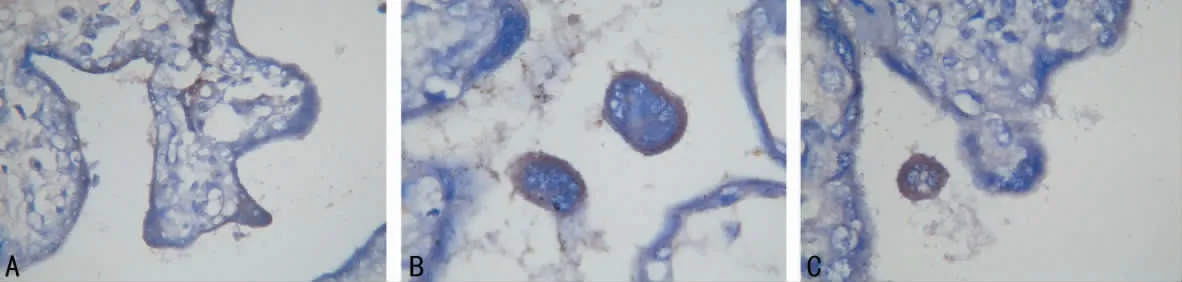
图1 3组孕妇胎盘中Ang-Ⅰ的表达(SP,×400)

图2 3组孕妇胎盘中Ang-2的表达(SP,×400)
3 讨 论
3.1 米非司酮配伍米索前列醇引产的应用 对于中期引产(妊娠13~24周),应用米非司酮配伍米索前列醇进行药物流产是一种可取的方法,并证实是安全和有效的[4]。国际药物流产联盟中期引产的推荐给药方案为:米非司酮200 mg顿服,36~48 h后阴道塞米索前列醇0.4 mg,然后重复口服0.4 mg米索前列醇,每3小时1次,最多4次[5]。国内李在容等[6]的研究显示米非司酮联合米索前列醇用于中期妊娠引产的完全流产率(80%)高于依沙吖啶引产,是一种安全、有效、方便的方法,效果优于依沙吖啶引产。本研究中,A组引产成功率高,胎盘粘连率低,从而降低了清宫率,减少产后出血量和出血时间,其临床优越性与上述研究结果一致。但引产后阴道流血时间长仍是临床医生困惑的问题。一些医院采取常规清宫术及术后常规使用抗菌药物来处理这一问题[7];这无疑增加了清宫术及使用抗菌药物可能带来的并发症及不良影响;所以,对减少胎盘粘连,减少不必要的手术操作的探究仍需继续深入地开展。
3.2 Ang-Ⅰ、Ang-Ⅱ表达的改变的意义 近年来的研究表明Ang-Ⅰ、Ang-Ⅱ两者主要是调节血管完整性的因子,Ang-Ⅰ通过受体促进血管的分化成熟,维持血管的稳定性,Ang-Ⅱ是Ang-Ⅰ及其共同受体的天然拮抗剂,在体内能竞争性抑制Ang-Ⅰ,起到破坏血管稳定性的作用[8-9]。两者在VEGF的影响下共同调节生理和病理的血管生成过程。如同时存在VEGF,则内皮细胞对其反应更敏感,形成新生血管[10]。
动物实验证明Ang-Ⅰ、Ang-Ⅱ存在于胎盘绒毛的血管内皮细胞中,调节胎盘绒毛血管的生成[11]。有研究表明,Ang-Ⅰ促进血管网形成、血管管腔增粗及血流量增加,并能维持这种结构的稳定[12],Ang-Ⅱ则启动血管降解的信号促进血管退化[13]。傅晓敏等[3]研究表明Ang-Ⅰ和Ang-Ⅱ的表达增加有可能促进残留绒毛的生长,其实验结果提示药流出血组血管生成素表达增加,说明其对绒毛残留起重要作用。
本研究中,与无胎盘粘连者比较,胎盘粘连者的胎盘Ang-Ⅰ表达水平高,而Ang-Ⅱ表达水平低,推测Ang-Ⅰ高表达可促进血管网的稳定,而Ang-Ⅱ的低表达使其血管退化困难,这可能导致了引产后胎盘不易剥离、胎盘粘连的发生。Nayak等[14]动物实验中,Ang-Ⅰ的表达呈孕激素依赖性并与螺旋动脉血管平滑肌细胞增殖相关;Ang-Ⅰ的增加可能通过使平滑肌细胞增殖而促进螺旋动脉成熟和稳定。米非司酮配伍米索前列醇组胎盘Ang-Ⅰ表达低于其他两组;胎盘Ang-Ⅱ的表达高于其他两组,提示米非司酮和米索前列醇可降低产后胎盘粘连率,可能与引产过程中其改变胎盘Ang-Ⅰ、Ang-Ⅱ的表达水平有关。本研究推测,由于米非司酮通过阻断孕激素受体,使富含孕激素受体的蜕膜组织变性、水肿、出血、坏死,促使蜕膜与绒毛膜分离,抑制胎盘血管网形成,减少胎盘血流量;使黄体酮水平下降的同时,呈黄体酮依赖性的Ang-Ⅰ也下降,与之拮抗的Ang-Ⅱ的升高,从而促进胎盘血管的退化,导致胎盘更加易于剥离,这可能导致了胎盘局部Ang-Ⅰ、Ang-Ⅱ表达的改变。这一推测,以及其之间的因果关系尚需进一步的实验研究方可证实。
所以,本研究推测,米非司酮配伍米索前列醇引产,以及已在临床上推广使用的米非司酮配伍利凡诺引产,其胎盘粘连率低、成功率高与米非司酮导致Ang-Ⅰ、Ang-Ⅱ的改变有关,设想如果再能通过生物学干预的手段,抑制或促进血管的生长,将进一步为临床上引产后胎盘的迅速、完整的剥离提供新的思路,从而能进一步减少宫腔操作及抗菌药物的应用。
[1]Tseng JJ,Chou MM.Differential expression of growth-,angiogenesis-and invasion-related factors in the development of placenta accrete[J].Taiwan J Obstet Gynecol,2006,45(2):100-1006.
[2]Tseng JJ,Hsu SL,Ho ES,et al.Differential expression of angiopoietin-Ⅰ,angiopoietin-Ⅱ,and The receptors in placentas from pregnancies complicated by placenta aeccete[J].Am J Obstet Gynecol,2006,194(2):564-571.
[3]傅晓敏,王雯,黄丽丽.药物流产后异常子宫出血者子宫内膜中血管生成素Ⅰ、Ⅱ的表达[J].解剖学报,2007,38(6):751-754.
[4]Lalitkumar S,Bygdeman M,Gemzell-Danielsson K.Midtrimester induced abortion:a review[J].Hum Reprod Update,2007,13(1):37-52.
[5]Gemzell-Danielsson K,Lalitkumar S.Second trimester medical abortion with mifepristone-misoprostol and misoprostol alone:a review of methods and management[J].Reprod Health Matters,2008,16(31 Suppl):162-172.
[6]李在容,万开芳.米非司酮配伍米索前列醇用于终止12~27周妊娠的临床观察[J].重庆医学2004,33(5):696-698.
[7]孟瑜,方爱华.药物流产及其应用[J].中国实用妇科与产科杂志,2008,31(12):8662-8668.
[8]刘舒,王绿娅,郭恒怡,等.血管生成素的作用机制和功能[J].中华病理学杂志,2003,32(3):273-275.
[9]钱领,刘南植.血管生成素家族与血管形成的研究进展[J].中华实用医学,2004,6(19):56-58.
[10]罗彦,魏于.促血管生成素及其受体TEK在血管形成中的调节作用[J].中华医学遗传学杂志,2006,23(1):63-66.
[11]Babischkin JS,Suresch DL,Pepe GJ,et al.Differential expression of placental villous angiopoietin-Ⅰand-Ⅱduring early,mid and late baboon pregnancy[J].Placenta,2007,28(2-3):221-218.
[12]Peirce SM,Price RJ,Skalak TC.Spatial and temporal control of angiogenesis and arterialization using focal applications of VEGF164 and Ang-Ⅰ[J].Am J Physiol Heart Circ Physiol,2004,286(3):918-925.
[13]焦贵霞,郭宏,张新东,等.促血管生成素在子宫内膜中的表达及其对早期妊娠自然流产的影响[J].山东医药,2008,48(5):79-80.
[14]Nayak NR,Kuo CJ,Desai TA,et al.Expression,localization and hormonal control of angiopoietin-Ⅰin the rhesusmacaque endometrium:potential role in spiral artery growth[J].Mol Hum Repord,2005,11(11):791-799.



