赵 青,马斌林
(新疆医科大学:1.第四附属医院超声科,乌鲁木齐832000;2.附属肿瘤医院乳腺头颈外科,乌鲁木齐830011)
乳腺癌现已成为威胁女性身心健康和生命的最严重的恶性肿瘤之一[1-4]。随着超声技术的发展,超声弹性成像为乳腺良、恶性肿块的鉴别诊断提供了一种新的影像学检查方法[5-9]。目前,弹性成像技术已逐渐推广应用,但通过另一种方法面积比值来鉴别乳腺肿块的良、恶性还处于探索阶段。现将本院138例患者乳腺肿块的良、恶性鉴别诊断价值报道如下。
1 资料与方法
1.1 一般资料 选择2011年1月至2012年6月新疆医科大学第四附属医院经手术病理检查证实的138例患者(乳腺肿块153个),按病情分为两组,恶性组46例,45例为女性,1例为男性,肿块最大直径8.0~29.3mm,平均(22.3±5.8)mm;患者年龄29~72岁,平均(47±11.5)岁;其中,浸润性导管癌37例(37个),原位癌6例(6个),浸润性小叶癌2例(2个),髓样癌1例(1个)。非恶性组共92例均为女性,肿块最大直径4.0~29.8mm,平均(17.6±0.8)mm;患者年龄17~68岁,平均(35.0±11.7)岁;其中,纤维腺瘤63例(78个),乳腺腺病16例(16个),炎症6例(6个),导管内乳头状瘤5例(5个),囊肿2例(2个)。排除肿块最大直径大于3cm、无法进行面积比测量者以及二维超声可以明确诊断乳腺囊肿的病例。
1.2 方法 超声检查使用西门子Acuson Antares及Acuson S2000彩色多普勒超声诊断仪,探头频率为7.5~13.0MHz。先进行乳腺常规扫查,再启动弹性成像模式,将探头垂直于皮肤正上方,调节肿块位置,使肿块位于取样框的中心位置,取样框大小为肿块面积的2倍左右[10],双幅实时观察二维及超声弹性成像图像,存储图像进行后期处理。
1.3 评判标准 根据文献[11]提出的弹性成像评分5分法,1分:肿块整体发生形变,弹性图像显示肿块整体为绿色;2分:肿块部分扭曲变形,或者中心不变形,弹性图像显示肿块由绿色和红色相混杂,但以绿色为主;3分:肿块边缘扭曲变形,但大部分没有发生变形,弹性图像显示肿块大部分为红色,周边部分为绿色;4分:肿块整体没有发生明显的变形,弹性图像显示肿块整体为红色;5分:肿块及周围组织均没有发生明显变形,弹性图像显示病灶及周围组织均为红色。根据Itoh弹性成像评分5分法[12],恶性病变:大于或等于4分;非恶性病变:小于等于3分。面积比诊断标准:用仪器测算病灶弹性成像图和灰阶声像图的面积比值[13],以面积比值构建ROC曲线,寻找面积比值的最佳诊断界点。
1.4 统计学处理 应用SPSS11.0软件进行统计学数据处理,计量资料以±s表示,乳腺良、恶性组的弹性成像面积比值是否有差异,采用t检验,定性资料用率描述,采用χ2检验进行率的比较,以P<0.05为差异有统计学意义。
2 结 果
2.1 硬度评分 恶性组39个肿块硬度评分大于等于4分,恶性病变占84.78%(图2A)。7个误诊为良性病变,评分小于4分,占15.22%(图2D);非恶性组93个肿块评分小于4分,诊断为良性病变,占86.92%(图2E)。14个误诊为恶性病变,评分大于3分,占13.08%(图2F)。硬度评分诊断乳腺恶性病变的灵敏度84.78%,特异度86.92%,正确指数0.717 0,阳性、阴性预测值分别为73.58%、93%,阳性、阴性似然比分别为6.48、0.18。恶性组中弹性硬度4~5分的出现率(84.78%)明显高于非恶性组(13.08%),P<0.05。见表1~2。
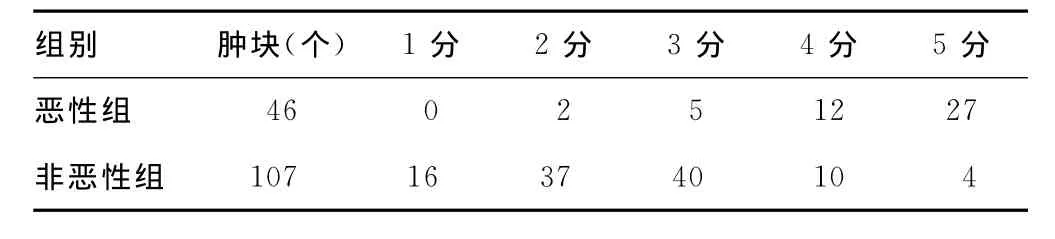
表1 两组患者乳腺肿块弹性成像评分比较

表2 两组患者硬度评分与病理结果比较
2.2 面积比鉴别乳腺良恶性肿块的检查结果
2.2.1 弹性图与二维图的面积比 恶性组弹性图与灰阶图面积比值为1.71±0.55,非恶性组肿块的弹性图与灰阶图面积比值为1.01±0.28。见表3。恶性组肿块的弹性成像图与灰阶声像图面积比值明显大于非恶性组肿块的面积比值(P<0.05),见表3。
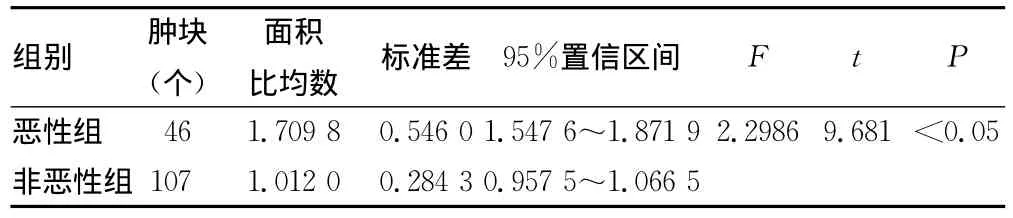
表3 两组患者弹性图与二维图面积比
2.2.2 ROC曲线 弹性图与灰阶图面积比值曲线下面积为0.860,肿块弹性图与二维图面积比为1.2,此界点鉴别诊断乳腺良、恶性时,其灵敏度、特异度、正确指数、阳性预测值最佳。见图1。

图1 超声弹性成像面积比值ROC曲线
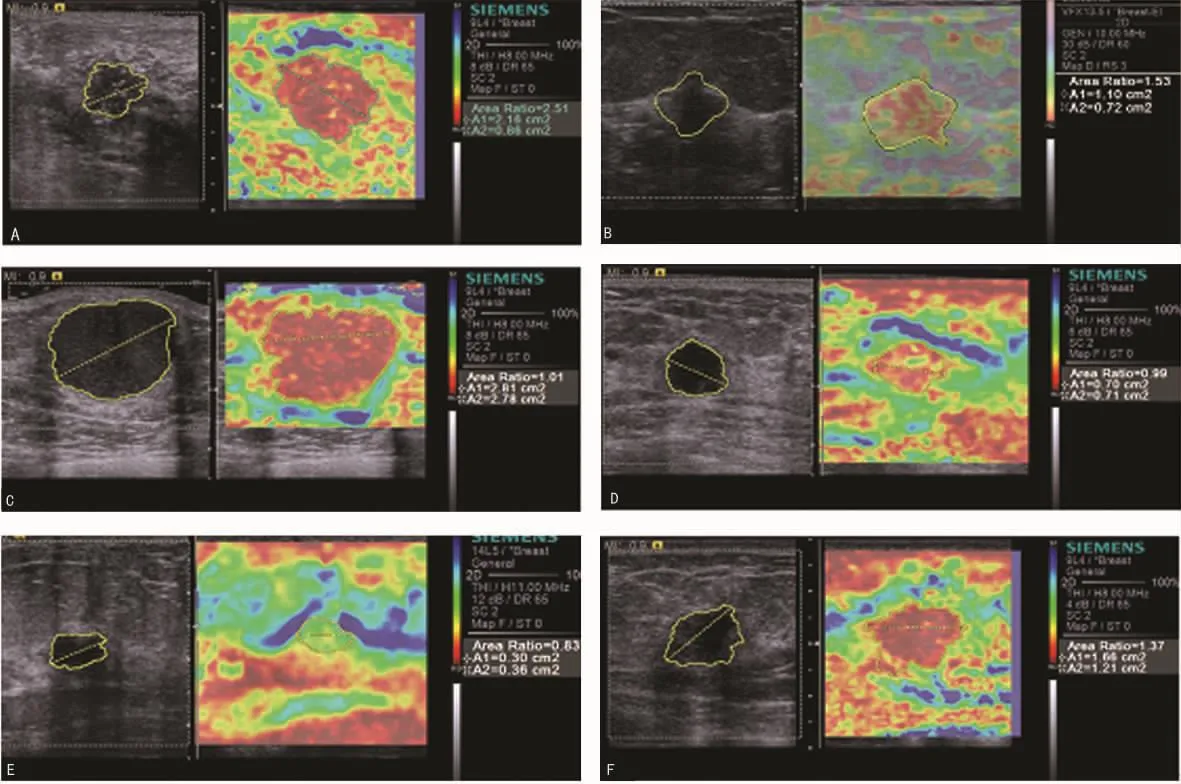
图2 病灶超声弹性成像
2.2.3 面积比与病理检查结果 恶性组46例恶性肿块中面 积比大于或等于1.2的病灶有35个,正确诊断为恶性病变(图2A、图2B),11个恶性病变被误诊为良性(图2C)。107例非恶性组肿块中面积比小于1.2的病灶有101个,正确诊断为良性病变(图2E),6个良性病变被误诊为恶性(图2F)。以面积比1.2为界点诊断乳腺恶性病变的灵敏度76.09%,特异度94.39%,正确指数 0.704 8,阳性及阴性预测值分别为85.37%、90.18%,阳性及阴性似然比分别为13.57、0.25。两组比较差异有统计学意义(P<0.05)。见表4。

表4 面积比与病理检查结果对比
2.3 硬度评分与面积比 见表5。
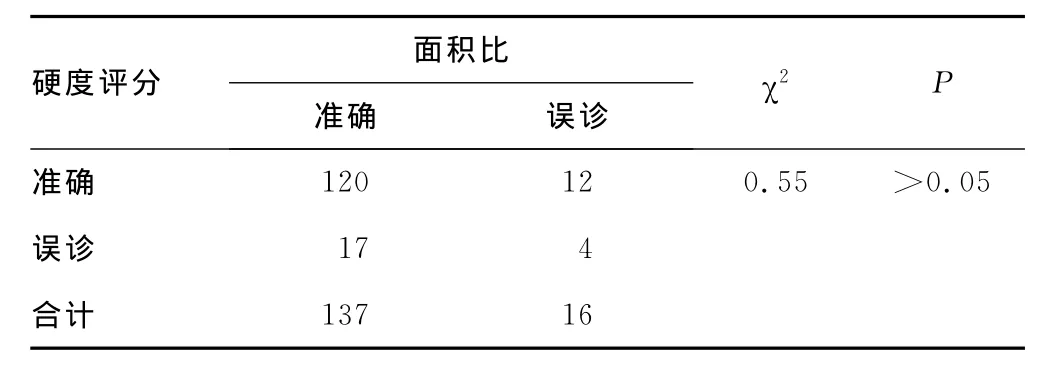
表5 硬度评分与面积比诊断结果比较(n=153)
3 讨 论
3.1 超声弹性成像硬度评分及面积比对乳腺肿块的诊断 研究结果显示,非恶性组所显示弹性图多以绿色为主,硬度评分基本上小于或等于3分,占86.92%(图2E),恶性病变所显示弹性图多以红色为主,硬度评分大于等于4分,占84.78%(图2A),这与国内外报道相符[14]。研究还发现二维超声表现不典型的乳腺炎性病灶和腺病,其声像图表现为边界不清,形态不规则,内部回声不均匀,误诊为恶性的病灶,此时使用超声弹性成像,若显示病灶表现为较软的图像,评分为1分或2分,就基本可以诊断其为良性病变,排除其恶性的可能(图2E)。恶性肿瘤在弹性图所显示的面积较其二维图上有明显的增大,分析原因可能是恶性肿瘤呈蟹足样浸润性生长牵拉周围组织,而且附近的结缔组织生成,使周围组织硬度增加,表现为弹性成像图比二维图面积增大。这表明弹性图可以间接地反映出乳腺恶性病变对周围组织的浸润范围及程度。
3.2 硬度评分及面积比的误诊分析 乳腺癌硬度评分受组织病理类型的影响,本研究中病理诊断为恶性病变的乳腺肿块硬度评分为3分,误判为良性病变。其中包括导管内癌(图2D)、髓样癌及内部出血、坏死的浸润性导管癌(图2B)。由于乳腺导管内癌主要发生在终末导管小叶单位,上皮细胞广泛增生并伴有上皮异型性,增生的上皮局限于导管内尚无间质的浸润,肿瘤未穿破基膜无成纤维反应,硬度相对较低,所以评分3分误判为良性病变[15-16]。髓样癌富含癌细胞并伴大量淋巴细胞浸润,但纤维及胶原含量少,质地相对较软,硬度较低,容易导致假阴性的发生。浸润性导管癌内部出血、坏死,癌组织质地变软,图像显示绿色为主,评分3分,故误判为良性病变。非恶性组中有的病理诊断为纤维腺瘤,弹性图显示以红色为主,评分4分,误诊为恶性病变。分析原因可能是肿块钙化、胶原化组织变性等因素,使其硬度偏高;另有病理诊断为导管内乳头状瘤的乳腺肿块评分为4分,这可能由于导管内乳头状瘤患者病灶相对较大,内质地较硬,纤维成分较多,所以误判;还有病理诊断为乳腺腺病,硬度评分却为4分或5分,考虑可能是由于乳腺局部腺体纤维化程度比较高,使得病灶及周边腺体硬度增高,显示出较硬的颜色导致误诊。以上病变虽然硬度评分产生了误判,但其弹性图面积较灰阶图面积明显增大,通过面积比可以正确诊断,避免了误诊。对于一些病变内部钙化或液化坏死等情况致使弹性图难以做出准确的评分时,超声弹性成像面积比测定可以作为一种新的检测指标对病灶的良、恶性做出判断[17-18]。
研究中发现,也有恶性肿瘤面积比小于1.2。其中1例为男性,浸润性导管癌(图2C),弹性成像显示病灶整体呈红色,硬度评分4分诊断为恶性,但根据面积比1.01误诊为良性病变。后分析此肿块包膜前缘约3mm×2mm范围与皮肤分界不清,疑似向皮肤浸润,而且硬度评4分支持恶性病变,若综合分析,不应误诊。病理诊断为乳腺导管内癌,弹性图硬度评分3分,面积比0.99,通过硬度评分及面积比误诊为良性病变(图2D)。可能是乳腺导管内癌增生的上皮只局限于导管内,对周围组织尚未浸润,未产生牵拉,二维与弹性图面积变化不大,所以误判为良性病变。非恶性组中部分乳腺腺病硬度评分5分,面积比大于或等于1.2,二者均误诊为恶性病变(图2F)。考虑可能是由于乳腺腺体及周边纤维化程度比较高,所以弹性图面积大于二维面积。
3.3 硬度评分与面积比评价乳腺肿块的对比结果分析 本研究硬度评分灵敏性较面积比高,而面积比特异性较硬度评分高,二者对乳腺病变进行评价各有优势。使用硬度评分灵敏度高于面积比,说明硬度评分正确判断恶性病变的能力高于面积比,可以较面积比更有效地发现恶性病变,减少了漏诊,尤其是对于评分4分的病变,这样可以有助于早期发现乳腺癌,为患者赢得早期诊断及治疗的时间;使用面积比诊断乳腺恶性病变的特异度较硬度评分高,说明使用面积比确定良性病变的能力较硬度评分高,这样可以减少误诊率,降低误诊对受检患者的身心带来的伤害,减轻患者进一步检查和治疗的成本,节约了检查的费用和医院的资源。
综上所述,以面积比大于1.2诊断恶性肿瘤,是弹性成像面积比鉴别乳腺肿块良、恶性的最佳诊断界点。硬度评分灵敏性较面积比高,而面积比特异性较硬度评分高,二者对乳腺肿块进行评价各有优势,硬度评分与面积比在鉴别乳腺良、恶性病灶时价值相当。
[1]姜玉新.乳腺超声诊断的研究方向[J].中华超声影像学杂志,2000,9(1):8-9.
[2]Rahbar G,Sie AC,Hansen GC,et al.Benign versus malignant solid breast masses:US differentiation[J].Radiology,1999,213(3):889-894.
[3]郑莹,李德禄,向泳梅,等.上海市区乳腺癌流行现状及趋势分析[J].外科理论与实践,2001,6(4):219-221.
[4]Taylor LS,Porter BC,Rubens DJ,et al.Three-dimensional sonoelastography:principles and practices[J].Phys Med Biol,2000,45(6):1472-1496.
[5]田家玮,陈宇,刘宇杰.高频超声与X线钼靶联合应用对早期乳腺癌的诊断价值[J].中国医学影像技术,2006,22(4):557-559.
[6]张蒂荣,鲁树坤,王双双,等.乳腺肿块的彩色多普勒血流频谱形态与病理对照研究[J].中华超声影像学杂志,2004,13(6):439-441.
[7]王迎,陈小燕.小乳癌高频声像图及血流显像分析[J].临床和实验医学杂志,2009,8(1):57-58.
[8]赵峰,邢虎,张歆,等.高频超声对乳腺肿瘤内部微钙化灶的敏感度和特异度的研究[J].中国实验诊断学,2009,13(1):75-76.
[9]颜玮,冯炎,马方,等.灰阶超声、彩色多普勒超声在早期乳腺癌诊断的应用价值[J].同济大学学报,2007,28(3):52-54.
[10]罗葆明,曾婕,智慧,等.乳腺超声弹性成像检查感兴趣区域大小对诊断结果影响[J].中国医学影像技术,2007,23(9):1330-1332.
[11]Thomas A,Kümmel S,Fritzsche F,et al.Real-time sonoelastography performed in addition to B-mode ultrasound and mammography:improved differentiation of breast lesions?[J].Acad Radiol,2006,13(12):1496-1504.
[12]Taylor LS,Porter BC,Rubens DJ,et al.Three-dimensional sonoelastography:principles and practices[J].Phys Med Biol,2000,45(6):1472-1496.
[13]Kallel F,Ophir J.Limits on the contrast of strain concentrations in elastography[J].Ultrasound Med Biol,1988,24(8):1215-1219.
[14]富丽娜,王怡,王涌.超声弹性成像与常规超声联合应用在乳腺病灶良恶性鉴别上的价值[J].中国医学计算机成像杂志,2007,13(2):124-126.
[15]王新允,宋文静,马莹,等.天津医科大学20年乳腺肿瘤临床病理分析[J].中国肿瘤,2002,11(10):581-583.
[16]范晓芳,丁勇俊,王卫理,等.实时组织弹性成像结合彩色多普勒超声诊断乳腺肿瘤的研究[J].徐州医学院学报,2009,29(11):763-765.
[17]Itoh A,Ueno E,Tohno E,et al.Breast disease clinical application of US elastography for diagnosis[J].Radiology,2006,239(2):341-350.
[18]Kallel F,Ophir J.Limits on the contrast of strain concentrations in elastography[J].Ultrasound Med Biol,1988,24(8):1215-1219.



