吴艾霖,熊怡淞,王艳艳,曲远青,吴丽娟△
(1.第三军医大学研究生管理大队,重庆 400038;2.成都军区总医院临床
实验医学研究与保障中心,成都 610083)
论着·基础研究
热休克蛋白70基因rs1008438多态性与高原肺水肿的相关性*
吴艾霖1,2,熊怡淞2,王艳艳2,曲远青2,吴丽娟2△
(1.第三军医大学研究生管理大队,重庆 400038;2.成都军区总医院临床
实验医学研究与保障中心,成都 610083)
目的 探讨热休克蛋白(HSP)70基因启动子区rs1008438位点单核苷酸多态性(SNP)与高原肺水肿(HAPE)之间的关系。方法 采用PCR-DNA直接测序法检测100例HAPE组、200例健康对照组个体基因组rs1008438位点的基因分布,分析不同基因型与HAPE的关系;运用ELISA法检测不同基因型HAPE组和健康对照组白细胞细胞质和细胞核HSP70蛋白含量变化;应用蛋白质芯片技术和EVIDENCE180全自动芯片仪分析TNF-α、IL-1β、IL-6表达水平。结果 HAPE组,健康对照组rs1008438的TT、GT、GG的基因型频率分别是76.0%、20.0%、4.0%,93.0%、6.5%、0.5%。统计处理显示,HAPE组TT基因型频率明显低于健康对照组(P<0.05);GT、GG基因型患HAPE的危险性是TT基因型的4.195倍,G等位基因相对T等位基因也能明显增加HAPE的发病风险(OR=4.178);ELISA检测结果显示,不同基因型HAPE组HSP70含量均高于健康对照组,且HSP70细胞核/细胞质比值TT基因型高于GT/GG基因型;蛋白质芯片检测表明,HAPE组血清中的TNF-α、IL-1β、IL-6表达水平均明显高于健康对照组。结论 rs1008438位点多态性与HAPE易感性相关,这种相关性可能是由于突变型在基因转录水平通过影响启动子活性而增强HSP70表达,从而导致HAPE的发生。
多态性,单核苷酸;高原肺水肿;rs1008438;热休克蛋白70;启动子
高原肺水肿(high altitude pulmonary edema,HAPE)是指近期抵达高原(一般指海拔3 000 m以上),出现静息时呼吸困难、胸闷压塞感、咳嗽、咳白色或粉红色泡沫痰,患者感觉全身乏力或活动能力减低的疾病,是遗传和环境因素共同作用的结果。近年来,对于HAPE的研究热点涉及体内多个系统,如细胞离子转运系统、内皮系统等[1-4]。热休克蛋白(HSP)是一组细胞在应激环境诱导下生成的一组蛋白质。人快速进入高原环境时,体内的HSP会迅速增高来提高细胞的应激能力,抵抗外部的不利因素,其中一个机制为调节Na+-K+-ATP酶的活性,防止水分进入肺泡,引起HAPE[5]。Qi等[6]对修建青藏铁路的中国工人进行了调查,观察了148名HAPE患者和438名健康者,结果表明HSP70的rs1061581、rs1043618 和 rs1008438位点的多态性可能与HAPE易感性相关,尤其rs1008438通过改变HSPA1A的启动子活性对HAPE的发生、发展起重要作用。
作者通过生物信息学分析的方法发现HSP70基因启动子区rs1008438位点位于转录因子结合区域,且在国际人类基因组单体型图计划(www.Hapmap.org)中查询到在中国汉族人群中等位基因频率大于12%,推测其可能影响HSP70基因的表达,从而导致HAPE的发生。本研究通过对临床HAPE病例及健康人群的研究,探讨rs1008438多态性与HAPE的关系,以深入认识HAPE发生、发展的遗传基础,为临床HAPE患者的预防提供客观依据。
1 资料与方法
1.1 一般资料 新入伍战士1 200人,汉族,所有研究对象均为男性,年龄18~20岁,入伍前经体检身体健康。分别从23、110、396 m和891 m的4个不同海拔地乘火车抵达海拔505 m(成都)集结地,休整7 d后乘飞机到达海拔3 658 m高原(拉萨)。除非特指,本研究中平原海拔高度为505 m,高原海拔高度为3 658 m。从本次受试者符合急性高原反应评分量表(AMS Lake Loulse)评分诊断标准的HAPE患者中选取100名患者作为HAPE组,从未达到诊断标准的人群中随机选取200名作为健康对照组,两组人员除观察因素外其他一般资料(服役时间、身高、体质量、身体状况、祖籍地) 基本均衡。
1.2 主要实验材料 高保真PrimeSTAR HS DNA Polymerase PCR试剂盒、PrimeScript RT(逆转录)PCR试剂盒、SYBR premix EX taq荧光定量PCR试剂盒(TaKaRa公司);DNA胶回收纯化试剂盒、柱式总RNA提取试剂盒及所有引物合成(上海生工生物技术有限公司);HSP70 ELISA试剂盒(Stressgen Biotechnologies,Canada);蛋白质芯片试剂盒和EVIDENCE180全自动芯片仪(Randox,UK)。
1.3 基因分型
1.3.1 基因组DNA提取 清晨空腹状态下采集各组人群外周静脉全血,乙二胺四乙酸二钾(EDTA-K2)抗凝。基因组DNA提取使用酚-氯仿法,nano 2000超微量分光光度计测定A260及A280,判断基因组DNA的纯度和浓度。
1.3.2 目的基因的PCR扩增及纯化 ABI 2720 PCR仪用于目的片段的扩增,上游引物5′-GTG ACA CTC TGC TCC AAA CTT CT-3′,下游引物5′-CCC CTT GTC TAT TTC TGC TCA C-3′。反应体系含2×PrimeSTAR GC Buffer 25.0 μL,PrimeSTAR HS DNA Polymerase 0.5 μL,2.5 mM dNTPs Mixture 4.0 μL,10.0 μM引物各1.0 μL,DNA模板1.0 μL,双蒸水补足50.0 μL。反应条件:预变性95 ℃ 3 min,变性94 ℃ 30 s,退火59 ℃ 35 s,延伸72 ℃ 50 s,共35个循环,最后72 ℃延伸5 min。1.5%琼脂糖凝胶电泳PCR扩增产物,用柱式DNA胶回收试剂盒进行切胶纯化回收。PCR纯化产物测序美国ABI公司3730测序列分析仪测序。
1.4 HSP70含量测定 患者和健康组均取清晨空腹血2 mL(EDTA-K2抗凝)用于HSP70检测。血样标本用红细胞裂解液破坏红细胞并用PBS洗涤1次(1 000 r/min,10 min),计数5×106个细胞,用蛋白提取试剂盒(Pierce)分别抽提细胞质蛋白和细胞核蛋白,置于-70 ℃待测。HSP70用 ELISA试剂盒检测,具体操作严格按试剂盒说明书进行。
1.5 细胞因子检测 运用蛋白质芯片技术和Evidence180全自动芯片仪检测并分析HAPE组和健康对照组血清中细胞因子TNF-α、IL-1β、IL-6的表达水平。两组人群清晨空腹抽血5 mL于分离胶管(BD公司生产),室温放置30 min,3 000 r/min离心10 min,分离血清,置于-80 ℃冰箱贮存待检。具体方法及操作过程参见文献[7]。
1.6 统计学处理 各组均采用χ2检验进行Hardy-Weinberg遗传平衡检验;采用SPSS13.0行统计学分析,采用χ2检验及Fisher精确检验分析病例对照之间的基因型分布并计算优势比OR值和95%CI。荧光定量PCR数据通过2-△△CT法[4]换算成相对含量并进行分析,HSP70表达及细胞因子间比较利用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 rs1008438基因型分布
2.1.1 RT-PCR直接测序法分型结果 如图1所示,测序峰清晰,无明显杂峰,结果稳定,能明显区分TT、GT、GG 3种基因型。健康对照组200例标本中,HSP70启动子rs1008438位点基因型为GG的1例(0.5%)、GT的13例(6.5%)、TT的186例(93.0%);HAPE组100例标本中,HSP70启动子rs1008438位点基因型为GG的4例(4.0%)、GT的20例(20.0%)、TT的76例(76.0%)。由Hardy-Weinberg平衡计算得到两组的P值分别为0.31、0.16,均大于0.05,说明各组人群都符合Hardy-Weinberg,样本选择具有代表性。
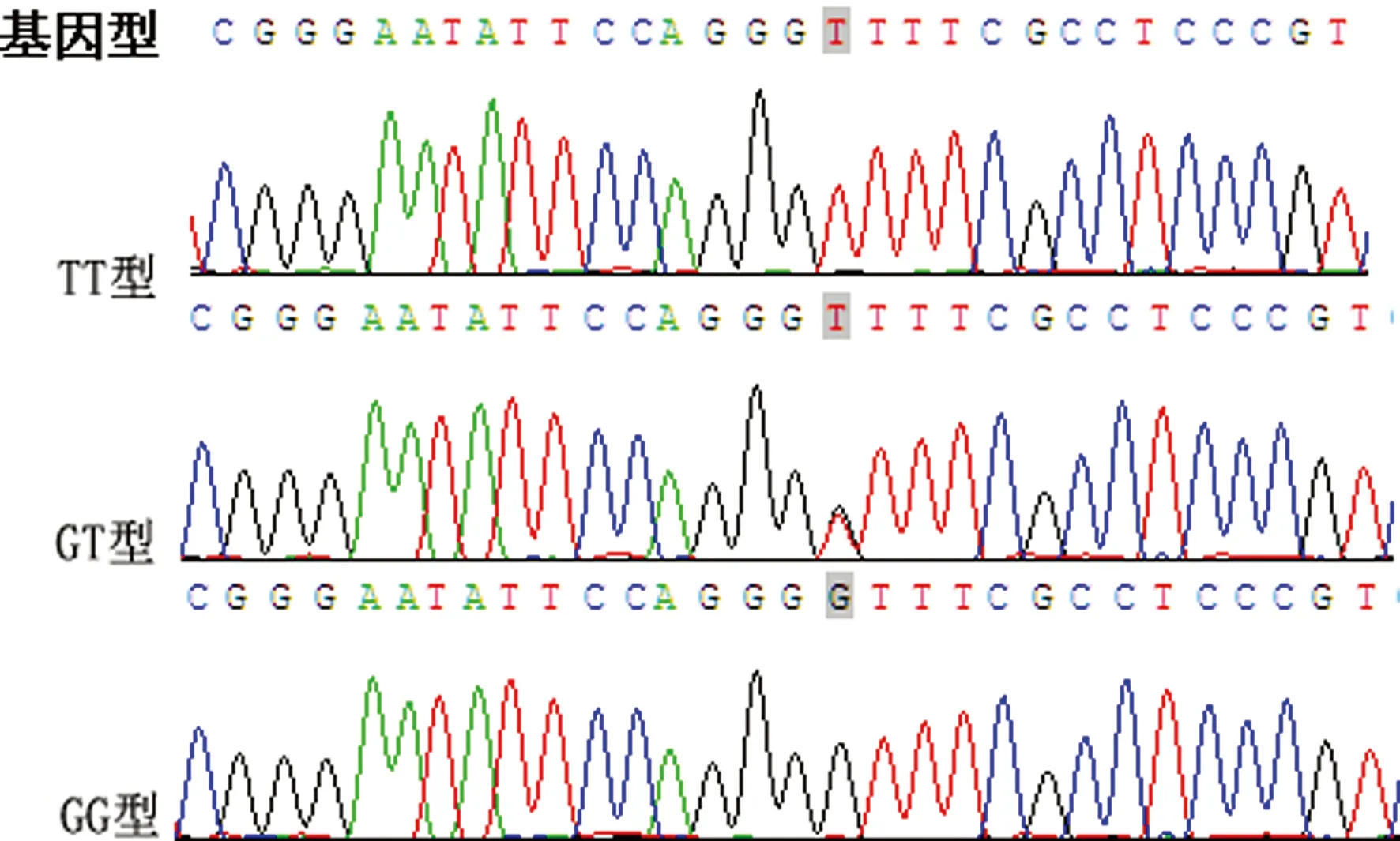
图1 HSP70基因启动子区rs1008438位点测序峰图。
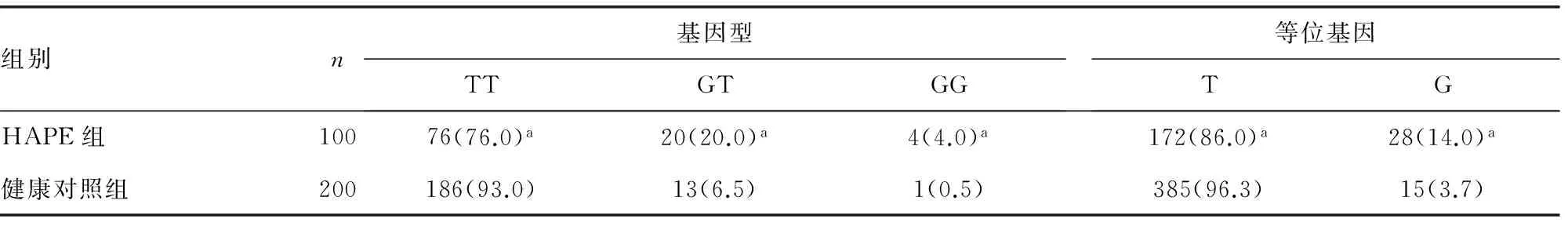
表1 各组HSP70基因rs1008438位点基因型及等位基因频率分布[n(%)]
a:P<0.05,与健康对照组比较。
2.1.2 各基因型及等位基因频率分布情况 各组等位基因均以T等位基因最为常见,突变型GT基因型及GG基因型罕见。HAPE组TT基因型频率明显低于健康对照组(P<0.05),而GT和GG基因型则明显高于健康对照组(均P<0.05);等位基因频率分析同样显示HAPE组G等位基因频率明显高于健康对照组(P<0.05),见表1。对基因易感性分析发现,GT、GG基因型患HAPE的危险性是TT基因型的4.195倍(OR=4.195,95%CI:3.767~4.622),G等位基因相对T等位基因也能明显增加HAPE的发病风险(OR=4.178,95%CI:3.750~4.606)。
2.2 HSP70含量测定实验 不同基因型HAPE组和健康对照组白细胞细胞质和细胞核HSP70蛋白含量测定结果见表2。对于HAPE组,HSP70含量在细胞核和细胞质中的比值(细胞核/细胞质),TT基因型明显高于GT、GG基因型;并且TT、GT、GG在细胞核中的绝对含量也均高于细胞质,GT、GG基因型与TT基因型比较,表现尤为明显。对于健康对照组,则没有上述表现。另外,健康对照组与HAPE组比较,GT、GG基因型 HSP70含量明显低于TT型。
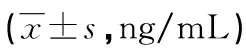
表2 不同基因型HAPE组和健康对照组白细胞细胞质和细胞核HSP70蛋白比较
2.3 细胞因子水平表达 健康组与HAPE组比较,HAPE组血清中TNF-α、IL-1β、IL-6表达水平明显增高,见图2。
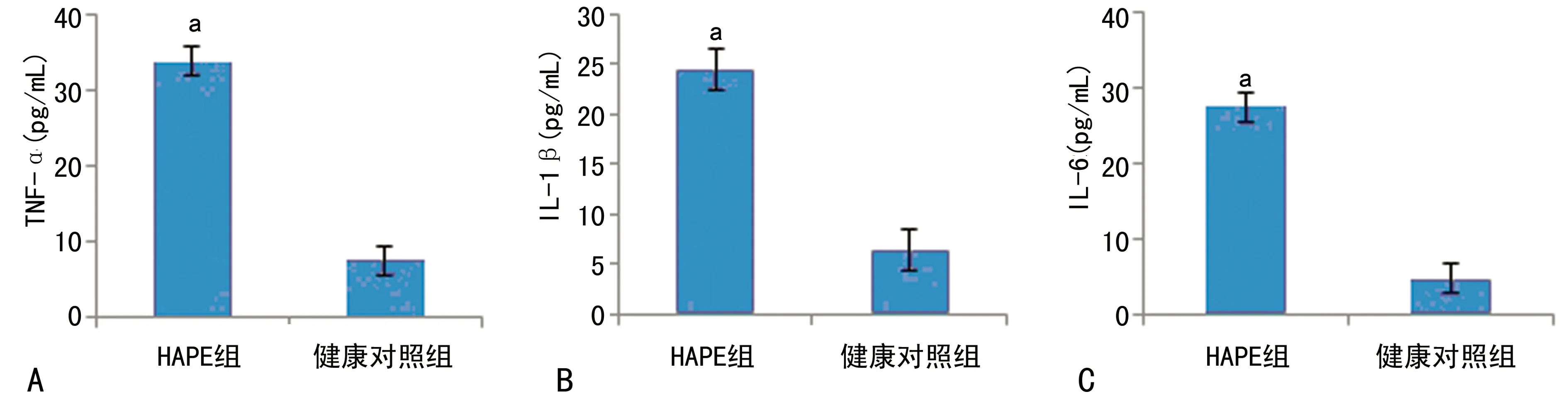
A:TNF-α;B:IL-1β;C:IL-6;a:P<0.05,与健康对照组比较。
图2 HAPE组和健康对照组血清中TNF-α、IL-1β、IL-6含量比较
3 讨论
HSP70是进化上最保守的蛋白质之一,相对分子质量约70×103,主要由一个N端高度保守的44 ku ATPase功能域(ATPbindingdomain)和一个相对分子质量为25 ku的C端区域组成[8]。其具有(1)分子伴侣功能:在细胞中执行最基本的生理功能,如蛋白质折叠、伸展、转运、寡聚体的形成和解聚等,维持细胞的生存和功能,在应激的不利条件下,提高细胞的抵抗力,起到应激保护作用;(2)协同免疫作用:正常情况下HSP70在细胞内呈基础表达,表达水平较低;而在高温及各种有害应激状态下,HSP70的合成速度明显增加,一般数分钟内即可达到最高水平,而原来的蛋白质合成则减少,以提高生物体的抗应激能力[9-12]。Qi等[6]的研究证实在正常情况下HSP70位于细胞质内,当细胞遭受应激作用时,如高温、高湿等极端环境,人体会迅速动员细胞质中的HSP70到细胞核内并包围核仁,细胞质内只有少量存在,以此来抵御外来的不利因素,维持人体正常的功能。本研究表明HAPE患者HSP70含量细胞核/细胞质,TT基因型明显高于GT、GG基因型。这可能提示突变型GT、GG基因型及G等位基因更易患HAPE。同时,在HAPE组中,细胞核中的HSP70的绝对含量也明显高于细胞质,这可能是因为人为了适应高原的极端环境,在极短时间内,人体动员大量细胞质中的HSP70到细胞核以此抵御外来不利因素而产生的一种自卫表现。同时,蛋白质芯片技术检测表明,HAPE组和健康对照组血清中细胞因子TNF-α、IL-1β、IL-6的表达水平存在明显差异,前者远远高于后者(P<0.05)。这可能是因为HAPE组的HSP70增高所致。Asea等[13-14]研究表明HSP70会上调TNF-α、IL-1β、IL-6等细胞因子的表达水平。这进一步证明了HSP70与HAPE有很大的关联。这也表明HAPE患者为了抵御外来的不利因素,在短时间内,迅速动员相关细胞因子,激活或者沉默某些免疫途径,以此来维护生命的稳定。
借助病例-对照试验,作者还分析了HAPE组和健康对照组基因型rs1008348位点的多态性,结果显示健康对照组T等位基因频率96.3%,与Hapmap中记录的CHB人群T等位基因频率接近[15];且病例组无论在基因型频率还是在等位基因频率分布上与健康组相比均有明显差异,野生型TT纯合子频率明显低于健康组。而且从基因型频率的易感性分析发现,GT/GG基因型及G等位基因明显增加HAPE发生的风险。上述发现表明rs1008348位点G等位基因与HAPE的发生密切相关。
综上所述,HSP70启动子rs1008438 GT、GG基因型及G等位基因与HAPE的发生明显相关,且经过对HAPE组和健康对照组血清中细胞因子TNF-α、IL-1β、IL-6的含量测定,初步分析验证上过观点,为更深入认识HAPE发生的分子机制在基因和蛋白水平上奠定了基础。
[1]Saxena S,Kumar R,Madan T,et al.Association of polymorphisms in pulmonary surfactant protein A1 and A2 genes with high-altitude pulmonary edema[J].Chest,2005,128(3):1611-1619.
[2]Meyer S,Z′graggen BR,Blumenthal S,et al.Hypoxia attenuates effector-target cell interaction in the airway and pulmonary vascular compartment[J].Clin Exp Immunol,2007,150(2):358-367.
[3]Qi Y,Niu W,Zhou W,et al.Correlation between angiotensinogen gene polymorphisms and essential hypertension in Chinese population[J].J Hum Hypertens,2008,22(2):147-150.
[4]Manuguerra M,Matullo G,Veglia F,et al.Multi-factor dimensionality reduction applied to a large prospective investigation on gene-gene and gene-environment interactions[J].Carcinogenesis,2007,28(2):414-422.
[5]Munro S,Pelham HR.An Hsp70-like protein in the ER:identity with the 78 kd glucose-regulated protein and immunoglobulin heavy chain binding protein[J].Cell,1986,46(2):291-300.
[6]Qi Y,Niu WQ,Zhu TC,et al.Genetic interaction of Hsp70 family genes polymorphisms with high-altitude pulmonary edema among Chinese railway constructors at altitudes exceeding 4000 meters[J].Clin Chim Acta,2009,405(1/2):17-22.
[7]郭广宏,田亚平.生物蛋白芯片技术在细胞因子检测上的应用[J].军医进修学院学报,2005,26(5):338-339.
[8]邱烈,管勤,袁英.HSP70对组织细胞的保护[J].重庆医学,2009,38(15):1977-1980.
[9]李霞绯.细胞外热休克蛋白70的释放、受体及功能[J].重庆医学,2011,40(14):1448-1450.
[10]孙运良,徐灿,苏长青,等.重组腺病毒介导Hsp70基因表达对胰腺癌荷瘤小鼠的免疫功能影响[J].重庆医学,2012,41(32):3353-3355,3359.
[11]Wu YR,Wang CK,Chen CM,et al.Analysis of heat-shock protein 70 gene polymorphisms and the risk of Parkinson′s disease[J].Hum Genet,2004,114(3):236-241.
[12]Li JX,Tang BP,Sun HP,et al.Interacting contribution of the five polymorphisms in three genes of Hsp70 family to essential hypertension in Uygur ethnicity[J].Cell Stress Chaperones,2009,14(4):355-362.
[13]Asea A,Kraeft SK,Kurt-Jones EA,et al.HSP70 stimulates cytokine production through a CD14-dependant pathway,demonstrating its dual role as a chaperone and cytokine[J].Nat Med,2000,6(4):435-442.
[14]Asea A,Rehli M,Kabingu E,et al.Novel signal transduction pathway utilized by extracellular HSP70:role of toll-like receptor(TLR) 2 and TLR4[J].J Biol Chem,2002,277(17):15028-15034.
[15]Lorenzo VF,Yang Y,Simonson TS,et al.Genetic adaptation to extreme hypoxia:study of high-altitude pulmonary edema in a three-generation Han Chinese family[J].Blood Cells Mol Dis,2009,43(3):221-225.
The relationship between rs1008438 polymorphism of HSP70 gene and high altitude pulmonary edema*
WuAilin1,2,XiongYisong2,WangYanyan2,QuYuanqing2,WuLijuan2△
(1.PostgraduateManagementAgency,theThirdMilitaryMedicalUniversity,Chongqing400038,China;2.ResearchandServiceCenterofLaboratoryMedicine,ChengduMilitaryGeneralHospital,Chengdu,Sichuan610083,China)
Objective To investigate the relationship between the single nucleotide polymorphisms(SNP) of rs1008438 in HSP70 promoter and the susceptibility of high altitude pulmonary edema(HAPE).Methods The PCR-DNA sequencing method was used to analyze gene distribution of rs1008438 in 100 HAPE patients and 200 healthy people,and the relationship between different genotypes and HAPE was evaluated.Meanwhile,HSP70 protein in cytoplasm and nuclei of white blood cells were detected by ELISA in patientgroup and healthy group.TNF-α,IL-1β and IL-6 levels were analyzed by protein chip technology and EVIDENCE180 automatic chip reader.Results The TT,GT,and GG genetype frequencies of rs1008438 in HAPE patients and healthy controls were 76.0%,20.0%,4.0%,and 93.0%,6.5%,0.5%,respectively.The TT genetype frequency in HAPE patients was significantly lower than that in healthy control(P<0.05).The HAPE incidence rate in GT/GG genetype was 4.195 times higher than that in TT genetype,and the allele G can also significantly increase the prevalence of HAPE compared to T allele(OR=4.178).ELISA showed that HSP70 were higher in HAPE group of all genotypes than those in healthy control of the same genotype.And the nuclei/cytoplasm ratio of HSP70 in TT genotype was higher than that in GT/GG genotype.Protein chip showed that the levels of TNF α,IL-1β,and IL-6 in HAPE group were significantly higher than those in healthy control.Conclusion The polymorphism of rs1008438 is related to susceptibility of HAPE.Mutate genetype may change the promoter activity and increase the expression of HSP70,which induced HAPE.
polymorphism,single nucleotide;high altitude pulmonary edema;rs1008438;HSP70;promoter
10.3969/j.issn.1671-8348.2015.05.006
国家自然科学基金资助项目(81302596);成都军区总医院创新科研基金资助项目(2011YG-A23、2013YG-B064)。 作者简介:吴艾霖(1982-),主管技师,在读硕士,主要从事siglec-1介导组织巨噬细胞炎性反应参与类风湿关节炎发病机制研究。△
,E-mail:wulijuan1638@126.com。
R394.3
A
1671-8348(2015)05-0593-04
2014-09-13
2014-10-10)



