苏小桃,何 俊,欧 军,申莹莹
(南华大学:1.附属南华医院脊柱外科;2.附属第一医院临床医学研究所,湖南衡阳 421001)
论着·基础研究
二甲双胍抑制骨肉瘤MG63细胞的迁移和侵袭能力*
苏小桃1,何 俊1,欧 军1,申莹莹2△
(南华大学:1.附属南华医院脊柱外科;2.附属第一医院临床医学研究所,湖南衡阳 421001)
目的 观察二甲双胍对骨肉瘤MG63细胞的迁移侵袭能力的影响。方法 以骨肉瘤MG63细胞株为研究对象,二甲双胍处理后分别采用transwell小室法检测细胞迁移和侵袭能力的变化,采用明胶酶谱实验检测基质金属蛋白酶2(MMP-2)和MMP-9的活性,采用real-time PCR法检测细胞中埃兹蛋白(Ezrin) mRNA的表达,采用Western blot检测Ezrin蛋白的表达;Lipofectamine 2000转染Ezrin质粒到细胞中观察其对二甲双胍诱导的细胞迁移侵袭抑制及对下游信号通路的影响。结果 二甲双胍可显着抑制MG63细胞的迁移和侵袭,并降低MMP-2和MMP-9的酶活性。用药48 h后,MG63细胞内Ezrin的mRNA和蛋白水平均明显下降,且上调Ezrin可减弱二甲双胍诱导的骨肉瘤细胞迁移和侵袭抑制及二甲双胍诱导的MAPK/Erk信号通路抑制。结论 二甲双胍可抑制MG63细胞的迁移和侵袭能力,可能是通过下调Ezrin和MAPK/Erk信号通路而实现。
二甲双胍;骨肉瘤;细胞运动;肿瘤浸润;埃兹蛋白;MAKP/Erk信号通路
骨肉瘤是最常见的原发性骨肿瘤,其特征是具有高度恶性的倾向,能迅速破坏周围的组织,并发生转移[1]。当骨肉瘤复发或发生转移时预后极差[2]。尽管目前疗效确切的临床化疗药物不断涌现,如大剂量甲氨蝶呤、多柔比星、顺铂和异环磷酰胺等,但化疗药物较大的毒副作用及逐渐出现的耐药性成为制约其发展的主要问题,而应用血管内皮抑素、端粒酶靶向治疗等较新的方法治疗骨肉瘤的临床研究目前尚处于起步阶段,其有效性和安全性尚需大量临床资料证实[3-4]。因此,亟待寻找一种安全、有效的药物来延缓骨肉瘤进展,提高骨肉瘤患者生存率。二甲双胍作为一种临床上使用多年的常见降糖药,其安全性已经得到了充分验证。近来,相关研究表明二甲双胍在一定程度上具有抗肿瘤作用[5-7],基于此,本实验拟研究二甲双胍对骨肉瘤MG63细胞迁移和侵袭的影响并探讨其作用机制以期明确其在骨肉瘤治疗的可能性。埃兹蛋白(Ezrin)是ERM家族中重要的成员,它最初是在研究鸡小肠黏膜细胞刷状缘微绒毛的细胞骨架的主要成分时被首次发现。Ezrin 作为外层细胞骨架为真核细胞质膜结构提供支持作用。Ezrin是一个相对分子质量为82×103的磷酸化蛋白质,由villin-2基因编码表达。研究显示,Ezrin在多种肿瘤的转移中发挥着重要的作用[8-11]。Ezrin作为一个同时与间叶和上皮来源的多种恶性肿瘤转移高度相关的蛋白,正越来越引起人们的重视。目前的研究表明二甲双胍可通过不同的机制抑制多种不同的肿瘤,如二甲双胍可通过靶向Stat3抑制三阴性乳腺癌细胞的生长并诱导细胞的凋亡,还可通过下调miRNAs减弱胰腺癌干细胞的功能从而抑制胰腺癌细胞的增殖和侵袭转移能力[5-6]。为明确二甲双胍抑制骨肉瘤细胞迁移和侵袭能力的分子机制,本研究观察Ezrin在二甲双胍处理前后的变化,并探讨其是否为二甲双胍的关键靶点。
1 材料与方法
1.1 材料 人骨肉瘤细胞株MG63购于中国科学院上海细胞库。RPMI1640培养液、胎牛血清购于美国Gibco公司,二甲双胍购于Sigma-Aldrich公司,Ezrin抗体和actin抗体购于abcam公司,Akt抗体,p-Akt(Ser473)抗体,Erk1/2抗体,p-Erk1/2(Thr202/Tyr204)抗体,辣根过氧化物酶标记的二抗购于Cell signaling公司,Ezrin质粒购于Origene公司,Lipofectamine 2000 购于invitrogen公司,transwell小室购于corning公司,基质胶购于BD公司,trizol购于invitrogen公司,RT-PCR试剂盒购于Fermentas公司,q PCR试剂盒购于takara公司。BCA蛋白定量试剂盒,RIPA裂解液,PMSF,上样缓冲液均购于碧云天公司。明胶酶谱试剂盒购于GENMED公司。蛋白Marker购于Bio-Rad公司,PVDF膜购于Millipore公司,ECL发光液购于Pierce Biotechnology公司,胶片购于Kodak公司。青霉素、硫酸链霉素购于北京鼎国生物技术有限公司。
1.2 方法
1.2.1 细胞培养 MG63细胞接种于含10%胎牛血清,100 U/mL青霉素,100 μg/mL链霉素的RPMI1640培养液中,置于37 ℃,5%CO2及饱和湿度条件的培养箱中培养。
1.2.2 实验分组 于6孔细胞培养板每孔接种2×105个MG63细胞,单层培养至细胞覆盖率为80%左右。细胞分为实验组和对照组。对照组:不加药;实验组:加入二甲双胍,使其终浓度为10 mmol/L,培养48 h后收集细胞进行后续实验。浓度选取理由:查阅多篇文献发现二甲双胍抑制多种肿瘤侵袭迁移效果较明显时浓度均为10~30 mmol/L,故采纳了最低的整倍数浓度10 mmol/L[6,12-13]。
1.2.3 实时荧光定量PCR MG63细胞接种于6孔板,加入或不加入10 mmol/L二甲双胍培养48 h后,收集细胞。Trizol试剂法提取总RNA,按照RT-PCR试剂盒说明书进行逆转录反应。每组取50 ng cDNA,用SYBR Premix Ex TaqⅡKit试剂盒进行实时荧光定量PCR反应。Ezrin的正向和反向引物分别是5′-ACG TCT GAG AAT CAA CAA GC-3′,5′-TTC TCC TCA TAG TCC TGC AG-3′;GAPDH的正向和反向引物分别是5′-TGC CAC TCA GAA GAC TGT GG-3′,5′-GGA TGC AGG GAT GAT GTT CT-3′。每孔反应体积为20 μL,每组3个重复孔。PCR扩增条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸20 s,共计35个循环,72 ℃再延伸10 min。反应在Roche Lighcycler 480系统进行,结果处理用△Ct值法。
1.2.4 Western blot检测 MG63细胞接种于6孔板,加入或不加入10 mmol/L二甲双胍培养48 h后,收集细胞,PBS洗1次,加入 RIPA(含蛋白酶抑制剂)裂解细胞,冰上放置30 min,超声断裂 DNA,低温离心取上清于另一EP 管。二喹啉甲酸(BCA)法测定蛋白浓度,取40 μg总蛋白变性后100~130 V恒压电泳约90 min,200 mA恒流转膜约120 min。5%牛奶摇床室温封闭1 h,一抗室温摇床孵育1 h后4 ℃ 过夜。PBST洗3次,二抗室温摇床孵育1 h。PBST洗2次,PBS洗1次,曝光。
1.2.5 细胞侵袭和迁移实验 细胞侵袭实验:MG63细胞种板,加入10 mmol/L二甲双胍培养48 h,将存活的骨肉瘤细胞种入已铺好Matrigel基质胶的Tranwell小室上层,行无血清培养36 h,吸去孔中培养基,用PBS洗2次,4%多聚甲醛固定30 min,稍微晾干后用结晶紫染色20 min,用棉签擦去上室面上的细胞,PBS洗3次,取出小室,晾干,镜下拍照。100倍显微镜下计数上下左右中5个随机不同视野的穿膜细胞数,取均值。实验重复3次。细胞迁移实验:方法同侵袭实验,只是transwell上室不用基质胶处理,观察时间为24 h。
1.2.6 明胶酶谱实验 MG63细胞加入10 mmol/L二甲双胍处理48 h后,每孔加入1 mL无血清培养基继续培养24 h,收集上清液,将上清液移入离心管中2 000 r/min,4 ℃离心10 min,上清液用Amicon Ultra-15 Centrifugal Filter Deviceces浓缩,测定蛋白浓度于-80 ℃储存备用。配置8%分离胶和5%浓缩胶(胶中均含1%明胶),取30 μg蛋白与上样缓冲液(非还原型)混合,不加热。4 ℃电泳,80 V约1.5 h。电泳结束后,将凝胶用去离子水洗两次后,用1×buffer A震荡洗脱2次,每次30 min。将凝胶置于孵育液buffer B中37 ℃温箱中孵育42 h。用考马斯亮蓝染色液染色2 h,脱色液(冰醋酸∶甲醇∶去离子水=5∶7∶88)震荡脱色2 h后,显示出基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)约72×103和MMP-9约92×103为位于蓝色背景上的白色透亮带,扫描仪扫描图片备用。
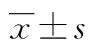
2 结 果
2.1 二甲双胍抑制骨肉瘤MG63细胞体外的迁移和侵袭能力 当用二甲双胍10 mmol/L处理MG63细胞48 h后细胞的迁移和侵袭能力明显减弱(图1),迁移从(171.70±6.60)个/视野减少到(50.30±4.30)个/视野,侵袭从(159.30±3.50)个/视野减少到(46.00±4.40)个/视野,处理前、后比较差异有统计学意义(P<0.05),见图2。
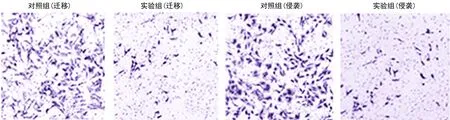
图1 Transwell迁移与侵袭实验结果(×200)
a:P<0.01,与对照组相比。
图2 二甲双胍抑制MG63细胞的迁移和侵袭能力比较
2.2 二甲双胍抑制MMP2和MMP-9的酶活性 对照组细胞的上清液均可降解明胶,表现出72×103和92×103位置的透明条带;而实验组的细胞上清液降解明胶的能力显着下降,表现为明胶上的消化条带减弱(图3),结果提示二甲双胍可以降低MMP-2和MMP-9的酶活性。
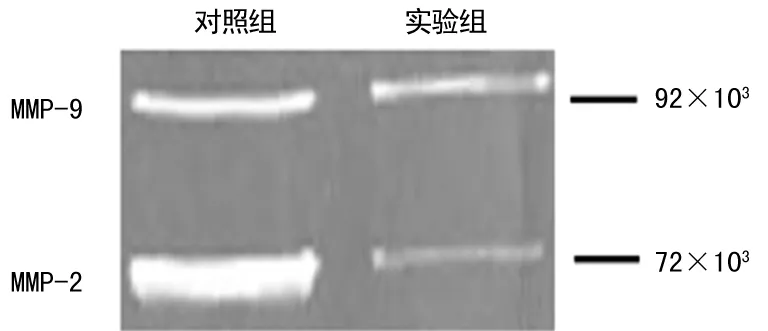
图3 二甲双胍抑制MMP-2和MMP-9的酶活性
2.3 二甲双胍抑制MG63细胞中Ezrin的表达 二甲双胍可显着降低MG63细胞中Ezrin基因的mRNA表达,从(100.00±5.20)%降到(30.20±1.70)%(图4A)。Western blot结果亦显示,10 mmol/L二甲双胍处理细胞48 h可明显下调Ezrin蛋白的表达,见图4B。
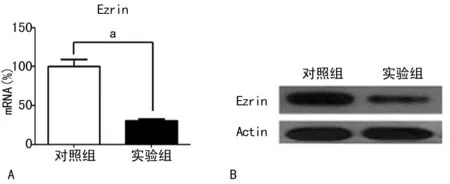
A:Ezrin的mRNA水平,a:P<0.01,与对照组相比;B:Ezrin蛋白水平。
图4 二甲双胍下调Ezrin的mRNA和蛋白水平
2.4 二甲双胍抑制骨肉瘤细胞的迁移和侵袭依赖于Ezrin的下调 侵袭实验结果显示,上调Ezrin可使MG63细胞的迁移和侵袭能力均明显增强,迁移从(175.00±8.70)个/视野增加到(300.00±5.80)个/视野,侵袭从(153.70±3.50)个/视野增加到(290.00±5.20)个/视野。而上调Ezrin还可降低二甲双胍对MG63细胞迁移和侵袭的抑制作用,高表达Ezrin后,迁移从(50.00±9.80)个/视野恢复到(99.30±5.80)个/视野,侵袭从(43.70±3.00)个/视野恢复到(90.30±6.10)个/视野,结果均有统计学意义(P<0.01),见图5、6。

图5 Transwell迁移与侵袭实验结果(×200)
2.5 二甲双胍通过下调Ezrin减弱MAPK/Erk信号通路 二甲双胍能下调MG-63细胞中p-Erk的蛋白水平,且不影响Erk的总蛋白水平,但p-Erk的降低可因过表达Ezrin而有所减少,却不会因过表达vector而有所变化(图7A)。而经二甲双胍处理MG-63细胞后Akt的磷酸化水平和总蛋白水平均未发生明显的改变(图7B)。
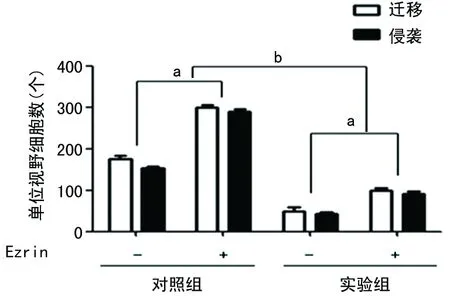
a:P<0.01,与同组未加Ezrin比较;b:P<0.01,与对照组比较。
图6 两组骨肉瘤细胞的迁移和侵袭能力比较
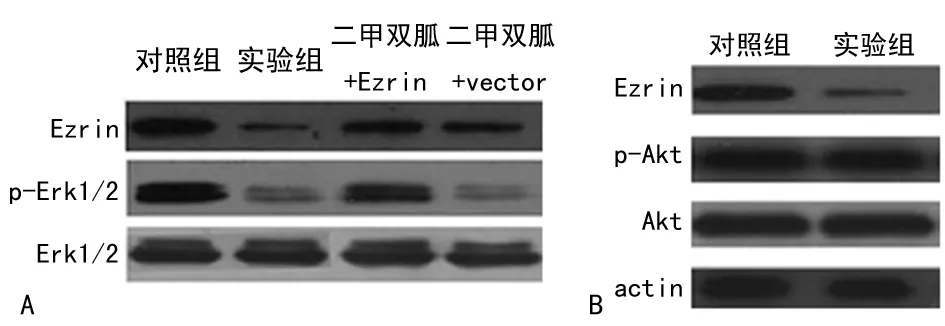
A:二甲双胍对MAPK/Erk信号通路的影响及过表达Ezrin对此信号通路的影响;B:二甲双胍对Akt/mTOR信号通路的影响。
图7 二甲双胍通过下调Ezrin减弱MAPK/Erk信号通路
3 讨 论
骨肉瘤常见于儿童和青少年,具有早期远处转移和高度局部复发倾向。尽管近年来在外科手术以及新辅助化疗上取得了很大进展,但病死率仍很高,其主要原因之一是骨肉瘤易复发转移[14-15]。目前临床治疗骨肉瘤的药物主要是化疗药物,如大剂量甲氨蝶呤、多柔比星、顺铂和异环磷酰胺等,多毒副作用大且易产生耐药性[3-4,16]。因此,寻找一种新的安全、有效的药物对提高骨肉瘤患者生存具有非常重要的意义。
二甲双胍是一种临床上常用的降血糖药物,近年来人们发现其对多种恶性肿瘤的生长具有抑制作用,可能成为治疗肿瘤的辅助药物,但其作用机制尚不完全清楚[5-7]。本研究首次发现二甲双胍对骨肉瘤细胞的迁移和侵袭具有抑制作用,并探讨了它的作用机制。Transwell小室实验结果表明二甲双胍处理骨肉瘤MG63细胞后细胞的穿膜能力降低,迁移和侵袭能力减弱。MMP-2和MMP-9的活性是与肿瘤侵袭转移能力密切相关的指标,明胶酶谱实验结果提示二甲双胍降低了MMP-2和MMP-9的酶活性,即骨肉瘤细胞降解细胞外基质的过程受到了抑制,骨肉瘤的侵袭转移能力减弱。已知Ezrin蛋白在多种人类肿瘤的转移中发挥了重要作用[8-11]。Folio等[17]研究表明,Ezrin蛋白是在一项骨肉瘤配对分析研究中鉴定出来的与骨发病相关的16种蛋白中的一种。在本研究中发现二甲双胍可以下调Ezrin的表达,并且高表达Ezrin可以降低二甲双胍对骨肉瘤细胞的迁移侵袭抑制,这很可能是因为二甲双胍通过下调Ezrin的表达从而抑制骨肉瘤细胞的迁移和侵袭。此外,还发现二甲双胍可以通过抑制Ezrin表达间接下调MAPK/Erk信号通路,导致骨肉瘤细胞的迁移和侵袭受到抑制。虽然有研究认为Ezrin蛋白能够调节Akt信号[18],但本研究发现二甲双胍处理骨肉瘤细胞后Akt通路的活化没有发生明显的改变,这与以前对胰腺癌细胞的研究相一致[19]。因此,本研究认为二甲双胍抑制骨肉瘤细胞的迁移和侵袭可能是通过下调Ezrin和MAPK/Erk信号通路而实现。作为一种肿瘤抑制药物,二甲双胍抑制骨肉瘤细胞的迁移和侵袭能力是通过下调Ezrin的表达,继而抑制MAPK/Erk信号通路的激活,即通过二甲双胍-Ezrin-Erk轴。
二甲双胍抑制骨肉瘤细胞的迁移和侵袭能力为骨肉瘤的治疗提供了一个新策略,也为增加骨肉瘤的化疗敏感性提供了一个新方法。二甲双胍通过下调Ezrin的表达从而抑制骨肉瘤细胞的迁移和侵袭,也提示了Ezrin作为骨肉瘤潜在治疗靶点的可能性。
综上所述,本研究的完成为二甲双胍用于临床治疗骨肉瘤患者奠定了理论基础,提供了临床转化方面的有力依据,对于获得新的骨肉瘤治疗靶点、克服骨肉瘤临床药物耐受也具有重要意义。目前骨肉瘤动物模型中二甲双胍的抗肿瘤作用尚不清楚,二甲双胍的抗骨肉瘤作用是否还有其他的分子机制参与也尚不明确,有待进一步深入探讨研究。
[1]Link MP,Goorin AM,Miser AW,et al.The effect of adjuvant chemotherapy on relapse-free survival in patients with osteosarcoma of the extremity[J].N Engl J Med,1986,314(25):1600-1606.
[2]Meyers PA,Heller G,Healey J,et al.Chemotherapy for nonmetastatic osteogenic sarcoma:the Memorial Sloan-Kettering experience[J].J Clin Oncol,1992,10(1):5-15.
[3]杨英年.骨肉瘤治疗进展[J].中国医药科学,2014,4(6):49-52.
[4]王威,毕文志.骨肉瘤治疗现状与展望[J].解放军医学院学报,2013,34(2):198-200.
[5]Deng XS,Wang S,Deng A,et al.Metformin targets Stat3 to inhibit cell growth and induce apoptosis in triple-negative breast cancers[J].Cell Cycle,2012,11(2):367-376.
[6]Bao B,Wang Z,Ali S,et al.Metformin inhibits cell proliferation,migration and invasion by attenuating CSC function mediated by deregulating miRNAs in pancreatic cancer cells[J].Cancer Prev Res (Phila),2012,5(3):355-364.
[7]Tsenq CH.Diabetes,metformin use,and colon cancer:a population-based cohort study in Taiwan[J].Eur J Endocrinol,2012,167(3):409-416.
[8]Ghaffari A,Hoskin V,Szeto A,et al.A novel role for ezrin in breast cancer angio/lymphangiogenesis[J].Breast Cancer Res,2014,16(5):438-443.
[9]Chen MJ,Gao XJ,Xu LN,et al.Ezrin is required for epithelial-mesenchymal transition induced by TGF-β1 in A549 cells[J].Int J Oncol,2014,45(4):1515-1522.
[10]LoVascoVR,LeopizziM,PuggioniC,et al.Ezrin silencing remodulates the expression of Phosphoinositide-specific Phospholipase C enzymes in human osteosarcoma cell lines[J].J Cell Commun Signal,2014,8(3):219-229.
[11]Mao J,Zhang M,Zhong M,et al.MicroRNA-204,a direct negative regulator of ezrin gene expression,inhibits glioma cell migration and invasion[J].Mol Cell Biochem,2014,396(1/2):117-128.
[12]Cerezo M,Tichet M,Abbe P,et al.Metformin blocks melanoma invasion and metastasis development in AMPK/p53-dependent manner[J],Mol Cancer Ther,2013,12(8):1605-1615.
[13] Wu B,Li S,Sheng L,et al.Metformin inhibits the development and metastasis of ovarian cancer[J].Oncol Rep,2012,28(3):903-908.
[14] Whelan J,McTieman A,Cooper N,et al.Incidence and survival of malignant bone sarcomas in England 1979-2007[J].Int J Cancer,2012,131(4):508-517.
[15]Wu PK,Chen WM,Chen CF,et al.Primary osteogenic sarcoma with pulmonary metastasis:clinical results and prognostic factors in 91 patients[J].Jpn J Clin Oncol,2009,39(8):514-522.
[16]Petrilli AS,de Camargo B,Filho VO,et al.Results of the Brazilian Osteosarcoma Treatment Group Studies Ⅲ and Ⅳ:prognostic factors and impact on survival[J].J Clin Oncol,2006,24(7):1161-1168.
[17]Folio C,Mora MI,Zalacain M,et al.Proteomic analysis of chemonaive pediatric osteosarcomas and corresponding normal bone reveals multiple altered molecular targets[J].J Proteome Res,2009,8(8):3882-3888.
[18]Khanna C,Wan X,Bose S,et al.The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis[J].Nat Med,2004,10(2):182-186.
[19]Meng Y,Lu Z,Yu S,et al.Ezrin promotes invasion and metasisi of pancreatic cancer cell[J].J Transl Med,2010,23(8):61-75.
Inhibition effect of metformin on migration and invasion in osteosarcoma MG63 cell line*
SuXiaotao1,HeJun1,OuJun1,ShenYingying2△
(1.DepartmentofSpinalSurgery,AffiliatedNanhuaHospital;2.InstituteofClinicalMedicine,FirstAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
Objective To observe the effect of metformin on the migration and invasion of osteosarcoma MG63 cells.Methods Osteosarcoma MG63 cells as the research objects were treated with metformin and then the transwell chamber assay was used to detect the change of cell migration and invasion ability.The gelatin zymography was used to detect the activity of MMP-2 and MMP-9.Real-time PCR was used to measure the expression level of Ezrin mRNA level.Western blot was used to detect the expression level of Ezrin protein;Ezrin plasmid was transfected into cells by lipofectamine 2000 and its influence on metformin-induced cell migration and invasion inhibition and the downstream signaling pathways was observed.Results Metformin could significantly inhibit the migration and invasion of MG63 cells and decreased the enzymatic activity of MMP-2 and MMP-9.The mRNA and protein levels of Ezrin in MG63 cells were decreased remarkably after 48 h medication treatment.Moreover,up-regulating Ezrin could attenuate metformin-induced osteosarcoma cell migration and invasion inhibition and metformin-induced MAPK/Erk signaling pathway inhibition.Conclusion Metformin could inhibit the migration and invasion ability of MG63 cells by possibly down-regulating the Ezrin and MAPK/Erk signaling pathway.
metformin;osteosarcoma;cell movement;neoplasm invasiveness;Ezrin;MAPK/Erk signaling pathway
10.3969/j.issn.1671-8348.2016.05.008
国家自然科学基金资助项目(81502276)。 作者简介:苏小桃(1972-),副主任医师,副教授,硕士研究生,主要从事骨肿瘤与脊柱相关疾病诊治的研究。△
,Tel:18273435520;E-mail:shenyingying1113@126.com。
R73-37
A
1671-8348(2016)05-0602-04
2015-06-26
2015-09-06)



