孙治霞,索红亮,王丽辉
(河南省中医院/河南中医药大学第二附属医院重症医学科,郑州 450002)
急性心肌梗死是心血管疾病死亡的重要原因之一,其发病率和病死率呈逐年上升趋势[1]。研究表明,急性心肌梗死的发病机制与遗传、氧化应激、炎症等心血管疾病危险因素密切相关,多种细胞信号通路在心肌梗死期间和之后发生的病理变化中起重要作用[2]。核因子-κB(NF-κB)作为重要的细胞转录因子,是炎性反应和氧化应激反应的关键环节。C-Jun N-末端激酶(JNK)信号通路作为丝裂原活化蛋白激酶(MAPKs)信号转导通路之一,参与多种心血管疾病的发病机制。研究证实,从植物中提取的天然黄酮类化合物对急性心肌梗死大鼠心肌损伤具有保护作用[3]。榅桲(Cydonia Oblonga Mill)是蔷薇科榅桲属灌木植物,富含鞣质、有机酸、黄酮等多种药用化学成分,其中榅桲提取物总黄酮能抗炎、抗氧化、抗血栓,同时还能改善自发性高血压大鼠的心脏结构和功能[4-5]。但是,榅桲总黄酮对急性心肌梗死大鼠的保护作用及其相关机制尚不明确。本研究通过结扎左冠状动脉前降支构建心肌梗死大鼠模型,观察榅桲总黄酮对心肌梗死大鼠的心肌保护作用,并初步探讨可能的作用机制,以期为其临床应用提供一定的实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 无特殊病原体(SPF)级成年雄性SD大鼠购自北京生命科学研究所,体质量280~320 g,7~8周龄,合格证号:YXK(京)2015-0002。所有实验程序均经本院伦理委员会批准,并按照国家有关规定进行。
1.1.2原材料及药品 榅桲叶购自张仲景大药房,经河南食品药品检验所检验为真品。阿托伐他汀钙片(ACT)购自北京嘉林药业股份有限公司,国药准字H20093819,批号201502。
1.1.3主要试剂及仪器设备 水合氯醛购自美国Sigma公司,批号47335;TUNEL细胞凋亡检测试剂盒购自英国Abcam公司,批号ab66108;DAPI购自英国Abcam 公司,批号104139;TRIzol购自美国Sigma-Aldrich公司,批号T9424;蛋白浓度测定试剂盒购自美国Solarbio公司,批号PC0030;RIPA裂解液购自碧云天生物技术研究所,批号P0013;大鼠p-细胞外信号调节激酶(ERK,批号sab1306604)、p-JNK(批号sab1305600)、p-p38 MAPK(批号sab4301534)、NF-κB p68(批号HPA023128)、β-actin(批号A1978)、Bax(批号sab2108447)、Bcl-2(批号srp0186)抗体购自Sigma-Aldrich公司;肿瘤坏死因子(TNF)-α采用酶联免疫吸附试验(ELISA)试剂盒(批号hz-0011c),单核细胞趋化蛋白-1(MCP-1)采用 ELISA试剂盒(批号h-0253c),购自上海沪震实业有限公司。倒置显微镜CKX41购自日本Olympus公司;离心机购自无锡瑞江离心机厂;凝胶成像系统购自美国UVP公司;核酸蛋白定量仪K5500购自北京凯奥公司;电泳仪DYCZ-24DN购自北京六一仪器厂;Powerwave XS酶标仪购自中国基因有限公司;酶联免疫检测仪购自南京德铁实验设备有限公司;CM3050S冷冻切片机购自美国Buffalo Grove公司。
1.2方法
1.2.1榅桲总黄酮的制备 榅桲叶洗净干燥后粉碎过筛,经石油醚脱脂后真空干燥。将干燥粉末经10倍量75%乙醇超声提取3次,真空干燥。加水溶解过滤后,洗脱3次,浓缩、干燥后得到总黄酮精制品,测定榅桲总黄酮纯度为66.75%。
1.2.2急性心肌梗死大鼠模型制备 根据参考文献[6]建立急性心肌梗死模型。腹膜内注射戊巴比妥钠(40~60 mg/kg)使大鼠充分麻醉后,行左胸廓切开术。用6-0无菌丝线距左冠状动脉前降支根部1~2 mm结扎。当结扎部位下面的左心室颜色由红色变为白色时,证实结扎成功。假手术组(sham,n=20)不进行冠状动脉结扎。
1.2.3动物分组及给药 将冠状动脉结扎后存活大鼠80只随机分成4组,每组20只:模型组、阿托伐他汀组(ACT组)、榅桲总黄酮低剂量组(L-COMF)和榅桲总黄酮高剂量组(H-COMF)。术后3 d开始,根据参考文献[7-8]对各组大鼠进行药物处理。sham组和模型组灌胃给蒸馏水10 μL/g;ACT组:灌胃给予阿托伐他汀8 mg/kg,给药剂量按照人与大鼠体表面积法折算等效剂量;L-COMF组:灌胃给予榅桲总黄酮80 μg/g;H-COMF组:灌胃给予榅桲总黄酮160 μg/g。每组大鼠每日灌胃给药1次,灌胃容积为10 μL/g,连续给药3周。
1.2.4氯化三苯基四氮唑(TTC)染色 给药3周后,各组分别取10只大鼠,取出心脏,冷生理盐水洗涤后置于-20 ℃过夜。将心脏置于1%氯化三苯硝基四氮唑红(TTC)中孵育10 min后,经4%多聚甲醛固定24 h,选取周长最长切片使用Image J进行扫描并计算梗死区域面积和缺血危险区面积(AAR),心肌梗死面积=梗死区面积/缺血危险区面积×100%。
1.2.5血流动力学检测 给药3周后,每组各取10只大鼠,经右颈总动脉将导管插入左心室,记录平均动脉压(MAP)、左心室收缩压(LVSP)、左心室舒张末压(LVEDP)、左心室内压上长最大速率(LV+dp/dtmax)、左心室内压下降最大速率(LV-dp/dtmax)。
1.2.6标本采集 血流动力学检测完毕后,腹主动脉取血3 mL并迅速取出心脏。将血液置于乙二胺四乙酸(EDTA)管中,轻轻搅动试管并将血液离心30 min后,将血清标本置于-20 ℃保存,待测。心脏经生理盐水洗涤后,剔除非心肌组织部分吸去水分,一部分取心室周长最大心肌片段,置于10%甲醛缓冲液中固定24 h后,经石蜡包埋待测;一部分取心肌梗死周围组织,置于-80 ℃保存待测。
1.2.7组织形态学检测 取石蜡包埋大鼠心肌组织,经切片(5 μm)、烘烤后,经二甲苯脱蜡、梯度乙醇水合,洗涤后,经苏木精-伊红(HE)染色,中性树胶封片后,于显微镜下观察。
1.2.8TUNEL法检测心肌细胞凋亡 使用冷冻切片机将冷冻心肌切片(7 μm),使用TUNEL染色试剂盒对切片进行染色,根据制造商说明书检测凋亡细胞。心肌细胞用Desmin抗体进行染色标记,细胞核用4′,6-二脒基-2-苯基吲哚(DAPI)染色。盖玻片包埋后,通过倒置激光扫描共聚焦显微镜于×100倍放大率下进行成像,使用Image J软件定量TUNEL阳性核的百分比。
1.2.9ELISA检测TNF-α、MCP-1水平 采用ELISA检测血清标本中TNF-α和MCP-1水平,所有操作均严格按照制造商说明书进行。
1.2.10Western blot分析 取冻存心肌梗死周围组织,提取总蛋白后,将蛋白质于15%聚丙烯酰胺凝胶上电泳分离并转移至聚偏二氟乙烯膜上。3%TBST封闭后,与p-ERK1/2、p-JNK、p-p38 MAPK、NF-κB p68、β-actin、Bax、Bcl-2的一抗孵育后,与辣根过氧化物酶(HRP)标记的二抗孵育,用增强型化学发光加检测系统进行检测。使用图像分析软件对条带进行量化。
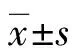
2 结 果
2.1榅桲总黄酮对心肌梗死大鼠发挥心肌保护作用 经TTC染色后,正常心肌组织呈蓝色,危险区呈砖红色,坏死区域呈灰白色。模型组大鼠心肌组织可观察到大片灰白色和砖红色区域,ACT组、L-COMF组、H-COMF组大鼠心肌组织中灰白色区域和砖红色区域面积有所降低。见图1。定量分析显示,与sham组[(18.65±2.91)%]相比,模型组大鼠心肌梗死面积[(35.82±4.68)%]显着升高(P<0.05)。与模型组相比,ACT组[(21.36±4.03)%]、L-COMF组[(26.42±3.22)%]、H-COMF组[(22.18±3.09)%]大鼠心肌梗死面积显着降低(P<0.05)。
图1 心肌梗死大鼠心肌组织TTC染色
2.2榅桲总黄酮对心肌梗死大鼠心功能的影响 与sham组相比,模型组大鼠MAP、LVSP显着降低,LVEDP显着升高,同时LV+dp/dtmax显着降低,LV-dp/dtmax显着升高(P<0.05)。与模型组相比,ACT组、L-COMF组、H-COMF组大鼠MAP、LVSP显着升高,LVEDP显着降低,同时LV+dp/dtmax显着升高,LV-dp/dtmax显着降低(P<0.05)。见表1。
表1 各组大鼠血流动力学变化
a:P<0.05,与sham组相比;b:P<0.05,与模型组相比
2.3组织形态学检测 HE染色显示,sham组大鼠观察到正常心肌组织结构,心肌细胞形态完整,肌原纤维排列整齐。模型组大鼠观察到心肌细胞破裂、变性、坏死,心肌纤维排列紊乱、断裂,并出现炎性细胞浸润,心肌组织损伤严重。ACT组、L-COMF组、H-COMF组大鼠心肌细胞破裂减少,局部散在心肌细胞坏死,肌原纤维排列较整齐,心肌损伤程度减轻。见图2。
2.4榅桲总黄酮对心肌细胞凋亡的影响 Desmin抗体、TUNEL和DAPI染色共定位证实大多数凋亡细胞为心肌细胞。sham组大鼠TUNEL阳性细胞极少,而模型组大鼠心肌组织中阳性细胞明显增加,ACT组、L-COMF组、H-COMF组大鼠心肌组织中TUNEL阳性细胞明显减少(图3)。定量分析发现,与sham组(每100个细胞0.85±0.06)相比,模型组大鼠TUNEL阳性细胞数(每100个细胞2.11±0.18)显着增加(P<0.05)。与模型组相比,ACT组(每100个细胞0.89±0.06)、L-COMF组(每100个细胞1.05±0.08)、H-COMF组(每100个细胞0.91±0.14)大鼠阳性细胞数显着降低(P<0.05)。
2.5榅桲总黄酮对血清TNF-α和MCP-1水平的影响 与sham组相比,模型组大鼠TNF-α和MCP-1水平显着升高(P<0.05)。与模型组相比,ACT组、L-COMF组、H-COMF组大鼠TNF-α和MCP-1水平显着降低(P<0.05)。见表2。
2.6榅桲总黄酮对心肌组织中NF-κB表达的影响 与sham组(1.01±0.01)相比,模型组大鼠NF-κB蛋白表达(3.26±0.08)显着升高(P<0.05)。与模型组相比,ACT组(1.21±0.05)、L-COMF组(2.96±0.06)、H-COMF组(1.25±0.06)大鼠NF-κB蛋白表达显着降低(P<0.05)。见图4。
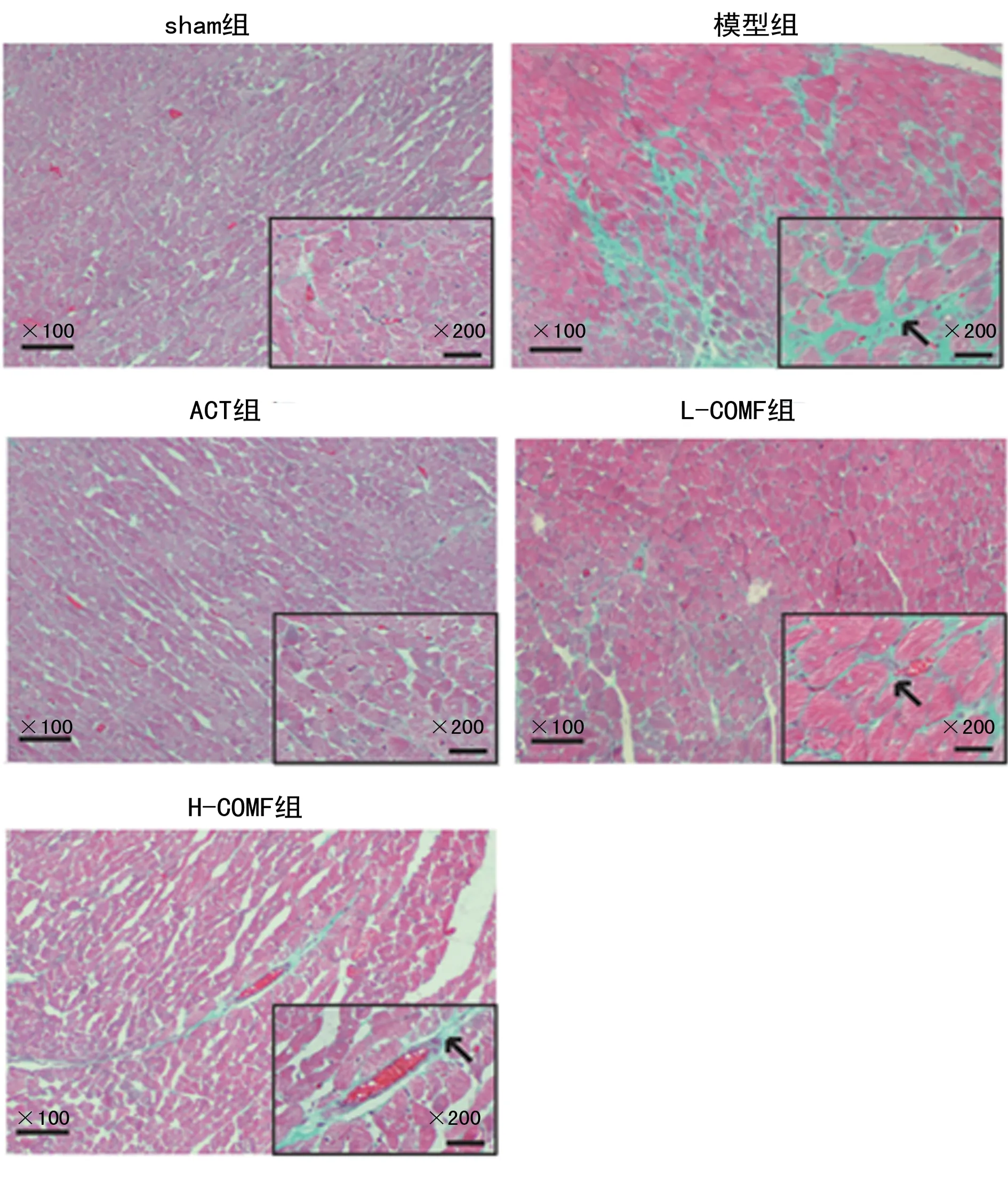
图2 各组大鼠心肌组织HE染色结果
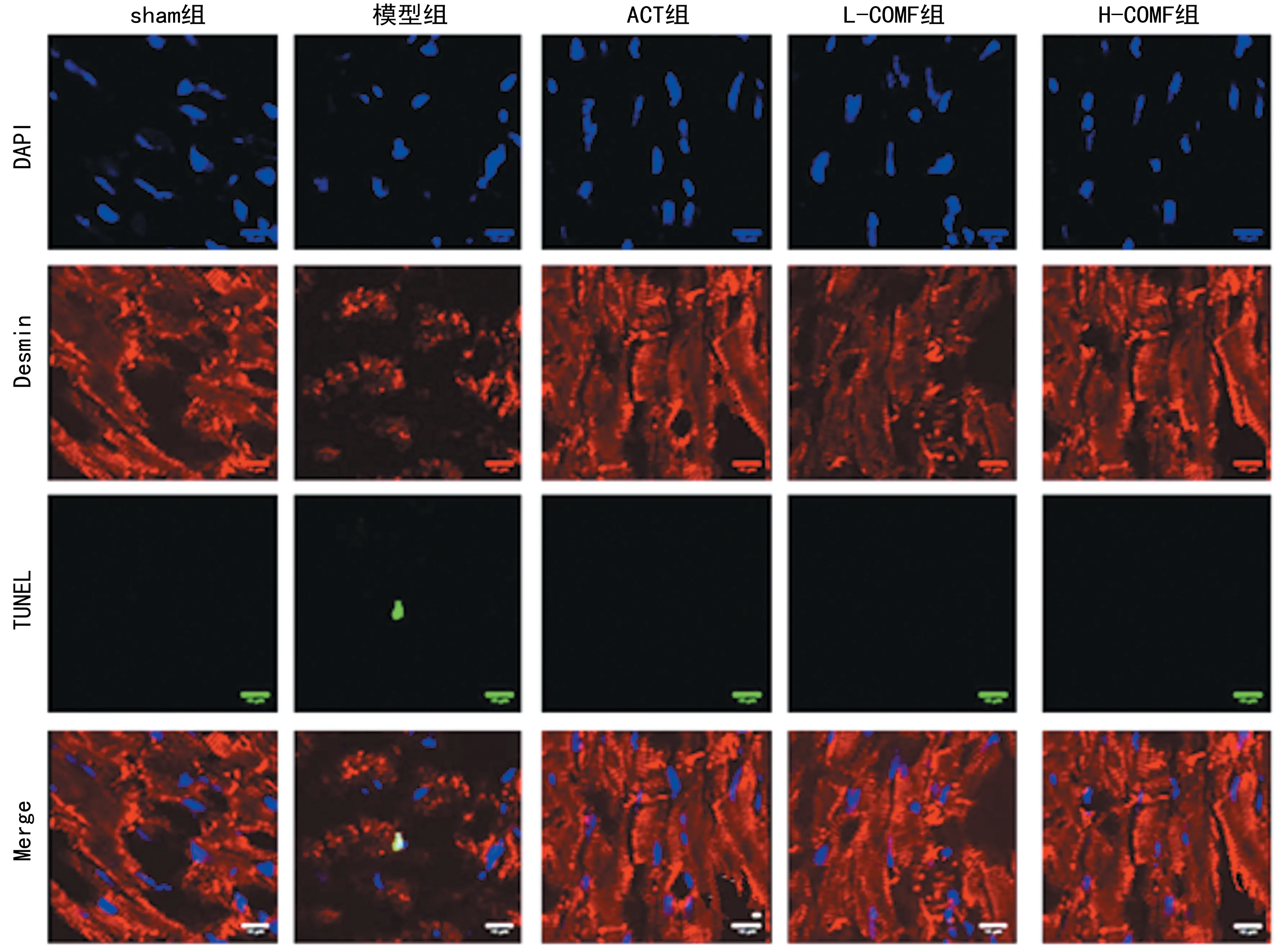
图3 各组大鼠心肌细胞凋亡的变化(×100)
表2 各组大鼠炎症相关因子MCP-1和TNF-α水平比较
a:P<0.05,与sham组相比;b:P<0.05,与模型组相比
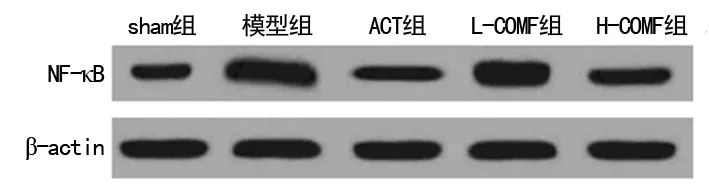
图4Westernblot分析NF-κB蛋白表达
2.7榅桲总黄酮对心肌组织中MAPKs信号通路的影响 与sham组相比,模型组大鼠p-ERK1/2、p-JNK、p-p38 MAPK蛋白表达水平均显着增加(P<0.05)。与模型组相比,ACT组、L-COMF组、和H-COMF组大鼠p-JNK蛋白表达显着降低(P<0.05)。而L-COMF组和H-COMF组大鼠心肌组织中p-ERK1/2、p-p38 MAPK蛋白表达与模型组相比差异均无统计学意义(P>0.05),且明显高于sham组(P<0.05)。见图5、表3。
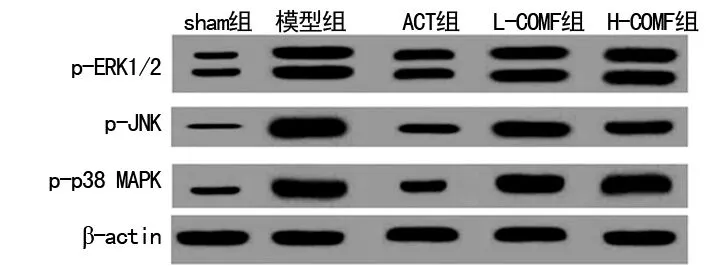
图5 Western blot分析MAPKs信号通路相关蛋白表达
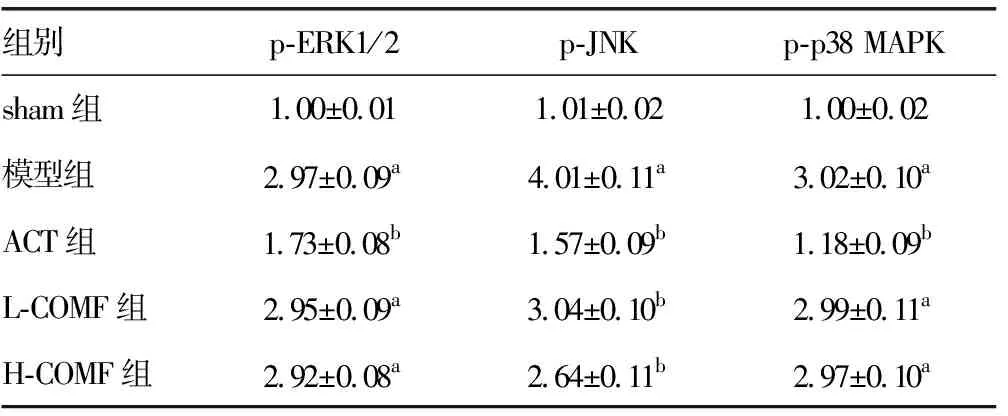
组别p-ERK1/2p-JNKp-p38 MAPKsham组1.00±0.011.01±0.021.00±0.02模型组2.97±0.09a4.01±0.11a3.02±0.10aACT组1.73±0.08b1.57±0.09b1.18±0.09bL-COMF组2.95±0.09a3.04±0.10b2.99±0.11aH-COMF组2.92±0.08a2.64±0.11b2.97±0.10a
a:P<0.05,与sham组相比;b:P<0.05,与模型组相比
2.8榅桲总黄酮对心肌组织Bax、Bcl-2表达的影响 与sham组相比,模型组大鼠Bax蛋白表达显着增加,Bcl-2蛋白表达显着降低(P<0.05)。与模型组相比,ACT组、L-COMF组、H-COMF组大鼠Bax蛋白表达显着降低,Bcl-2蛋白表达显着增加(P<0.05)。见图6、表4。
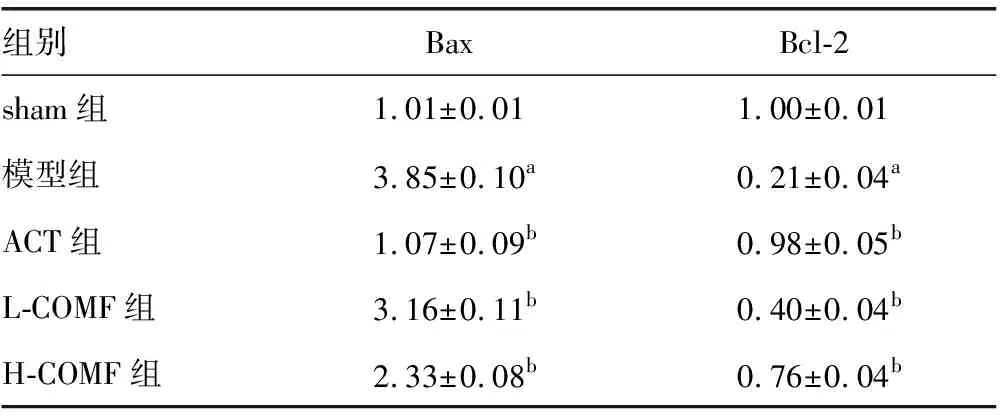
组别BaxBcl-2sham组 1.01±0.011.00±0.01模型组3.85±0.10a0.21±0.04aACT组1.07±0.09b0.98±0.05bL-COMF组3.16±0.11b0.40±0.04bH-COMF组2.33±0.08b0.76±0.04b
a:P<0.05,与sham组相比;b:P<0.05,与模型组相比
3 讨 论
本研究通过结扎左冠状动脉前降支构建急性心肌梗死模型,并用组织学检测观察到心肌梗死大鼠心肌细胞破裂、变性、坏死,心肌纤维排列紊乱、断裂,出现炎性细胞浸润。同时,TUNEL检测观察到心肌细胞凋亡,提示建模成功。心肌缺血过程中心脏炎性反应的直接后果是引起心肌细胞凋亡,心肌细胞凋亡能够导致心功能受损,是引起左心室重构和心力衰竭的重要因素之一[9]。本研究发现模型组大鼠MAP、LVSP显着降低,LVEDP显着升高,同时LV+dp/dtmax显着降低,LV-dp/dtmax显着升高,提示心肌梗死大鼠心肌舒缩功能受损和血流动力学异常。心肌梗死大鼠心肌细胞凋亡、坏死,引起梗死区严重炎性反应,心肌炎性反应进一步加剧心肌细胞凋亡,最终引起心功能失调。同时本研究还发现,榅桲总黄酮治疗能够降低心肌梗死大鼠危险区和坏死心肌面积,对心肌梗死大鼠有心肌保护作用,可能是由于榅桲总黄酮能够缓解心脏过度收缩并降低心室舒张压,改善心脏收缩功能,恢复缺血引起的心脏结构改变,从而改善心肌梗死大鼠心功能。 上述结果均表明榅桲总黄酮能够显着改善心肌梗死大鼠炎性反应、心肌细胞凋亡和心功能,从而发挥心肌损伤保护作用,然而具体作用机制尚不明确。
MCP-1作为主要的趋化因子,能够募集和活化心肌组织中的炎性细胞到达炎性反应部位,从而引发和维持炎性反应,在动脉粥样硬化、心肌梗死、心室重构等心血管疾病中起重要作用[10-11]。TNF-α作为一种重要的炎性因子,在衰竭心肌中大量表达,与临床血流动力学严重程度密切相关。研究表明,心力衰竭组织中TNF-α高表达能够引起心肌细胞凋亡、心肌肥大和心室重构[12]。而NF-κB对炎性因子和趋化因子起重要调控作用,NF-κB是真核生物中广泛存在的特异性DNA结合蛋白,具有多向转录调控作用,在调控心肌缺血引起的炎性反应中起重要作用[13]。炎性因子能够激活NF-κB,使NF-κB从细胞质中快速转移至细胞核,同时NF-κB的激活能够进一步诱导包括炎性因子和趋化因子在内的多种靶基因表达,导致细胞凋亡和组织损伤,从而参与包括冠心病和急性心肌梗死在内的多种病理生理过程[14-15]。本研究发现,模型组大鼠TNF-α和MCP-1水平均显着升高,同时NF-κB蛋白表达显着升高,表明心肌梗死后心肌损伤与机体炎性反应有关;经榅桲总黄酮治疗后,TNF-α和MCP-1水平显着降低,同时心肌组织中NF-κB蛋白表达显着降低。结合过往研究推测,榅桲总黄酮可能通过降低心肌梗死后炎症相关因子的表达,从而抑制NF-κB活化,而NF-κB活性的抑制又进一步降低炎性因子和趋化因子的表达。
MAPKs信号途径作为细胞内重要的信号转导通路,能够被炎性介质激活,而激活的MAPKs能够连接并激活不同的目标激酶,参与多种级联反应调节,从而参与调控多种生理和病理过程。MAPK信号转导途径可作用于下游底物NF-κB,促进促炎基因的转录。已证实,在哺乳类动物细胞中存在3条并行的MAPK信号通路:p38 MAPK、细胞外信号调节激酶(ERK)和JNK,MAPK上特定氨基酸序列磷酸化可将3条通路全部激活,且它们在调控细胞功能时不仅能独自发挥作用,而且能相互交错[16],且与多种心血管疾病均密切相关[17-18]。本研究发现,心肌梗死大鼠心肌组织中ERK1/2、JNK、p38 MAPK磷酸化水平升高,提示MAPKs信号通路活化。经榅桲总黄酮治疗后,心肌梗死大鼠心肌组织中JNK磷酸化水平显着,而ERK1/2、p38 MAPK磷酸化水平未发生明显变化,提示榅桲总黄酮能够阻止心肌梗死引起的JNK信号通路活化,而对ERK1/2、p38 MAPK信号通路无明显影响。研究发现,JNK能够被TNF-α等炎性细胞因子激活,参与调控心肌细胞凋亡和炎性反应,在心肌损伤中发挥重要作用[19]。该研究还显示,心肌梗死大鼠JNK的活化能够激活NF-κB,使其从细胞质易位至细胞核,从而引起炎性损伤和细胞凋亡。结合过往研究推测,榅桲总黄酮能够通过调控JNK信号通路,降低炎性反应和心肌细胞凋亡,改善心肌梗死大鼠心肌功能。
还有研究证实,心肌梗死后心肌细胞凋亡能够导致左心室重构,是引起心力衰竭发生的重要机制,而持续而强烈的炎性反应是引起心肌细胞凋亡的重要原因[20]。JNK的激活通过调控凋亡相关Bcl-2家族蛋白活性,从而诱导细胞凋亡[21]。Bcl-2和Bax是Bcl-2家族最重要的细胞凋亡相关基因,二者结合通过形成异构二聚体或共同调节胞内Ca2+浓度从而发挥抗凋亡作用[22-23]。本研究发现,模型组大鼠Bax蛋白表达显着增加,Bcl-2蛋白表达显着降低,证实心肌梗死后心肌细胞凋亡,而经榅桲总黄酮治疗后,Bax蛋白表达显着降低,Bcl-2蛋白表达显着增加,提示榅桲总黄酮能够通过调控Bcl-2蛋白家族,降低心肌梗死引起的心肌细胞凋亡,发挥心肌保护作用。
综上所述,榅桲总黄酮能够对心肌梗死大鼠心肌损伤发挥保护作用,这可能是通过抑制JNK和NF-κB信号通路,从而下调心肌梗死引起的炎症损伤和细胞凋亡来实现的。然而心肌梗死引起心肌损伤的过程极其复杂,所涉及信号通路及蛋白还需进行深入探究,以期为疾病的治疗提供更充分的理论依据。



