孟志鹏,刘 静,胡四平,童 飞,龚浩杰
(1.浙江省湖州市中心医院麻醉科 313000;2.浙江省湖州市妇幼保健院麻醉科 313000)
脓毒症可导致全身多器官损伤,而肺脏因其独特的结构与功能,成为最早、最易受累且病情最重的器官之一[1],常表现为高病死率的急性肺损伤(ALI)/急性呼吸窘迫综合征(ARDS)等危重症,炎性反应失衡是ALI的根本原因之一,尽管学者们对ALI的防治及肺保护研究已取得巨大进展,但其病死率仍高达30%~40%[2],临床亟须寻求脓毒症肺损伤的预防方案和治疗药物。右美托咪定(DEX)是一种高选择性α2肾上腺素能受体激动剂,研究证实DEX因具有抗氧化、抗炎等独特作用能减轻大鼠急性肺损伤[3],特别是在脓毒症患者ALI呼吸机支持治疗时能减轻呼吸机相关性肺损伤或肾缺血再灌注肺损伤[4-5]。近年来,随着对祖国医学的重视及对ALI/ARDS的不断研究,有学者发现我国自主研发的传统医药盐酸戊乙奎醚(PHC)因作用于支气管平滑肌和肺组织M1、M3受体,使支气管平滑肌痉挛得到解除,肺顺应性增加,肺通气得到改善,同时PHC是一种高选择性的新型抗胆碱药物[6],能够稳定各种细胞器的膜结构,降低毛细血管通透性,缓解急性微循环功能障碍,还能抑制呼吸道腺体分泌,降低分泌物对肺部的感染,从而减轻肺组织损伤[7],也有研究表明PHC抑制Toll样受体-4表达,抑制大量炎性因子在肺内聚集和浸润,减轻肺部炎性反应,发挥一定的肺保护作用[8]。本研究通过比较PHC与右美托咪定对内毒素脂多糖(LPS)致大鼠ALI的保护性作用,探讨PHC临床治疗ALI的理论依据。
1 材料与方法
1.1实验动物 成年雄性健康清洁级SD大鼠40只,8周龄,体质量250~300g,由浙江省医学科学院动物实验中心提供[动物使用许可证号:SYXK(浙)2014-0001],分组分笼每笼3~4只,安静环境、室温22~24 ℃下适应性喂养1周,自由饮食、饮水,模拟昼夜交替12 h。
1.2方法
1.2.1模型制备与分组 术前大鼠自由饮水,禁食12 h。腹腔注射10%水合氯醛400 mg/kg麻醉后,仰卧位固定于操作台上称重,行右股静脉、右颈内动脉穿刺、置管。术中保留自主呼吸。按随机数字表法将大鼠分为4组,每组10只。(1)LPS模型组(LPS组):右股静脉注射LPS(Escherichia coli O111:B4,美国 Sigma公司)6 mg/kg;(2)DEX治疗组(L+D组):LPS作用30 min后2 min内右股静脉注射DEX 50 μg/kg(江苏恒瑞医药公司,批号:16060132),随后以5 μg·kg-1·h-1微泵泵入;(3)PHC治疗组(L+P组):LPS作用30 min后2 min内右股静脉注射PHC 1 mg/kg(成都力思特制药股份有限公司,批号:H20080606),随后以1 μg·kg-1·h-1微泵泵入。(4)0.9%生理盐水对照组(对照组):经右股静脉给予等量0.9%生理盐水。
1.2.2标本采集与标本检测 注射0.9%生理盐水或LPS 6 h后,右颈动脉采血2 mL后放血处死,血标本用酶联免疫吸附试验(ELISA)测定肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β及IL-6水平。取右肺上叶5 mm×5 mm组织,甲醛溶液固定48 h,石蜡包埋,切片(厚度约5 μm),苏木素-伊红(HE)染色,光镜下行肺组织病理学检查,并从中性粒细胞浸润、肺泡间隔增宽、肺泡腔内出血、肺泡腔渗出4个方面按严重程度行弥漫性肺泡损伤标准(DAD)评分:正常为0分,轻度为1分,中度为2分,重度为3分[9];取右肺中叶组织,滤纸吸尽表面水分及血液,称湿重(W),然后置80 ℃电热干燥箱内烘烤24 h左右,待质量恒定后称干重(D),计算肺组织湿/干重(W/D)比值。分离气管,夹闭右支气管,分3次用4 ℃ 0.9%生理盐水按20 mL/kg行左支气管肺泡灌洗,并回收左支气管肺泡灌洗液(BALF),离心后用酶联免疫吸附试验(ELISA)测定BALF的TNF-α、IL-6水平,用二喹啉甲酸(BCA)法测定BALF中总蛋白(TP)水平。
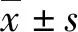
2 结 果
2.14组血清炎性因子水平比较 与对照组比较,LPS组、L+D组、L+P组炎性因子水平升高(P<0.05);与LPS组比较,两个治疗组TNF-α、IL-1β和IL-6水平明显下降(P<0.05);L+P组与L+D组TNF-α、IL-1β、IL-6水平比较,差异均无统计学意义(P>0.05),见表1。
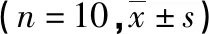
表1 各组血清炎性因子水平比较
*:P<0.05,与对照组比较;#:P<0.05,与LPS组比较
2.2光镜下观察肺组织病理学改变 光镜下,对照组中性粒细胞聚集、浸润少,肺组织结构无明显损伤(图1A);LPS组可见大量以中性粒细胞为主的炎性细胞聚集、浸润,肺泡结构紊乱,破坏严重,肺泡间隔水肿、增宽明显,肺泡腔大量渗出且伴有明显出血(图1B);L+D组、L+P组肺组织损伤程度较LPS组轻,病理学改变程度较LPS组轻,L+D组与L+P组比较无明显差异(图1C、D)。
2.34组肺组织DAD评分和W/D比值比较 与对照组比较,其余3组DAD评分及W/D比值均明显升高(P<0.05);与LPS组比较,两个治疗组DAD评分及W/D比值均明显下降(P<0.05);L+P组与L+D组DAD评分及W/D比值比较,差异均无统计学意义(P>0.05),见表2。
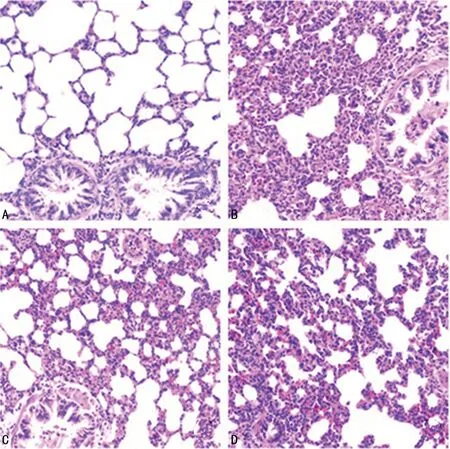
A:对照组;B:LPS组;C:L+D组;D:L+P组
图1各组肺组织病理学改变(HE染色,×200)
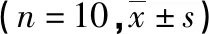
表2 各组DAD评分和肺组织W/D比值比较
*:P<0.05,与对照组比较;#:P<0.05,与LPS组比较
2.44组BALF中TNF-α、IL-6和TP水平比较 与对照组比较,其余3组BALF中TNF-α、IL-6和TP水平明显升高(P<0.05);与LPS组比较,两个治疗组TNF-α、IL-6和TP水平均下降(P<0.05);L+P组与L+D组BALF中TNF-α、IL-6和TP水平比较,差异均无统计学意义(P>0.05),见表3。
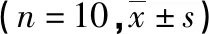
表3 各组BALF中TNF-α、IL-6和TP表达水平比较
*:P<0.05,与对照组比较;#:P<0.05,与LPS组比较
3 讨 论
通过实验,笔者发现静脉注射DEX、PHC对LPS导致的大鼠ALI有保护作用。DEX、PHC注射可以显着降低大鼠血清中炎性因子水平、BALF中炎性因子及TP水平,减轻由于LPS导致的肺部水肿损伤。DEX、PHC 可以通过抗炎对LPS导致的ALI起到早期保护作用。脓毒症是临床工作中常见的一种急危重症,常引起全身多器官损伤,其中肺损伤病情重,发生早,常表现为ALI或者ARDS,是导致患者病死率居高不下的主要原因[10]。革兰阴性菌细胞壁的主要成分是LPS,是引起脓毒症性ALI的重要物质,LPS水平与脓毒症性ALI密切相关,因此,本实验选择股静脉注射6 mg/kg LPS制备大鼠ALI模型[11]。笔者发现大鼠经LPS处理后,HE染色和光镜下显示出显着特征性肺组织病理学改变,包括大量中性粒细胞浸润、肺泡壁变薄、肺泡腔内液体渗出、出血,肺组织DAD评分升高、W/D比值显着升高,BALF中炎性细胞数量增多,TP水平明显升高等特征,表明制备大鼠ALI模型成功。
ALI的发病机制为肺部炎性反应,也是ALI的中心环节。肺组织内的炎性因子、趋化因子被激活后产生级联免疫反应。研究表明TNF-α、IL-6和IL-1β是ALI早期炎性反应中较早升高的炎性因子,也作为ALI时炎症介质的始动因素诱发多种炎性因子的表达,并在ALI的进展中起到了重要作用[12]。其中,TNF-α是应激反应中最早产生的促炎因子,在ALI发生、发展中起到核心作用[13]。IL-1β是由单核巨噬细胞产生的一种多功能促炎因子,大量聚集、浸润于ALI肺泡液中,诱导早期蛋白的合成,在ALI的发生、发展中起到促进作用;IL-6是由单核巨噬细胞、上皮细胞等多种细胞产生的炎性因子,与TNF-α协同作用于ALI的进程中,可比较准确地反映肺组织的炎性反应强度,其表达水平与ALI严重程度密切相关。其表达与ALI轻重程度一致[14]。因此,抑制炎性反应是减轻LPS致ALI的有效方法之一。
DEX是一种新型高选择性α2肾上腺素受体激动剂,因具有镇痛、镇静、催眠、不抑制呼吸等独特的优点被广泛应用于临床。张琳等[15]研究发现,脓毒症大鼠经DEX处理后炎性因子释放被抑制,炎性反应程度减轻,脓毒症大鼠的死亡率大大降低。随着研究的深入,发现DEX可以增加抗炎因子的表达,抑制中性粒细胞的浸润,对脑、心、肺、肾等重要脏器具有一定的保护作用,其中,DEX的肺保护作用逐渐得到临床研究者的重视[16]。
肺部组织中富含大量的M1、M3胆碱能受体,而PHC是一种新型抗胆碱药,选择性作用于M1、M3受体,减少腺体分泌,降低气道阻力,增加肺顺应性,解除支气管平滑肌和肺毛细血管痉挛,减轻肺水肿,改善肺功能。此外,PHC还能稳定细胞膜及溶酶体、线粒体等细胞器的膜结构,抑制 TNF-α、IL-6等促炎因子释放,减轻炎性反应[8]。
本实验中大鼠静脉注射LPS后,血清和BALF中上述炎性因子水平均有不同程度升高,出现明显的炎性反应。说明LPS打破了大鼠体内的促炎和抗炎动态平衡,炎性因子过度表达并向失控方向发展。TNF-α、IL-6和IL-1β大量生成和释放。给予DEX或PHC治疗后,血清和BALF中TNF-α、IL-6和IL-1β明显降低,表明二者的干预可以抑制脓毒症大鼠炎性因子的释放,减轻炎性细胞的浸润,缓解LPS导致的肺组织炎性反应,且二者治疗效果没有明显差异。本实验结果还表明,大鼠经LPS干扰后,光镜下肺组织病理学改变提示肺组织出现不定程度的损伤,肺组织DAD评分、W/D比值及BALF中的TP均有升高,给予DEX或PHC干预后,光镜下观察病理切片结果提示肺损伤情况较LPS组有明显好转,肺组织DAD评分、W/D比值及BALF中TP水平出现下降,表明肺泡水肿程度经DEX或PHC治疗后得到明显改善,二者对LPS致ALI具有一定的保护作用,且二者疗效无明显差异。
综上所述,本实验证明了DEX和PHC均可通过抗炎作用从而有效减轻肺组织的级联炎性反应及肺泡水肿程度,对LPS致大鼠早期ALI有一定的保护作用。但是本研究发现二者在明显抑制炎性因子表达的情况下,ALI只是减轻,未全部缓解,推测ALI仍存在DEX和PHC作用以外的分子机制。其他可能的分子机制及二者能否改善ALI大鼠的最终预后有待进一步研究证实。



