李国炜,李海洋,成 超,桑志山,杨钦喜,贾 磊,温欣慰
(1.贵州省贵阳市第一人民医院肝胆外科 550002;2.贵州医科大学附属医院肝胆外科,贵阳 550004;3.四川大学华西广安医院肝胆外科,四川广安 638000)
我国是全球肝癌的高发地区,其发病率和病死率均处于世界较高水平,预计未来的中国和世界肝癌发病人数和病死人数将逐渐增加[1]。虽然目前的外科技术有着突飞猛进的发展,肿瘤的介入治疗、放射治疗、靶向治疗、免疫治疗及生物治疗等在不断崛起。但是肝癌的治疗效果及预后仍不理想,术后肿瘤早期复发和转移是影响患者预后的主要原因[2]。由于肝癌发病隐匿,早期诊断困难,大多数患者发现时因出现转移而失去根治性治疗的机会。因此,进一步阐明肝癌侵袭、转移相关作用机制将具有重要临床意义。波形蛋白(vimentin,VIM)是一种丰富并高度保守的Ⅲ型中间纤维蛋白之一,近年的研究显示VIM在不同的生理及病理状态下显现出复杂的生物学功能,与肿瘤的侵袭转移能力关系密切[3]。本课题组在前期的试验中证实波形蛋白的高表达与肝癌的恶性程度及预后相关。本研究希望通过siRNA干扰技术,探讨VIM与肝癌侵袭转移的关系,希望为治疗原发性肝癌提供理论基础及生物干预靶点。
1 材料与方法
1.1材料 人肝癌细胞MHCC97-H、MHCC97-L购于上海中乔新舟生物公司(来源ATCC),胎牛血清(FBS)、胰酶消化液(EDTA)购自美国Gibco公司。高效RIPA细胞裂解液购自索莱宝,Trizol试剂盒购自上海拜力生物科技有限公司,VIM抗体、辣根过氧化物酶(HRP)标记山羊抗兔IgG(H+L)、化学发光(ECL)试剂盒购自沈阳万类生物科技有限公司。VIM siRNA(h)(sc-29522)、siRNA Dilution Buffer、siRNA Transfection Reagent、Control siRNA-A (sc-37007)、siRNA Transfection Medium、Control siRNA (Fluorescein Conjugate)-A(sc-36869)均购自美国Santa Cruz公司。Transwell小室购自美国Nunclon Surface公司。FastStart Unicersal SYBR Green Master (Rox)购自日本Takara Bio公司,cDNA反转录、cDNA合成(反转录)试剂盒购自美国赛默飞世尔科技(中国)有限公司。VIM引物由上海生工设计合成。CCK-8细胞增殖检测试剂盒购自上海东仁化学科技有限公司。Matrigel基底胶购自北京索莱宝生物科技有限公司。
1.2方法
1.2.1细胞培养 培养所需培养基按90%达尔伯克改良伊格尔培养基(DMEM)+10% FBS+1%双抗配制,细胞培养条件为37 ℃、5%CO2。根据细胞生长情况,1~3 d更换培养基。待细胞生长至85%以上即可进行传代。
1.2.2瞬时转染 实验分3组,实验组:转染特异性VIM-siRNA干扰;阴性对照组:转染非特异性Control siRNA-A;空白对照组:未加任何转染。所需VIM-siRNA由美国 Santa Cruz公司设计并合成,筛选出一条具有干扰效果的VIM-siRNA片段,其上游序列:5′-AUG GAA GAG AAC UUU GCC G-3′,下游序列:5′-CGG CAA AGU UCU CUU CCA U-3′。按照siRNA Transfection Reagent试剂说明书进行操作。
1.2.3Western blot 提取细胞总蛋白,二喹啉甲酸(BCA)法测蛋白水平,取样品量与十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液5X按照4∶1的比例加入1.5 mL EPP管混匀。置于100 ℃沸水加热5 min,以充分变性蛋白。按每孔40 μg总蛋白上样,经10%SDS-PAGE转膜、封闭,孵化一抗、二抗、ECL发光,最后用AX-Ⅱ型X射线摄影暗匣曝光。图片存于电脑,使用Image J软件处理,对结果进行灰度值分析,β-actin作为内参对照,进行半定量分析。
1.2.4实时荧光定量PCR(qPCR) 提取细胞总RNA并进行RNA水平测定,按cDNA反转录试剂盒操作说明进行反转录cDNA合成。以β-actin为内参,根据FastStart Unicersal SYBR Green Master操作说明进行PCR反应,反应条件为:95 ℃预变性10 min变性1个循环,95 ℃变性15 s,55 ℃退火30 s,72 ℃延伸1 min,共40个循环,72 ℃再延伸5 min 1个循环,4 ℃保存。通过检测样本CT值进行统计,采用2-△△CT法计算出目的基因mRNA的相对表达水平。VIM上游引物:5′-AGT CCA CTG AGT ACC GGA GAC-3′,下游引物:5′-GGG TGT CGA GGG AAA AAT AGG-3′,β-Actin上游引物:5′-CCT GGC ACC CAG CAC AAT-3′,下游引物:5′-GGG CCG GAC TCG TCA TAC-3′。
1.2.5CCK-8细胞增殖实验 细胞以3×103个/孔接种于96孔板中,各组设置4个时间点,0、24、48、72 h。在4个不同时间点各组加入总体积10%的CCK-8试剂,3 h后酶标仪在下450 nm波长测定光密度(OD)值,将各测试孔OD值减去本底OD值(空白组对照,即只加培养基未接种细胞),按公式计算细胞存活率,存活率%=(实验组-空白组)/(对照组-空白组)×100%,并绘制细胞生长曲线。
1.2.6Transwell侵袭实验 细胞转染24 h后,经胰酶消化,用含1%牛血清清蛋白(BSA)的DMEM培养基配成单细胞悬液,将细胞密度调整为5×105个/mL。混匀按每孔加入Matrigel 50 μL铺胶于Transwell膜小室,置于37 ℃ 30 min。取制备的细胞悬液1×105个/mL(配成200 μL)加入Transwell小室上室,下室加入含20%FBS的DMEM培养基500 μL,置于37 ℃培养箱常规培养24 h。经磷酸盐缓冲液(PBS)适当清洗,多聚甲醛固定30 min,风干。用0.1%结晶紫染色15 min。PBS清洗,于显微镜下选取5个视野直接镜下拍照观察穿膜细胞数,取平均值。
1.2.7细胞划痕试验 将各组细胞按1×106个/孔接种到6孔板内,培养24 h。用高压消毒后100 μL枪头垂直均匀在培养板中划线。再PBS清洗划下脱落的细胞3次,每孔加入2 mL无血清培养液,置于37 ℃、5%CO2的培养箱继续培养,分别于0、24、48 h对细胞进行观察并拍照,划痕修复率=(0 h划痕距离-24 h或48 h划痕距离)/0 h划痕距离×100%。
1.2.8荧光显微镜观察转染情况 荧光对照组[Control siRNA (Fluorescein Conjugate)-A]分别转染MHCC97-H细胞和MHCC97-L细胞6 h后,于荧光显微镜下观察转染情况。

2 结 果
2.1Western blot检测VIM在不同转移潜能肝癌细胞中的表达 VIM在MHCC97-H细胞中表达水平(1.20±0.33)明显高于MHCC97-L细胞表达水平(0.93±0.29),两种细胞VIM表达水平比较差异有统计学意义(P<0.05)。两种细胞VIM表达,见图1。

1:MHCC97-H;2: MHCC97-L
图1 Western Blot检测不同肝癌细胞VIM的表达
2.2MHCC97-H和MHCC97-C两株细胞转染情况 暗视野下可见已转染一包呈绿色荧光,同一视野明视野拍照对比,其转染均达70%以上,见图2。
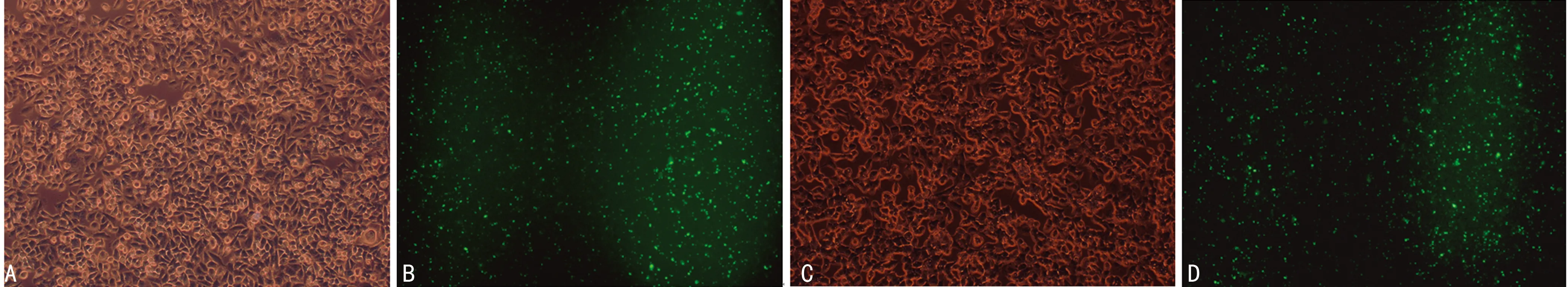
A:MHCC97-H细胞;B:MHCC97-H细胞转染6 h后;C:MHCC97-L细胞;D:MHCC97-L细胞转染6 h后
图2 MHCC97-H细胞和MHCC97-L细胞转染情况(×200)
2.3Western blot检测转染后各组细胞VIM表达水平 转染后MHCC97-H细胞和MHCC97-L细胞实验组中VIM均有明显下调,其抑制率分别为73.69%和69.43%,与相应的阴性组及空白组相比,差异均有统计学意义(P<0.05),见图3、4。
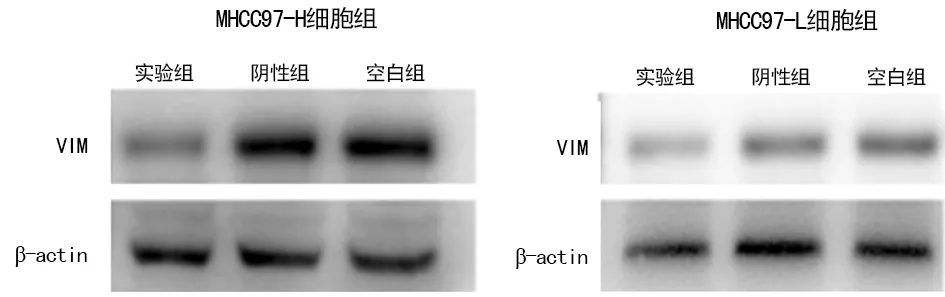
图3 Western blot检测VIM在各组细胞中的表达

a:P<0.05,与空白组和阴性组比较
图4 VIM在各组细胞中的VIM表达水平比较
2.4qPCR检测转染后各组细胞VIM mRNA的相对表达水平 qPCR检测结果显示,两种细胞实验组中VIM mRNA表达水平均明显下调,与阴性组及空白组比较,差异均有统计学意义(P<0.05)。VIM mRNA在各组细胞中的相对表达水平比较,见图5。
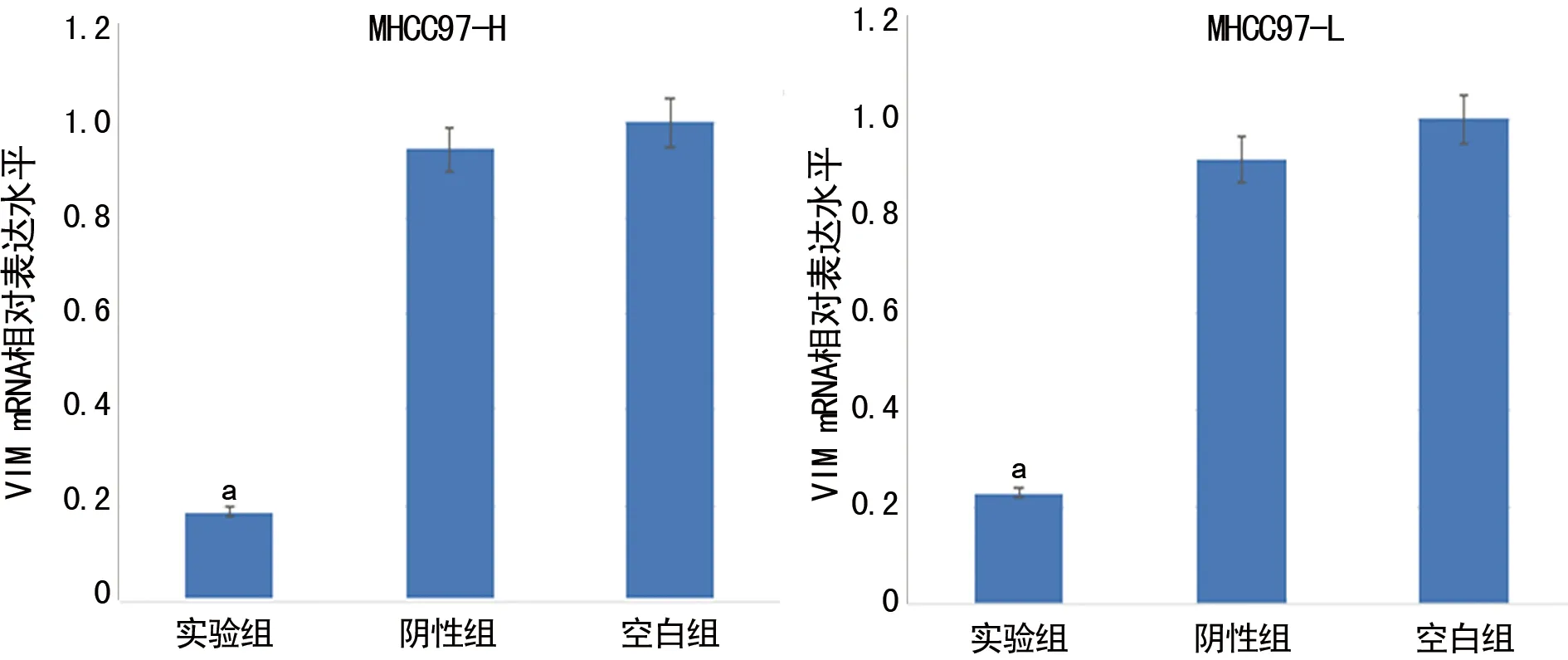
a:P<0.05,与阴性组和空白组比较
图5 VIM mRNA在各组细胞中的相对表达水平比较

a:P<0.05,与阴性组和空白组比较
图6两种肝癌细胞各组细胞增殖能力比较

a:P<0.05,与阴性组和空白组比较
图7 48 h时两种肝癌细胞各组细胞增殖率比较
2.5两种细胞CCK-8细胞增殖实验结果比较 实验组中MHCC97-H细胞和MHCC97-L细胞的增殖能力均有不同程度抑制,转染24~48 h时其抑制作用较为明显,与相应的阴性组和空白组比较,差异均有统计学意义(P<0.05),见图6、7。
2.6沉默VIM基因对各组细胞侵袭能力的影响 通过siRNA干扰技术沉默VIM基因后,两种细胞的侵袭能力均被明显抑制,实验组VIM-siRNA与阴性组和空白组比较,差异均有统计学意义(P<0.05),见图8、9。

图8 沉默VIM基因对MHCC97-H、MHCC97-L细胞侵袭能力的影响(Transwell×200)
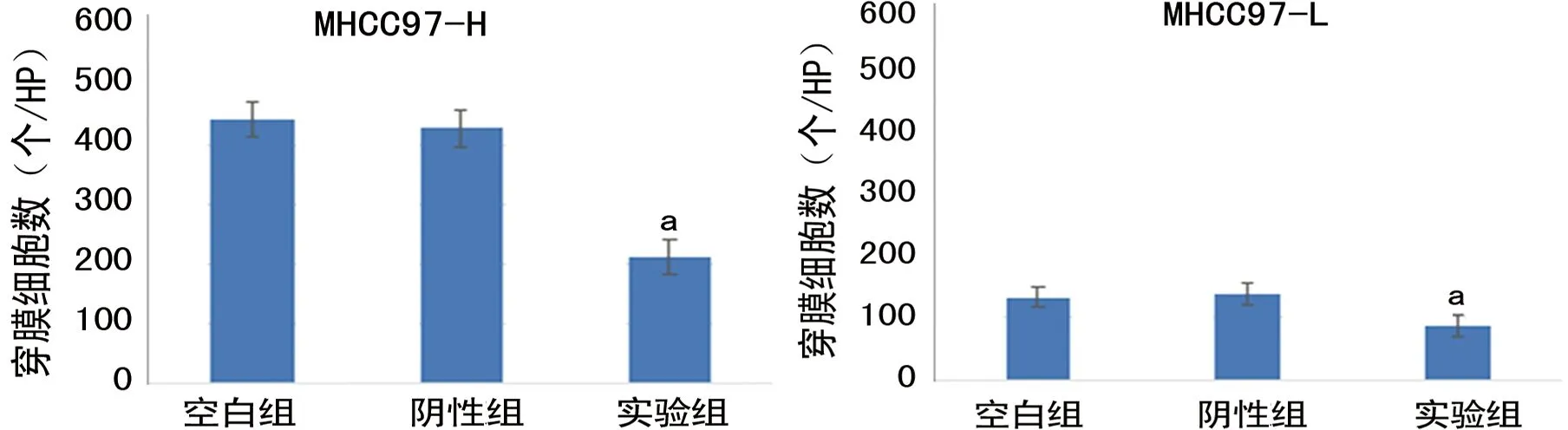
a:P<0.05,与阴性组和空白组比较
图9各组细胞Transwell侵袭试验穿膜细胞数比较
2.7各组细胞迁移能力比较 通过细胞划痕试验结果显示,在MHCC97-H细胞和MHCC97-L细胞中,沉默VIM后两种细胞迁移能力均受抑制,实验组与对应的阴性对照组、空白对照组比较,差异具有统计学意义(P<0.05)。见图10、11。

图10 各组细胞划痕实验结果(×200)

a:P<0.05,与阴性组和空白组比较
图11各组细胞划痕修复率比较
3 讨 论
我国是乙型病毒性肝炎(简称乙肝)大国,全球估计有57%的肝硬化和78%的肝细胞肝癌病例与乙肝或丙型病毒性肝炎(简称丙肝)病毒感染相关[4]。尽管原发性肝癌的诊断和治疗已经取得了进展,但其预后仍然不尽人意。肝癌复发及转移仍是影响患者预后的主要原因。进一步弄清楚肝癌的发生、发展机制及侵袭转移相关作用机制具有重要临床意义。
在临床上,肿瘤的早期诊断及预测预后对其治疗至关重要。本课题组前期研究发现,VIM在原发性肝癌组织中异常表达,癌组织中VIM表达远大于癌旁近、远组织(距癌组织2~5 cm、>5 cm),其高表达与肝癌的TNM分期、病理分化、癌结节数量及转移情况密切相关[5],本研究认为VIM的高表达对肝癌具有一定的促进作用,VIM可以视为一种潜在的肿瘤标志物[6-7]。关于这一点,在其他研究中也得到验证。有学者利用强效抗体V9抗原表位的精确测定VIM,在恶性肿瘤中具有高度特异性,作为促进恶性肿瘤的诊断[8]。通过血清学检测VIM,对小肝癌的诊断具有40.91%的灵敏度和87.50%的特异度[9]。
本研究选用两种不同转移潜能的肝癌细胞系,其转移潜能MHCC97-H>MHCC97-L,MHCC97-H肺转移能力为100%,MHCC97-L肺转移潜能为40%[10]。通过蛋白印迹实验提示VIM的高表达可能促进肝癌的侵袭转移。通过siRNA干扰技术能够有效沉默VIM基因在MHCC97-H和MHCC97-L细胞中的表达,而且两种细胞的增殖能力、侵袭能力和迁移能力明显下降,说明VIM的表达在肝癌的侵袭、转移过程中扮有重要的作用,并对肿瘤的靶向治疗具有一定的临床意义。关于其作用机制,目前尚不清楚。本课题组认为这一现象与VIM本身的生物学功能密切相关,如调控细胞的黏附、迁移、细胞凋亡、上皮-间质转化及血管生成等。
近年来,有研究显示VIM参与细胞黏附及迁移的调控,可解释在上皮细胞-间质转化过程中,细胞运动性增强、黏附性减弱及细胞形态改变,进而导致肿瘤侵袭能力的增强[11]。此外,VIM具有促进血管生成作用和介导内皮细胞收缩力的调节[12-13],同时也可参与调节血管生成的平衡[14]。而部分信号分子是可以通过调节VIM来促进肝细胞癌中的细胞增殖和侵袭,如长的非编码RNA GAS5[15],说明VIM可以作为部分信号通路的信号分子参与肿瘤的发展过程。有学者认为,VIM可能是通过鸟嘌呤核苷酸交换因子(GEF)VAV2介导的Rac1激活,促进黏着斑激酶(FAK)的稳定,使癌细胞更具运动性和侵袭性[16]。
本研究结果表明,VIM与肝癌侵袭转移的关系。VIM的高表达与肝癌恶性程度及预后呈正相关,具有一定的临床指导意义。进一步阐明VIM与肝癌相关信号的作用机制,对于研究肿瘤的发生、发展及研发阻断肿瘤侵袭转移的靶向药物具有重要意义。



