
【摘要】文章以“常见酸、碱的化学性质”为例,以期借助多种实验手段引导学生在理解酸、碱知识的基础上,不断提高解决问题的能力,从而培养学生的高阶思维能力。
【关键词】高阶思维能力;实验;教学;酸;碱
作者简介:李莹莹(1982—),女,江苏省淮阴中学。
初中阶段学生的能力培养,可以根据《义务教育化学课程标准(2022年版)》设置的五个学习主题—“科学探究与化学实验”“物质的性质与应用”“物质的组成与结构”“物质的化学变化”“化学与社会·跨学科实践”来进一步细化[1]。化学实验教学要培养学生善于发现问题、敢于分析问题、勇于解决问题的高阶思维能力。高阶思维指发生在高层次认知水平上的心智活动,是创新能力、问题解决能力、批判思维能力的核心[2]。教师要根据教学实际情况,合理选择实验内容,精心设计教学过程,提高学生的高阶思维能力。
一、化学实验的教学目标
笔者以“常见酸、碱化学性质”这一学生必做实验为例,尝试从基本操作、原理分析、成分分析、实验设计、建构知识框架等角度,培养学生在真实问题的解决过程中主动应用化学知识的意识,促进学生提高质疑能力、批判能力以及创新能力。
二、化学实验教学案例分析
(一)常见酸的化学性质
1.实验操作
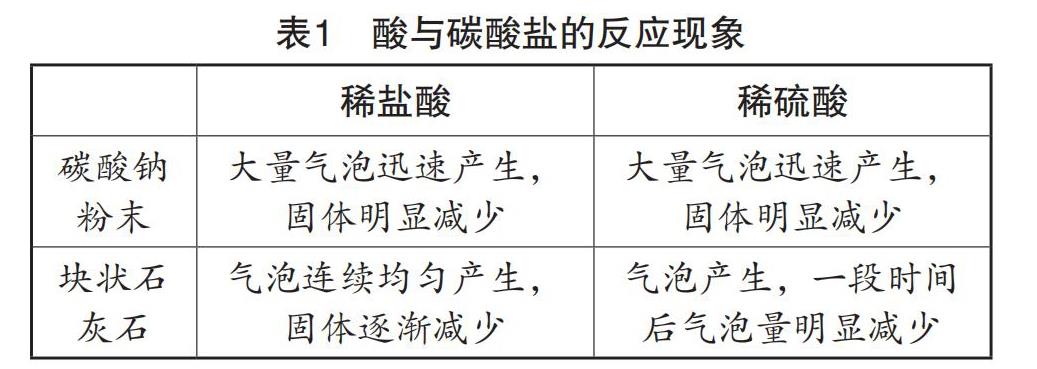
取两支试管,加入适量的碳酸钠粉末和块状石灰石,再分别加入适量稀硫酸和稀盐酸,观察实验现象,填写表1。
笔者:“同学们可以根据实验现象写出化学反应方程式,并标注基本反应类型吗?”
学生书写化学反应方程式,并分析得出上面四个反应都属于复分解反应。
笔者:“上面四组实验,哪组比较适合实验室制取二氧化碳气体呢?”
学生从反应的速度及持续性的角度进行分析后,选择稀盐酸和石灰石作为实验室制取二氧化碳的原料。
笔者:“请同学们评价稀盐酸与石灰石反应制取二氧化碳的方法。”
学生:“稀盐酸与石灰石反应制取二氧化碳反应速度适中,在实验室里选用长颈漏斗即可组装发生装置。”
笔者:“稀硫酸是高沸点酸,难挥发,是否可以选用稀硫酸在实验室制取二氧化碳气体呢?”
学生:“不可以。因为稀硫酸与碳酸钠粉末反应速度太快,不便于控制与收集;稀硫酸与石灰石反应生成微溶于水的硫酸钙,使反应不能持续进行。”
笔者:“同学们对已学知识掌握得很好,对实验现象的观察也很仔细,请同学们进一步思考,稀硫酸分别与碳酸钠粉末、石灰石反应,为什幺会出现上述现象,是否可以进行改进?”
学生1:“碳酸钠粉末是固体,与液体稀硫酸接触面积很大,反应会非常迅速、充分。可以选用过氧化氢溶液制氧气的发生装置,用分液漏斗控制液体的滴加速度,以控制反应的速度。”
学生2:“稀硫酸与石灰石可以反应,但是生成的硫酸钙微溶于水,会覆盖在石灰石表面,阻碍反应的进一步发生。如果能及时把硫酸钙从石灰石表面除掉,反应就可以持续进行了。”
2.小结
在实验过程中,笔者及时关注学生的具体操作,帮助学生学会正确的实验操作方法。首先,笔者引导学生复习固体药品和液体药品的取用方法;其次,笔者关注学生使用仪器的规范,让学生在多次实验中体会胶头滴管“垂直悬空,不碰壁”的操作要领。再次,笔者引导学生复习复分解反应这一基本反应类型,让学生借助于化学式、化合价理解复分解反应“等价交换”的特征。最后,笔者在实验的基础上,关联实际应用,培养学生敢于质疑、善于分析、敢于提出自己的观点的品质以及积极运用已有知识解决问题的能力。
(二)酸与金属、金属氧化物的反应
1.学生分组实验
酸除了能与碳酸盐反应,还能与哪些类别的物质反应呢?请同学们完成以下实验内容,并填写实验表格(见表2)。学生分为A、B两组,分别进行实验A和实验B,并观察实验现象。
2.小结
学生进行上述实验操作与观察,难度不大。在自主实验过程中,学生从观察一种物质的实验现象,上升到分析与归纳一类物质的实验现象,找出化学反应的异同,有利于归纳零散的知识,自主构建系统化知识框架。
对于金属与酸的这一类反应,学生借助实验与金属活动性顺序表,可以更加清晰地认识“氢前活泼金属”能与稀盐酸或稀硫酸发生置换反应,产生氢气。这是在学完酸、碱、盐的新课知识后,学生必须进行的知识建构。通过知识建构,学生可以更好地发展高阶思维能力。
(三)常见碱的化学性质
1.实验操作
笔者:“实验桌上的试剂中,有两瓶是存放碱液的,同学们能取出来,并说明你是怎幺分辨的吗?”
学生观察实验桌上的试剂,找出两个用橡胶塞的细口瓶。他们分析道:“碱液能够和非金属氧化物发生反应,玻璃的主要成分是二氧化硅,会与碱液反应,所以不用玻璃塞,而用橡胶塞。”
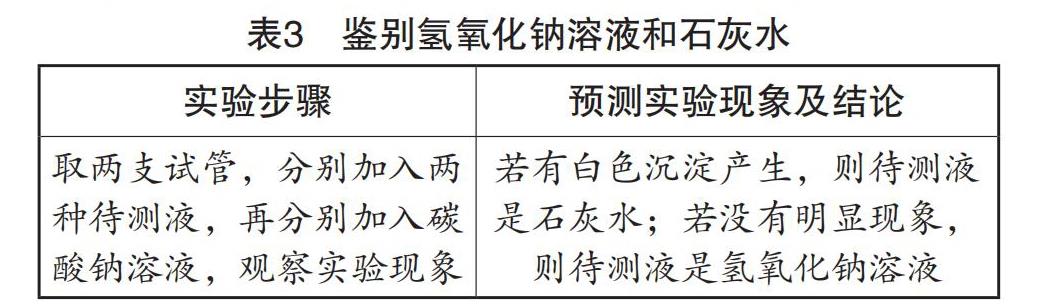
笔者:“这两瓶试剂都没有标签,同学们可以区分哪瓶是氢氧化钠溶液,哪瓶是石灰水吗?”
学生:“根据碱类物质的性质,结合实验室给定的药品,可以设计实验表格(见表3)进行验证。”
2.小结
此实验把认识碱类物质化学性质的实验操作转化成鉴别两种常见碱的实验操作,充分激发了学生的好奇心、探究欲以及想象力,有效调动了学生的思维。学生能够学以致用,在充分理解碱类物质共性的同时,利用其个性进行鉴别。通过这样的实验操作,学生体验到自主设计实验、验证结论以及科学探究的快乐,发展了辩证思维、逻辑思维等高阶思维。
(四)酸碱中和反应
1.预测实验
笔者:“酸和碱是两类不同的物质,我们已经研究并归纳了它们的化学性质。假如我们将稀盐酸与氢氧化钠溶液混合,会出现什幺变化呢?”
学生:“无明显变化。”
2.设计实验
笔者:“稀盐酸与氢氧化钠溶液混合后,是否发生了化学反应呢?同学们能设计实验进行验证吗?”
供学生选择的药品如下:稀盐酸、氢氧化钠溶液、酚酞试液、镁条、硫酸铜溶液。
实验方案1:取适量稀盐酸加入试管中,然后加入氢氧化钠溶液至过量,再加入镁条,如果没有明显实验现象,说明酸性物质消失了,则可以证明稀盐酸和氢氧化钠发生了反应;反之,则未反应。
实验方案2:在试管中依次加入适量氢氧化钠溶液、稀盐酸、硫酸铜溶液,如果没有明显实验现象,说明酸性物质消失了,则可以证明稀盐酸和氢氧化钠发生了反应;反之,则未反应。
实验方案3:在试管中依次加入适量氢氧化钠溶液、过量的稀盐酸、酚酞试液,如果没有明显实验现象,说明碱性物质消失了,则可以证明稀盐酸和氢氧化钠发生了反应;反之,则未反应。
实验方案4:在试管中依次加入适量氢氧化钠溶液、酚酞试液和稀盐酸,如果红色褪去,说明碱性物质消失了,则可以证明稀盐酸和氢氧化钠发生了反应;反之,则未反应。
3.解释实验
笔者:“上述几种方案,设计思路是什幺呢?”
学生:“在稀盐酸中加入过量氢氧化钠溶液,如果发生反应,那幺稀盐酸就会被消耗,酸性就会消失。此时加入那些原本能够和酸性溶液发生反应,且有明显反应现象的物质,如果没有出现明显的现象,就说明稀盐酸和氢氧化钠溶液发生了反应。同理,在氢氧化钠溶液中加入过量稀盐酸,通过验证碱性的消失,就可以证明氢氧化钠溶液和稀盐酸发生了反应。因此,我们可以从化学反应的本质出发思考问题,即化学反应发生时,反应物是不断被消耗的。”
4.实验现象记录(见表4)
5.小结
对于没有明显现象的化学反应,要验证其是否发生时,第一种思路是可以验证反应物是否消失,第二种思路是可以验证新物质是否生成。
笔者引导学生自主设计验证酸和碱反应发生的实验方案,有效地调动了学生的思维,发展了学生设计、分析、动手、评价等能力,真正发挥了实验教学的作用。
学生仔细观察化学反应的现象,认识化学反应的本质,可以学会思辨,发展批判性思维,并且提高分析问题、解决实际问题的能力。
(五)建构知识框架
笔者:“根据上述实验,我们知道了酸和碱是可以发生反应的,请同学们建构酸和碱的知识框架,总结酸和碱的化学性质。”
学生:“酸能与多种活泼金属反应,生成盐和氢气;酸能与某些金属氧化物反应,生成盐和水;碱能与某些非金属氧化物反应,生成盐和水;酸和碱都能与酸碱指示剂反应,指示剂遇酸或碱的溶液显示不同的颜色;酸和碱能够发生中和反应,生成盐和水;盐在水溶液中能解离出金属离子和酸根离子。”
结语
综上所述,文章围绕酸和碱的化学性质,从实验前的分析预测到对实验现象的观察、分析以及解释,再到对实验方案、结论的评价,探究利用实验教学引导学生理解酸和碱的有关知识,促进学生自主建构系统的化学知识框架的方法,以期真正提高学生解决问题的能力,培养学生的高阶思维能力,凸显化学实验教学的育人价值。
【参考文献】
[1]中华人民共和国教育部.义务教育化学课程标准(2022年版)[M].北京:北京师范大学出版社,2022.
[2]汤小梅.化学教学中高阶思维训练拓展设计[J].化学教学,2017(8):21-24.



