鲁 猛,王 刚,贾洪艳,李 洋,张 磊,张秋学,李学峰,王 娜
(1.沧州市中心医院,河北 沧州 061000;2.河北医科大学,河北 石家庄 050011)
肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤,在世界范围内致死率排第二位。我国肝癌发病率与死亡率较高。目前HCC的治疗主要以手术为主,辅以放化疗的方式,但肝癌恶性程度高,术后复发与转移率高,患者预后较差,亟需寻找新的治疗药物与治疗靶点[1-2]。细胞自噬与肝癌发生、转移、靶向治疗和耐药密切相关,调节自噬是治疗HCC与减少耐药的新策略[3]。姜黄素(curcumin,Cur)是植物姜黄的提取物,具有抑制肝癌细胞增殖、诱导细胞周期阻滞与细胞凋亡、抗肿瘤的作用[4]。Wnt/β-连环蛋白(β-Catenin)信号通路与肿瘤恶性进展和耐药性有关,B细胞淋巴瘤因子9(B-cell lymphoma factor 9,BCL9)是β-Catenin的共激活因子。BCL9能促进β-Catenin通路激活,促进乳腺癌生长、侵袭和转移[5]。研究显示,姜黄素能通过激活自噬,下调磷脂酰肌醇蛋白聚糖3(glypican-3,GPC3)/Wnt/β-Catenin信号通路抑制HCC肿瘤生长[6]。故本研究以β-Catenin/BCL9通路为切入点,从细胞自噬角度,探讨姜黄素治疗肝癌的机制。
1 材料
1.1 细胞 肝癌细胞HepG2(批号:TCHu 72)购自上海中科院细胞库。
1.2 主要试剂与仪器 姜黄素(批号:C1386)购自sigma公司;自噬抑制剂3-MA(批号:S276713,纯度:99.97%)购自Selleck;Lipo6000TM转染试剂(批号:C0526)、Annexin V-FITC细胞凋亡检测试剂盒(批号:C1062S)购自碧云天生物科技有限公司;质粒对照(VEC)(批号:2201051)、Bcl9过表达质粒(OE-Bcl9)(批号:2201052)、shRNA慢病毒载体阴性对照(Sh-NC)(批号:2201061)及shRNA Bcl9慢病毒载体(Sh-Bcl9)(批号:2201062)均购自云舟生物科技股份有限公司;双标腺病毒mRFP-GFP-LC3(批号:HB5421)购自汉恒生物科技(上海)有限公司;微管相关蛋白1轻链3B抗体(LC3B)(批号:ab221794)、自噬关键分子酵母Atg6同系物抗体(Beclin1)(批号:ab207612)、波形蛋白抗体(Vimentin)(批号:ab137321)、E-钙黏蛋白抗体(E-cadherin)(批号:ab40772)、β-Catenin抗体(批号:ab224803)、BCL9抗体(批号:ab113110)均购自Abcam公司。
流式细胞仪(型号:CytoFLEX)购自贝克曼库尔特商贸(中国)有限公司;光学显微镜(型号:WYS-100C)购自天津微仪光学仪器有限公司;透射电子显微镜(型号:Titan KriosG2)购自苏州佐藤精密仪器有限公司;组织包埋机(型号:HistoStar)购自江苏维林科生物技术有限公司;超薄切片机(型号:UM10)购自江苏雷博科学仪器有限公司;激光共聚焦显微镜(型号:LSM 980 with Airyscan)购自武汉世百瑞科技有限公司;自动凝胶成像分析仪(型号:Tanon 3500)购自苏州阿尔法生物实验器材有限公司。
2 方法
2.1 细胞处理及分组 HepG2细胞生长至对数期时,将HepG2细胞分为对照组(Control组)、Cur组、Cur+自噬抑制剂组(Cur+3-MA组)、Cur+质粒对照组(Cur+VEC组)、Cur+Bcl9过表达组(Cur+OE-BCL9组)、Cur+shRNA慢病毒载体阴性对照组(Cur+Sh-NC组)、Cur+shRNA Bcl9慢病毒载体组(Cur+Sh-BCL9组),除Control组外,其余各组均使用20.0 μmol/L[7]的Cur 预处理24 h,Cur+3-MA 组使用20.0 μmol/L 的Cur 与5.0 mmol/L[8]的3-MA共同处理24 h,Cur+VEC组、Cur+OE-BCL9组、Cur+Sh-NC组、Cur+Sh-BCL9组使用20.0 μmol/L的Cur预处理24 h后再进行质粒转染。
2.2 细胞凋亡检测 HepG2细胞(1×105个/mL)接种至6孔板中,按“2.1”的分组进行处理,培养24 h后,调整细胞浓度为4×105个/mL,流式管分别加入20 μL Annexin V-FITC,再加入100 μL细胞悬液,室温避光孵育10 min,加入20 μL PI,室温避光10 min,流式细胞仪检测细胞凋亡。
2.3 细胞迁移与侵袭检测 (1)迁移实验:Transwell小室置于24孔板孔内,下室加入500 μL完全细胞培养液,各组细胞使用无血清培养基制成2×106个/mL的细胞悬液,上室加入200μL细胞悬液,培养48 h,PBS洗涤,95%乙醇固定,结晶紫染色,晾干后树脂封片,镜检,每孔随机选取5个视野计算细胞数量。(2)侵袭实验:Transwell小室上室使用Matrigel基质胶包被,其余步骤同迁移实验。
2.4 自噬体观察 各组细胞使用胰酶消化后,1 200 r/min离心10 min(离心半径:13.5 cm)收集细胞,依次用2.5%戊二醛和1%四氧化锇固定1 h,乙醇脱水后用丙酮置换2次,然后包埋在Epon树脂中,切成50 nm切片,3%醋酸铀酰和柠檬酸铅双重染色15 min,透射电子显微镜观察自噬体。
2.5 自噬体水平检测 将各组HepG2细胞接种到35 mm激光共聚焦培养皿中,细胞生长至对数期时,采用1/2体积感染法将双标腺病毒mRFP-GFP-LC3转染细胞,感染复数(MOI)值为200,感染36 h后,观察荧光表达状况,并拍照记录保存。
2.6 自噬(LC3Ⅱ/Ⅰ、Beclin1)、上皮间质转化(Vimentin、Ecadherin)、β-Catenin/BCL9通路(BCL9、β-Catenin)相关蛋白相对表达量 采用蛋白提取试剂盒提取各组细胞总蛋白,BCA法蛋白定量后,10%聚丙烯酰胺凝胶电泳,转印至硝酸纤维素膜(80 V,90 min),在5%脱脂奶粉中室温封闭1 h。将膜与LC3 Ⅱ/Ⅰ、Beclin1、Vimentin、E-cadherin、β-Catenin、BCL9、β-actin一抗(均按照1∶1 000稀释)在4 ℃孵育过夜,用0.1%Tween 20-Tris-缓冲盐水(TBST)洗涤3次,每次10 min;加入二抗(1∶2 000稀释)室温孵育1 h。再次用TBST洗涤3次,每次10 min,化学发光法进行显影,然后用自动凝胶成像分析仪拍照并分析。目的蛋白表达水平以目的条带灰度值与内参(β-actin)条带灰度值的比值表示。
2.7 统计学方法 采用SPSS 25.0统计分析,符合正态分布且方差齐的计量资料以()表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
3 结果
3.1 各组HepG2细胞凋亡率比较 Cur组细胞凋亡率明显高于Control组(P<0.05);Cur+3-MA组细胞凋亡率明显低于Cur组(P<0.05),Cur+OE-BCL9组细胞凋亡率明显低于Cur+VEC组(P<0.05);Cur+Sh-BCL9组细胞凋亡率明显高于Cur+Sh-NC组(P<0.05)。(见图1~2)
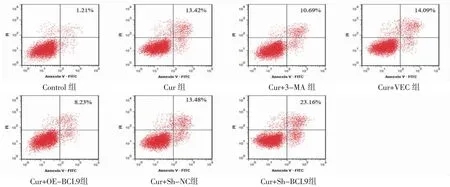
图1 Cur 对HepG2 细胞凋亡的影响
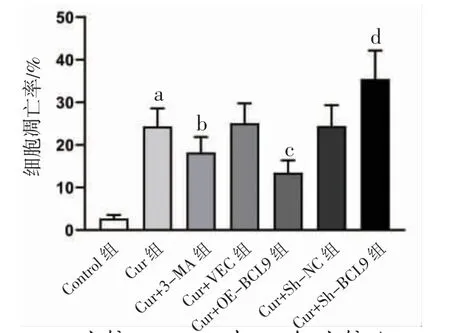
图1 各组HepG2 细胞凋亡率比较 (,n=6)
3.2 各组HepG2迁移与侵袭细胞数比较 Cur组细胞迁移与侵袭细胞数明显低于Control组(P<0.05);Cur+3-MA组细胞迁移与侵袭细胞数明显高于Cur组(P<0.05);Cur+OE-BCL9组细胞迁移与侵袭细胞数明显高于Cur+VEC组(P<0.05);Cur+Sh-BCL9组细胞迁移与侵袭细胞数明显低于Cur+Sh-NC组(P<0.05)。(见图3~4)
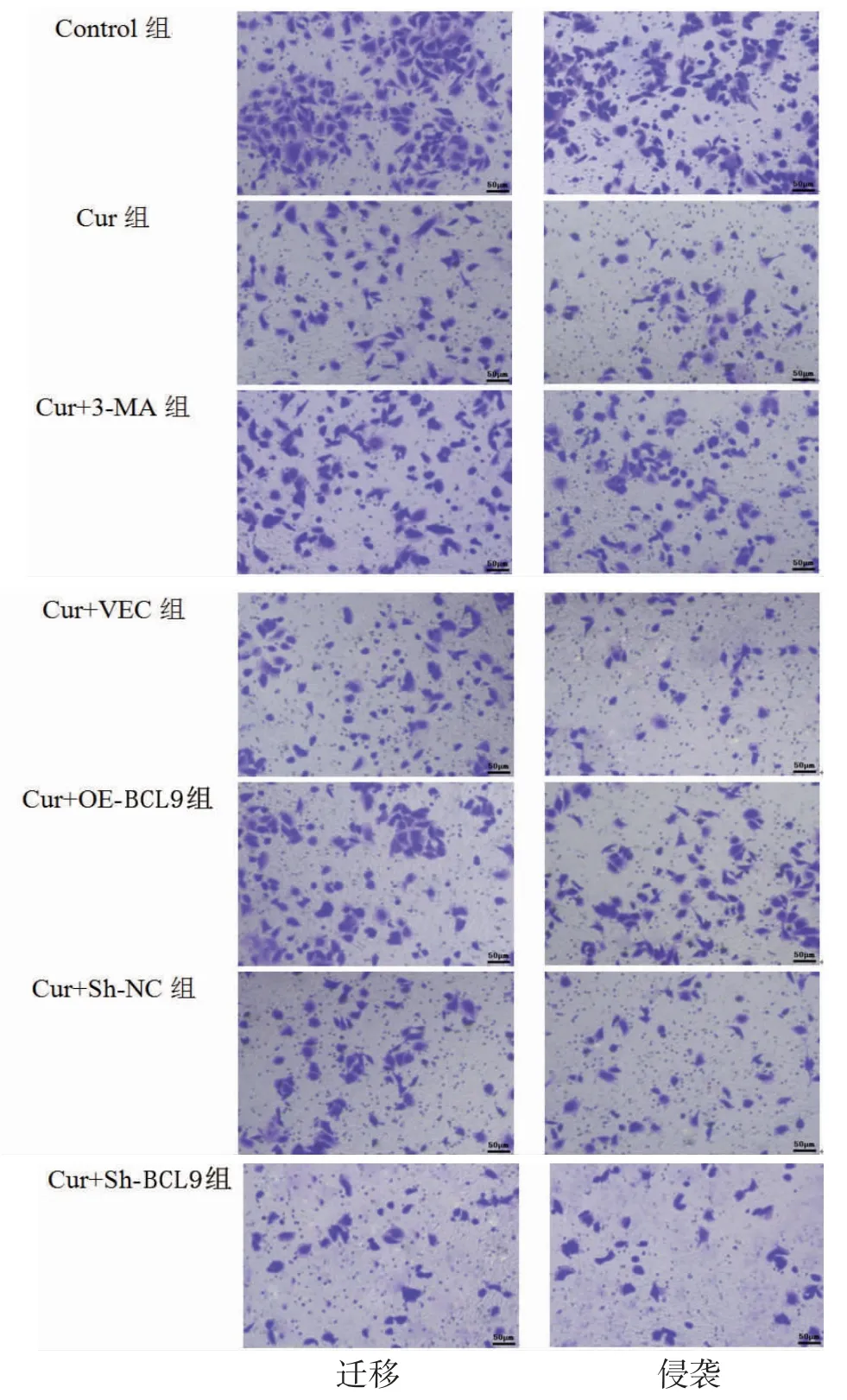
图3 Cur 对HepG2 迁移与侵袭的影响 (×200)
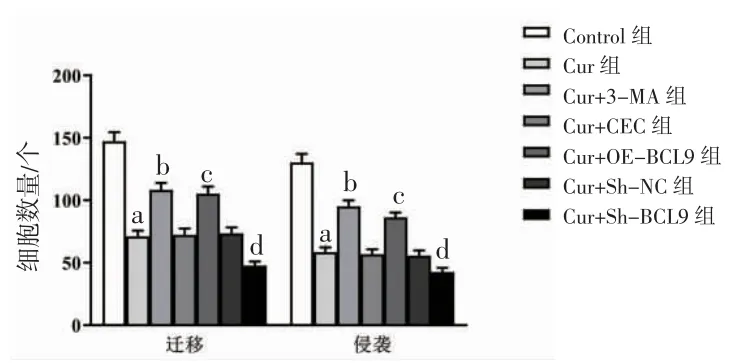
图4 各组HepG2 迁移与侵袭细胞数比较 (,n=6)
3.3 各组细胞自噬体形成比较 透射电子显微镜观察结果显示,Control组线粒体结构正常,无自噬体与自噬溶酶体形成;Cur组、Cur+VEC组、Cur+Sh-NC组细胞线粒体肿胀,出现大量自噬体;Cur+3-MA组自噬体少于Cur组;Cur+OE-BCL9组自噬体少于Cur+VEC组;Cur+Sh-BCL9组自噬体多于Cur+Sh-NC组。(见图5)
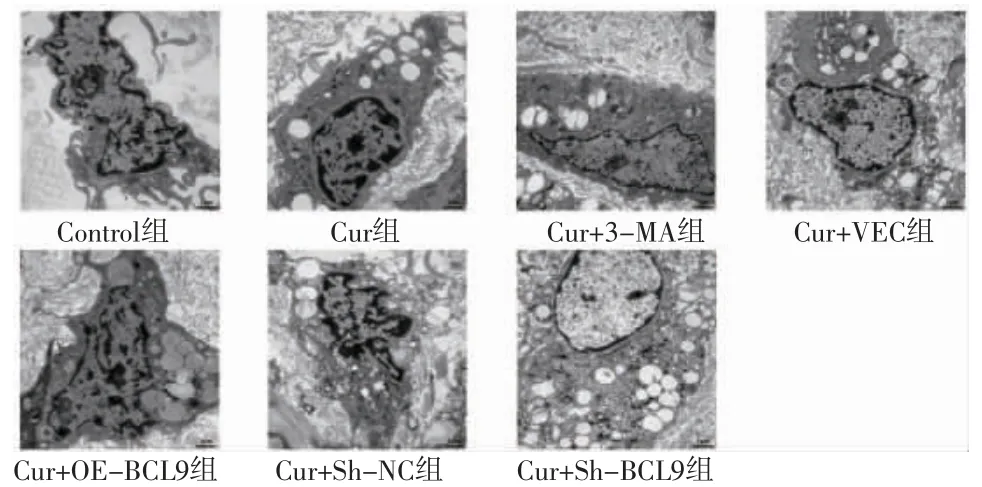
图5 透射电子显微镜观察各组HepG2细胞的自噬体(×20000)
3.4 各组细胞自噬水平比较 GFP-LC3双荧光质粒转染细胞后,激光共聚焦显微镜观察显示,Control组有少量绿色斑点(自噬小体)与红色斑点(自噬溶酶体);Cur组、Cur+VEC组、Cur+Sh-NC组显示大量绿色与红色,表明有大量自噬小体与自噬溶酶体形成;Cur+3-MA组绿色斑点与红色斑点少于Cur组,自噬小体减少;Cur+OE-BCL9组细胞绿色与红色斑点减少,自噬小体少于Cur+VEC组;Cur+Sh-BCL9组细胞绿色与红色斑点增多,自噬小体多于Cur+Sh-NC组。(见图6)
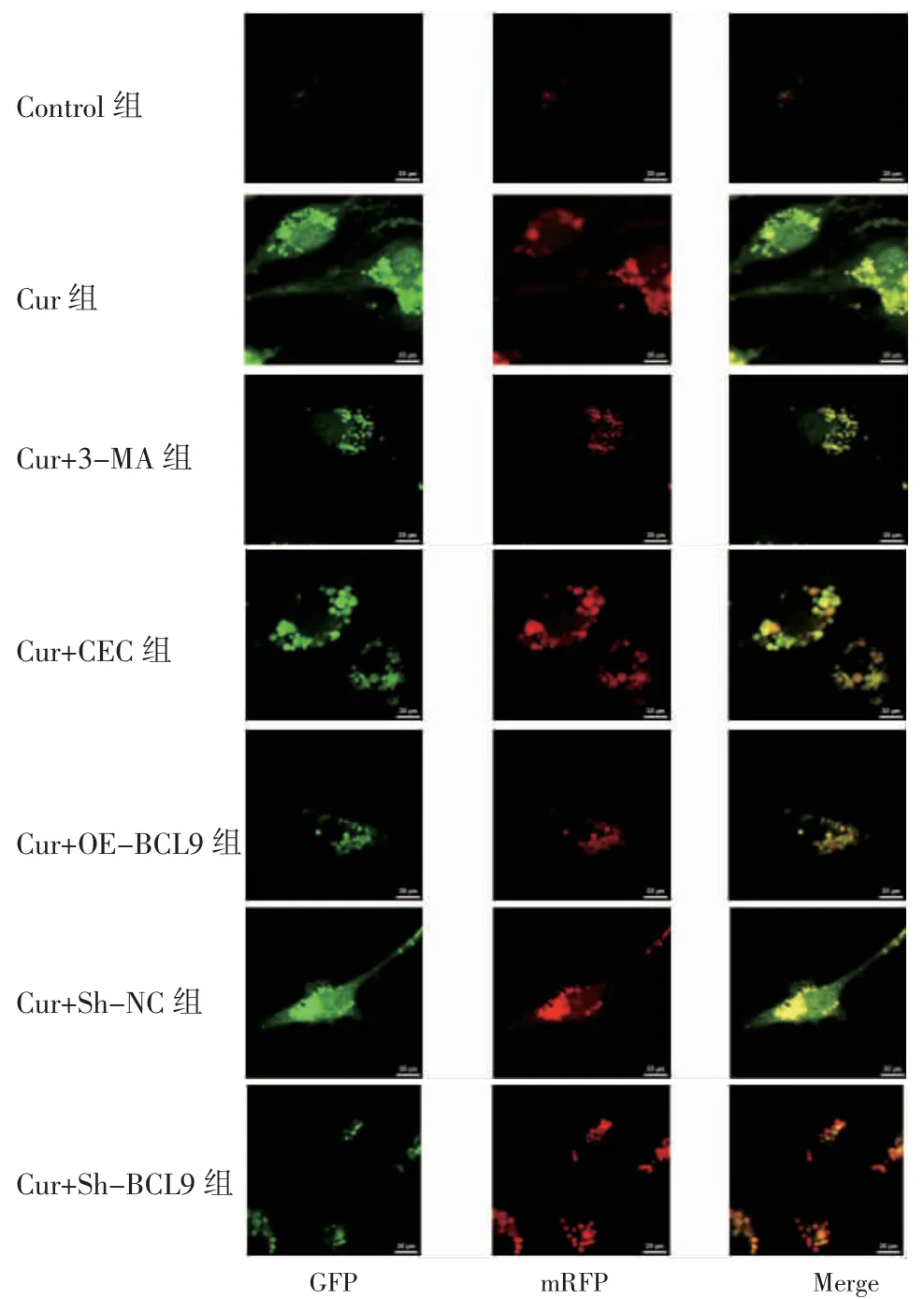
图6 激光共聚焦显微镜观察各组细胞自噬水平(63×油浸物镜)
3.5 各组细胞自噬及上皮间质转化(EMT)相关蛋白相对表达量比较 Cur组LC3Ⅱ/Ⅰ及Beclin1、E-cadherin蛋白相对表达量明显高于Control组(P<0.05),Vimentin蛋白相对表达量低于Control组(P<0.05);Cur+3-MA组LC3Ⅱ/Ⅰ及Beclin1、E-cadherin蛋白相对表达量明显低于Cur组(P<0.05),Vimentin蛋白相对表达量明显高于Cur组(P<0.05);Cur+OE-BCL9组LC3Ⅱ/Ⅰ及Beclin1、E-cadherin蛋白相对表达量明显低于Cur+VEC组(P<0.05),Vimentin蛋白相对表达量明显高于Cur+VEC组(P<0.05);Cur+Sh-BCL9组LC3Ⅱ/Ⅰ及Beclin1、E-cadherin蛋白相对表达量明显高于Cur+Sh-NC组(P<0.05),Vimentin蛋白相对表达量明显低于Cur+Sh-NC组(P<0.05)。(见图7~8)
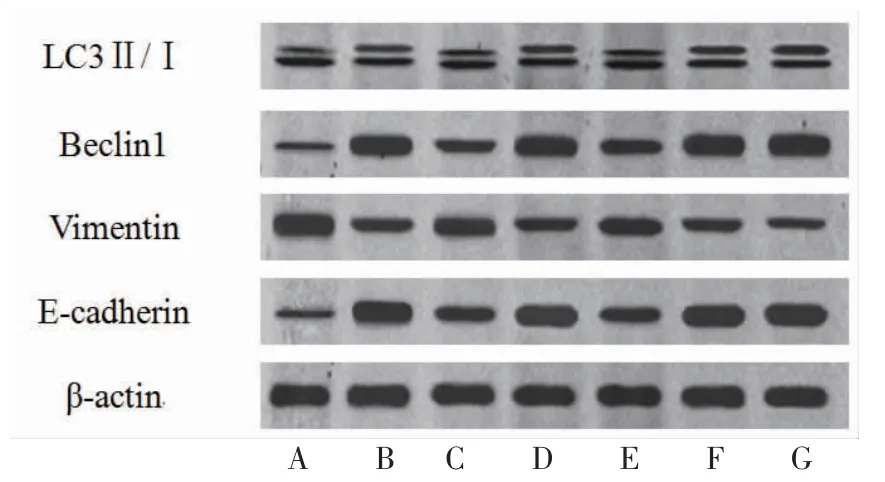
图7 LC3Ⅱ/Ⅰ、Beclin1、Vimentin、E-cadherin 蛋白表达Western blotting 图
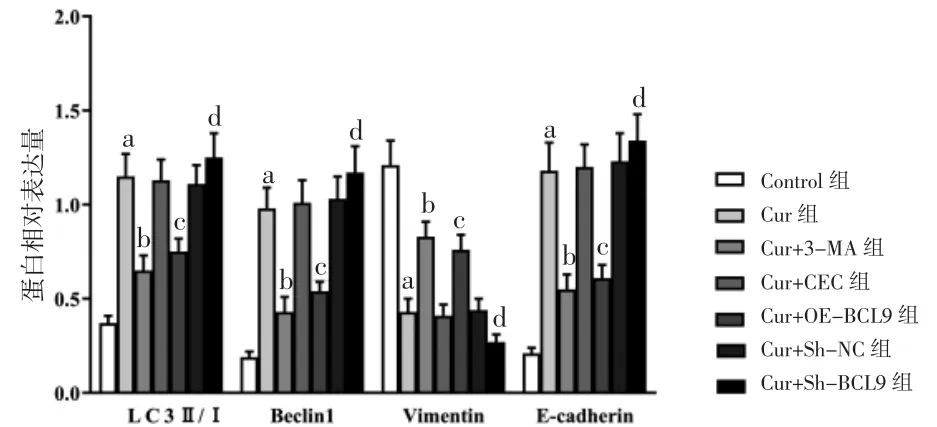
图8 各组细胞自噬及EMT 相关蛋白相对表达量比较(,n=6)
3.6 各组细胞BCL9、β-Catenin蛋白相对表达量比较 Cur组BCL9、β-Catenin蛋白相对表达量明显低于Control组(P<0.05);Cur+3-MA组BCL9、β-Catenin蛋白相对表达量高于Cur组(P<0.05);Cur+OE-BCL9组β-Catenin、BCL9蛋白相对表达量明显高于Cur+VEC组(P<0.05);Cur+Sh-BCL9组BCL9、β-Catenin蛋白相对表达量明显低于Cur+Sh-NC组(P<0.05)。(见图9~10)
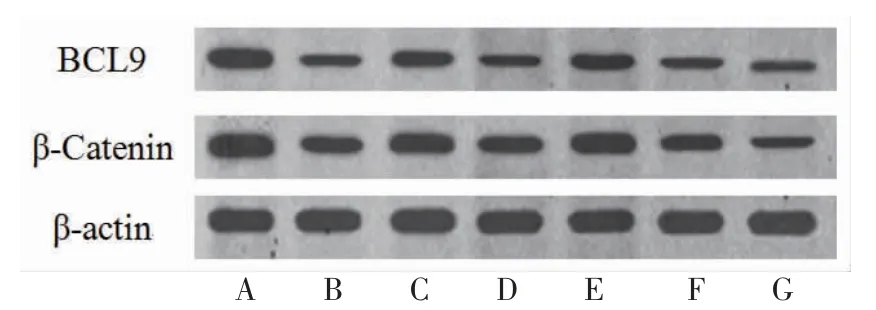
图9 各组HepG2 细胞BCL9、β-Catenin 蛋白表达Western blotting 图
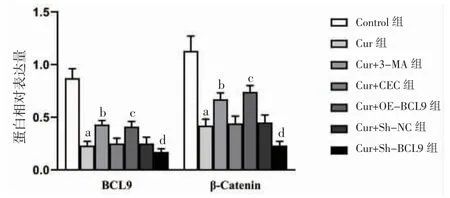
图10 各组HepG2 细胞BCL9、β-Catenin 蛋白相对表达量比较 (,n=6)
4 讨论
细胞自噬是维持细胞稳态的重要机制,自噬与肿瘤发生发展和耐药密切相关。自噬对肝癌的进展具有促进与抑制的双重作用,临床可根据自噬的作用制定靶向治疗HCC的策略[9-10]。姜黄素是姜黄的主要成分,对鼻咽癌、结肠癌、乳腺癌、肺癌等多种肿瘤均有抑制作用。姜黄素的抗肿瘤机制与抑制血管生成、调节细胞自噬、调节基因表达(如p53、Cyclin D等)相关[11-12]。研究[13]显示,姜黄素与5-氟尿嘧啶联用可促进肝癌细胞自噬,抑制细胞增殖。本研究显示,20 μmol/L的姜黄素处理HepG2细胞后,自噬小体形成与细胞凋亡率升高,且姜黄素与自噬抑制剂联合使用,可明显降低HepG2细胞自噬小体形成与细胞凋亡,提示姜黄素可诱导细胞自噬小体形成与凋亡。
LC3Ⅱ与Beclin1是自噬相关标志物,LC3主要介导自噬体的成熟,其水平的高低与自噬体的数量有关,LC3Ⅱ/Ⅰ比值越高表示自噬活性越强[14-15]。Beclin1蛋白可调控自噬前体的形成,引导自噬相关蛋白的定位。Beclin1与相关蛋白形成复合体后,可促进三磷酸磷脂酰肌醇的产生,促进自噬小体的形成[16]。自噬在肿瘤转移过程中发挥重要作用,EMT是癌症转移与侵袭的重要中间阶段,E-cadherin参与调节细胞间黏附作用,Vimentin可维持细胞的完整性和细胞骨架的稳定性,E-cadherin水平降低、Vimentin水平升高是EMT的标志[17]。研究[18]显示,核心蛋白聚糖通过c-Met/Akt/mTOR轴诱导自噬来抑制胶质瘤的侵袭和EMT表型。本研究结果显示,20 μmol/L的姜黄素处理HepG2细胞后,LC3Ⅱ/Ⅰ、Beclin1、E-cadherin表达水平明显升高,细胞迁移与侵袭数及Vimentin蛋白表达水平明显降低,而自噬抑制剂可逆转这一行为,表明姜黄素能通过诱导细胞自噬与凋亡,抑制肝癌细胞转移、侵袭与EMT。
β-Catenin是Wnt通路中Wnt靶基因表达最重要的效应因子。Wnt/β-Catenin信号通路参与调控肿瘤细胞的增殖、凋亡、转移和侵袭,与肿瘤的发生、发展及化疗耐药性密切相关[19]。β-Catenin的激活可促进肝细胞癌的免疫逃逸及增强化疗药物耐药性,从而导致治疗失败[20-21]。BCL9属于Bcl家族成员,β-Catenin需要募集BCL9以介导转录,BCL9可通过β-Catenin途径促进肿瘤细胞的EMT与侵袭[22]。研究[23]显示,BCL9在HCC中表达水平升高,而敲除BCL9基因后,细胞凋亡率明显升高。β-Catenin/BCL9通路在肿瘤的生长与转移过程中发挥重要调控作用[5]。有研究[24]显示,BCL9还与肿瘤细胞自噬有关,下调BCL-9的表达可诱导胶质瘤细胞的凋亡和自噬。本研究显示,姜黄素可明显下调HepG2细胞β-Catenin、BCL9表达水平,提示姜黄素可抑制β-Catenin/BCL9通路激活。过表达BCL9后,HepG2细胞自噬体及迁移与侵袭能力增强,凋亡减少,可减弱姜黄素对HepG2恶性进展的抑制作用,且抑制BCL9表达可促进姜黄素对HepG2恶性进展的抑制作用,表明姜黄素可能通过抑制β-Catenin/BCL9通路,诱导细胞自噬,抑制肝癌细胞迁移、侵袭与EMT。
综上所述,姜黄素能通过抑制β-Catenin/BCL9信号通路,诱导细胞自噬,抑制HepG2细胞恶性生物学行为。



