林 丽,马雪宁,任宇坤,杨素清,闫景东,安月鹏
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
特应性皮炎(atopic dermatitis,AD)是临床常见的一种慢性、瘙痒性、炎症性皮肤病,亦称异位性湿疹。其病情迁延缠绵,给患者的生活造成严重影响[1]。AD的病因多与遗传因素、环境因素、免疫因素及皮肤功能障碍相关[2],现许多学者认为辅助型T细胞1(helper T cell 1,Th1)/辅助型T细胞2(helper T cell 2,Th2)炎症漂移是其免疫因素中的关键机制[3]。临床上常应用糖皮质激素、免疫抑制剂及生物制剂等对AD进行治疗,但存在一定的不良反应且容易复发,在临床应用中受到一定的限制[4]。中医学认为AD发病与血热密不可分,且在血热的基础上,又经风邪袭表,入里化热,成血热风燥之势[5]。地黄饮出自《医宗金鉴》,由生地黄、熟地黄、玄参、当归、白蒺藜、牡丹皮、红花、僵蚕、陈皮、甘草组成。全方养血活血,祛风止痒,与AD的病机吻合[6]。本研究采用2,4-二硝基氯苯(2,4-dinitrochlorobenzene,DNCB)反复刺激的方法诱导AD小鼠模型,观察地黄饮对模型小鼠的皮损炎症程度、脏器指数、病理变化、肥大细胞浸润情况的调控作用,同时检测血清IgE、Th1型细胞因子IFN-γ及Th2型细胞因子IL-4水平并对其与皮损炎症程度的相关性进行分析,以探寻地黄饮对AD小鼠的药效作用及机制。
1 材料与方法
1.1 动物 健康SPF级雌性BALB/c小鼠36只,体质量(20±2)g,6周龄,购于辽宁长生生物技术股份有限公司,动物生产许可证号:SCXK(辽)2020-0001。小鼠饲养环境空气流动,12 h/12 h明暗交替,温度(22±2)℃,相对湿度50%~70%,自由饮水进食,食用标准饲料,适应性饲养7 d。本次实验通过黑龙江中医药大学附属第一医院动物伦理委员会批准(批准号:20200911-06)。
1.2 试剂与药物 地黄饮(方药组成:制何首乌10 g,生地黄25 g,熟地黄15 g,玄参15 g,当归15 g,白蒺藜20 g,牡丹皮15 g,红花5 g,僵蚕15 g,陈皮20 g,甘草10 g),购自黑龙江中医药大学附属第一医院草药局,由王萍主任药师鉴定药材为正品。润燥止痒胶囊(批号:2206032)购自国药集团同济堂(贵州)制药有限公司;石蜡(批号:2203167)购自Leica公司;无水乙醇(批号:B221117-1)购自天津永大化学试剂有限公司;苏木素伊红染色试剂盒(批号:081622221111)购自Beyotime公司;甲苯胺蓝(批号:20220721)购自Solarbio公司;DNCB(批号:P2067548)购自damas-beta公司;小鼠免疫球蛋白E(IgE)酶联免疫试剂盒(批号:11/2022-YJ037602)、小鼠白介素-4(IL-4)酶联免疫试剂盒(批号:11/2022-YJ063156)、小鼠γ 干扰素(IFN-γ)酶联免疫试剂盒(批号:11/2022-YJ002277)均购自上海酶联生物科技有限公司。
1.3 仪器 4 ℃冰箱(海尔集团电器有限公司,型号:SC-320D);-80 ℃冰箱(日本Panasonic公司,型号:MDF-382E);超净工作台(苏州安泰空气技术有限公司,型号:SW-CJ-ZFD);电子天平(瑞士METTLER TOLEDO公司,型号:ME104E);高压蒸汽灭菌器(日本Panasonic公司,型号:MLS-3751L-PC);纯水系统(美国Millipore公司,型号:TANKPE0600);移液枪(德国Eppendorf公司,型号:3120000);显微镜(日本OLYMPUS公司,型号:BX53);制冰机(常熟雪科电器有限公司,型号:IMS-50);脱水机[科迪制冷设备(昆山)有限公司,型号:KD-TS3A];轮转式切片机(德国Leica公司,型号:HistoCore MULTICUT);生物组织摊烤烘片机[科迪制冷设备(昆山)有限公司,型号:KD-TI];冷冻包埋机[科迪制冷设备(昆山)有限公司,型号:KD-BMIII];恒温振荡器(上海一恒科技有限公司,型号:THZ-98AB);低温离心机(美国Thermo公司,型号:SORVALL ST8/8R);酶标仪(美国Thermo公司,型号:Mulitiskan FC)。
1.4 分组及造模 36只小鼠采用随机数字表法分为空白组、模型组、对照组、地黄饮低剂量组、地黄饮中剂量组、地黄饮高剂量组,每组6只。参考文献建模方法[7-8],将小鼠背部3 cm×2 cm区域进行脱毛处理,除空白组外,其余各组第1、4、7天用移液枪向背部涂抹150 μL 1%DNCB溶液进行致敏激发皮损,并于第15、17、19、21、23、25、27天用移液枪向背部涂抹150 μL 0.5% DNCB溶液维持皮损;空白组在相同时间节点、相同位置涂抹等剂量的基质[V(丙酮):V(橄榄油)=1:4]。实验共28 d,于第29天取材。若模型组小鼠背部出现水肿剥脱、糜烂渗液或干燥鳞屑,且皮损炎症程度评分与空白组比较,差异有统计学意义(P<0.05),则造模成功。
1.5 药物制备及给药 地黄饮每剂药量为155 g,加入8倍蒸馏水并浸泡40 min,冷凝回流1 h提取药液并滤出;再加入6倍蒸馏水,冷凝回流40 min提取药液并滤出。将2次滤液合并混匀,于70~80 ℃恒温水浴箱中浓缩至1 g/mL,存于4 ℃冰箱中备用。对照组予润燥止痒胶囊,将3 g润燥止痒胶囊与5 mL 0.5%CMC-Na共同放入研钵,研磨至不会堵塞灌胃针即可,将溶液转置于10 mL量瓶后定容摇匀备用。于第15~28天每日09:00:00—10:00:00进行灌胃,1次/d。按照人与大鼠体表面积比例计算大鼠给药剂量,地黄饮低、中、高剂量组剂量分别为10.08、20.15、40.30 g(/kg·d)(剂量约为体质量70 kg成年人正常用量的0.5、1、2倍);对照组剂量为780 mg/kg(剂量约为体质量70 kg成年人正常用量的1倍);空白组、模型组予等体积生理盐水灌胃,3.42 mL(/kg·d)。
1.6 观察指标
1.6.1 皮损炎症程度评分 从第1天起每日拍照记录小鼠背部皮损变化。参照临床EASI评分方法,于实验第7、14、21、28天进行皮损严重程度评分,包括红斑、水肿/丘疹,表皮剥脱/抓痕,鳞屑/干燥4个方面,每项评分按0~3分的4级评分法,分值越大则皮损炎症程度越高,评分标准见表1。

表1 皮损炎症程度评分表
1.6.2 脏器指数 第28天给药后禁食12 h,第29天称取小鼠体质量,以1%戊巴比妥钠腹腔注射(50 mg/kg)麻醉小鼠,眼球目内眦取血后处死,摘取脾脏及胸腺,称量质量,并计算脏器系数。脏器系数=脏器质量/体质量。
1.6.3 皮肤组织病理变化 将各组小鼠受损皮肤组织置于4%多聚甲醛溶液中固定后,制备成4 μm皮损组织石蜡切片,经二甲苯Ⅰ、Ⅱ、Ⅲ及梯度乙醇脱蜡,苏木素染色5 min,伊红染色2 min后梯度乙醇脱水,中性树胶封片,于显微镜下观察组织病理学变化并采集图像进行分析。
1.6.4 肥大细胞浸润情况 将各组小鼠受损皮肤组织切片、脱蜡,甲苯胺蓝染色5min,蒸馏水冲洗5min,95%乙醇分化2min,分别浸入无水乙醇Ⅰ、Ⅱ及二甲苯Ⅰ、Ⅱ各2 min,中性树胶封片,于显微镜下观察肥大细胞浸润情况并采集图像进行分析统计。
1.6.5 血清IgE、IFN-γ、IL-4水平 采用ELISA法检测小鼠血清IgE、IFN-γ、IL-4水平,将各组小鼠的血液置于2 mL圆底离心管,在4 ℃、3 000 r/min、离心半径138 mm的条件下离心10 min分离血清。设置标准品孔和样本孔,标准孔加不同浓度标准品50 μL,样本孔先加样品稀释液40 μL,再加待测样品10 μL,每孔加入酶标试剂100 μL(空白对照孔不加样品及酶标试剂,其余各步操作相同),37 ℃温育60 min,洗涤,每孔先后加入显色剂A、B各50 μL,37 ℃避光显色15 min,加终止液50 μL终止反应,450 nm波长依序测量各孔OD值。绘制标准曲线并计算IgE、IFN-γ、IL-4含量。
1.7 相关性分析 分别将血清IgE、IFN-γ、IL-4与皮损炎症程度评分进行双变量回归分析,计算出相应的回归曲线方程和相关系数(r),探讨其与皮损之间的相关性。
1.8 统计学方法 通过SPSS 26.0及GraphPad Prism 8.0.2软件进行处理,计量资料以“均数±标准差”()表示。应用单因素方差分析进行组间比较,LSD-t检验进行两两比较,重复测量计量资料采用重复测量资料的方差分析,双变量线性回归分析进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠皮损炎症程度评分比较 所有小鼠不同时间皮损炎症程度评分比较,差异有统计学意义(P<0.01),即存在时间效应。各组小鼠皮损炎症程度评分总体比较,差异有统计学意义(P<0.01),即存在分组效应。空白组小鼠背部未出现皮损,整体状态良好;模型组小鼠背部出现水肿剥脱及糜烂渗液,部分可见干燥鳞屑及苔藓样变,与AD典型表现相符,皮损炎症程度评分高于空白组(P<0.05),说明DNCB能够有效诱导AD,造模成功。经治疗后,与模型组比较,其余各组皮损均呈不同程度改善。第21、28天,对照组及地黄饮低、中、高剂量组小鼠皮损炎症程度评分均低于模型组(P<0.01或P<0.05);地黄饮中、高剂量组皮损炎症程度评分低于对照组(P<0.05)。时间因素与分组因素存在交互效应(P<0.01),即各组小鼠皮损炎症程度评分降低幅度不一致。(见表2,图1~2)

图1 各组小鼠皮损图

图2 皮损炎症程度评分交互效应轮廓图
表2 各组小鼠皮损炎症程度评分比较 (,分)

表2 各组小鼠皮损炎症程度评分比较 (,分)
注:F时间主效应=9.501,P时间主效应=0.000;F分组主效应=34.486;P分组主效应=0.000;F交互效应=3.767;P交互效应=0.000;与空白组比较,aP<0.05;与模型组比较,bP<0.05,cP<0.01;与对照组比较,dP<0.05。
?
2.2 各组小鼠脏器指数比较 模型组小鼠脾脏指数高于空白组(P<0.05);对照组及地黄饮中、高剂量组胸腺指数低于模型组(P<0.01);对照组及地黄饮低、中、高剂量组脾脏指数均低于模型组(P<0.05或P<0.01);地黄饮高剂量组脾脏指数低于对照组及地黄饮低、中剂量组(P<0.01)。(见表3)
表3 各组小鼠脏器指数比较 (,mg/g)
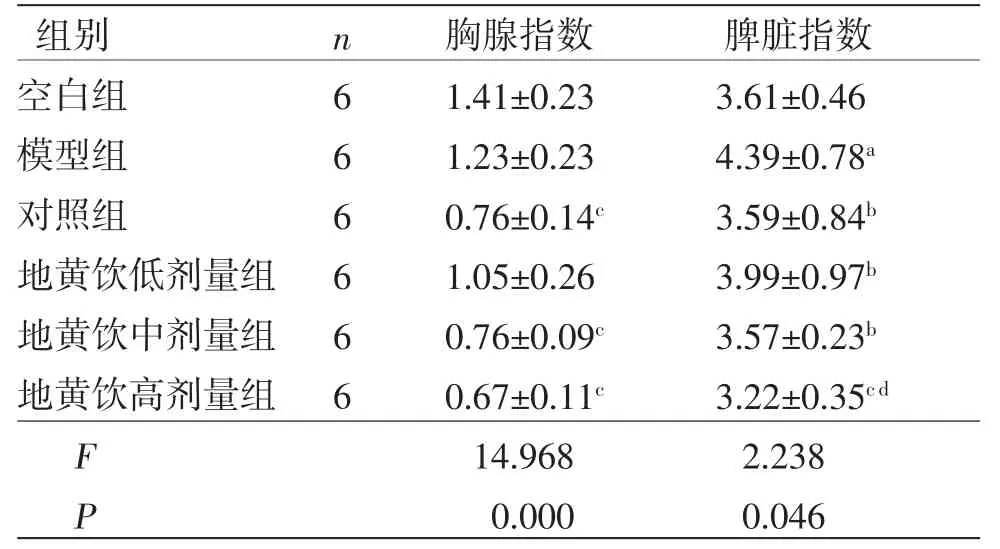
表3 各组小鼠脏器指数比较 (,mg/g)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05,cP<0.01;与对照组比较,dP<0.05。
?
2.3 皮肤组织病理变化 空白组小鼠皮肤表皮较薄,表皮与真皮交界清晰,无水肿及淋巴细胞浸润;模型组小鼠表皮较厚,角质层存在角化过度或不全,棘层肥厚、水肿,真皮层较厚且伴有大量炎症细胞浸润,提示造模成功;对照组及地黄饮低、中、高剂量组表皮及真皮轻度肥厚,存在少量炎症细胞浸润。(见图3)
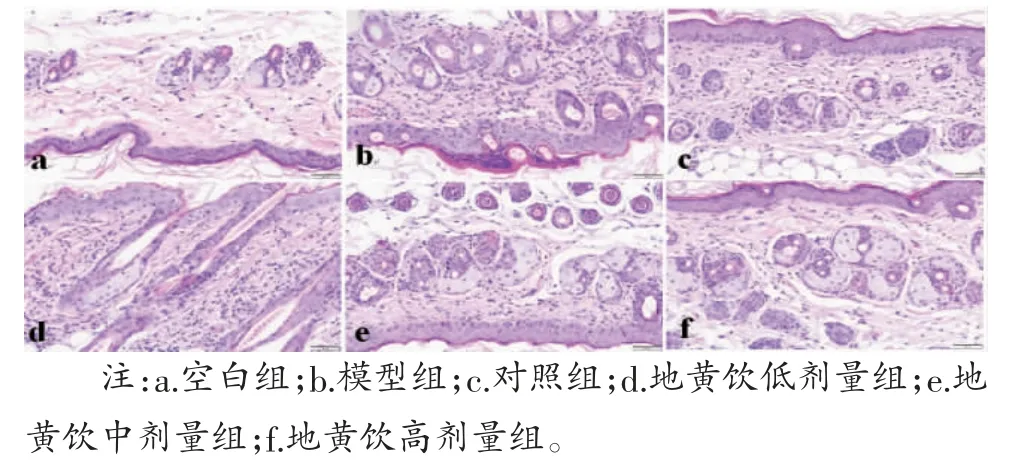
图3 各组小鼠皮肤组织形态 (HE,×200)
2.4 肥大细胞浸润情况 空白组小鼠皮肤真皮层中可见零星肥大细胞;模型组小鼠皮损部位真皮层肥大细胞数量高于空白组(P<0.05),部分呈脱颗粒状态;对照组及地黄饮低、中、高剂量组肥大细胞浸润程度较低,肥大细胞数量低于模型组(P<0.01)。(见表4,图4)
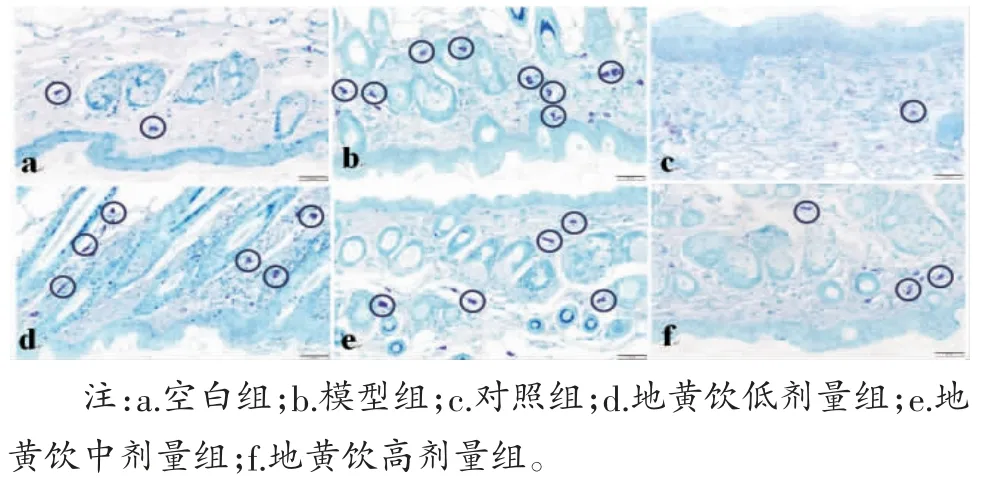
图4 各组小鼠皮肤真皮层中肥大细胞浸润情况(免疫组化,×200)
表4 各组小鼠皮肤组织中肥大细胞数目比较 (,个)
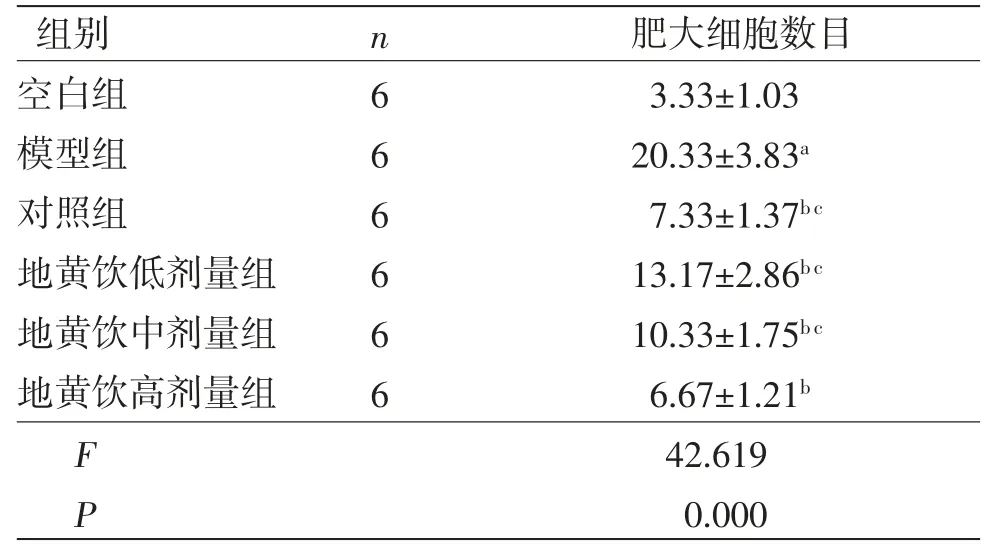
表4 各组小鼠皮肤组织中肥大细胞数目比较 (,个)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.01;与对照组比较,cP<0.05。
?
2.5 各组小鼠血清IgE、IFN-γ、IL-4水平比较 模型组小鼠血清IgE、IL-4水平高于空白组(P<0.05),血清IFN-γ水平低于空白组(P<0.05);对照组与地黄饮低、中、高剂量组小鼠血清IgE、IL-4水平均低于模型组(P<0.05或P<0.01),血清IFN-γ水平均高于模型组(P<0.05或P<0.01)。(见表5)
表5 各组小鼠血清IgE、IFN-γ、IL-4 水平比较 ()

表5 各组小鼠血清IgE、IFN-γ、IL-4 水平比较 ()
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05,cP<0.01;与对照组比较,dP<0.05。
?
2.6 相关性分析 通过对治疗后模型组、对照组及地黄饮低、中、高剂量组小鼠血清中IgE、IFN-γ、IL-4水平与各组小鼠皮损炎症程度评分进行双变量回归分析,求得直线回归方程:Y=0.981bX+12.521(r=0.552,P<0.05);Y=-61.337bX+1214.837(r=-0.568,P<0.05);Y=7.865bX+204.306(r=0.558,P<0.05),差异有统计学意义。(见图5)
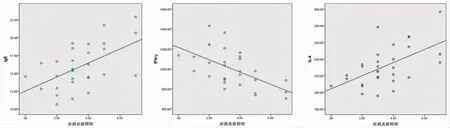
图5 血清IgE、IFN-γ、IL-4 含量与小鼠皮损炎症程度评分相关性分析散点图与直线拟合
3 讨论
AD是一种全身炎症性疾病,常在儿童期初发,可持续至成年,严重影响患者的生活质量[9-10]。现代医学认为该病与机体免疫功能、遗传基因和皮肤屏障等因素相关,但具体发病机制尚不明确[11]。目前西医治疗特应性皮炎多采用糖皮质激素、抗组胺药、钙调磷酸酶抑制剂、光疗和生物制剂等手段[1],虽可以取得确切治疗效果,但其疗效持续时间较短,易产生药物依赖现象,停药后易反弹,且费用较高,导致患者接受度有限。中医药治疗AD可显着减轻皮损与瘙痒程度,减少迁延,在缓解症状及降低复发率方面具有一定的优势。
中医药治疗AD经历了长期的临床实践。《医宗金鉴·外科心法要诀》记载:“血风疮证生遍身,粟形搔痒脂水淫,肝肺脾经风湿热,久郁燥痒抓血津。”“此证由肝、脾二经湿热,外受风邪,袭于皮肤,郁于肺经,致遍身生疮。形如粟米,瘙痒无度,抓破时,津脂水浸淫成片。”风湿热邪侵袭肝、脾、肺经,郁久化风,内外风邪共盛,耗血生火,灼烧阴津,瘙痒难耐,而致本病迁延难愈。本病患者内受湿热之邪,外感风邪,为本虚标实之证,与机体脾气不盛,正气不足相关[12]。故中医学认为AD患者平素禀赋不耐,脾土运化不利,湿热内生,又外感风邪,入里化热,而成血热风燥之势,治宜凉血活血,搜风止痒[13-14]。地黄饮出自《医宗金鉴》。方中生地黄、熟地黄滋阴养血为君药。熟地黄偏补血,生地黄偏凉血,两者同用补而不燥[15-16]。何首乌生于春气,为风木之化而通肝经,生用重补益,制用重养血,临床实际应用时因其存在肝肾毒性,可酌情去之[17]。三者共为君药。当归补血活血,红花活血调经,两者助熟地黄养血活血之力。玄参濡润,既能滋阴,又能降浮火,与熟地黄相合攻补兼施。当归、红花、玄参共为臣药。僵蚕、白蒺藜祛风止痒平肝,牡丹皮清热凉血,陈皮顺气燥湿,共为佐药。甘草为使药,起调和之用。全方凉血活血,疏风止痒,补而不燥,凉润以滋养一身之肌表,攻补兼施,调理脾气,标本同治。药理学研究表明,生地黄、熟地黄、何首乌均具有调控免疫系统作用。目前,地黄饮已广泛应用于特应性皮炎的临床治疗,临床疗效佳,但其治疗AD的作用机制研究较为少见。基于此,本研究拟制备AD小鼠模型,以地黄饮进行干预,探讨地黄饮治疗AD的效果,并基于Th1/Th2免疫失衡机制进一步探索其可能作用机制。
免疫失衡为AD发生发展过程中最为重要的病理环节,尤以Th1/Th2失衡为主。两者失去动态平衡并向以Th2型细胞为主的免疫环境倾斜[18-19]。Th2型细胞能够产生大量IgE及IL-4等炎症细胞因子[20-21],IL-4亦可间接活化肥大细胞[22]。活化的肥大细胞可产生一系列炎症因子,与B淋巴细胞、T细胞等相互作用,进一步引起炎症级联反应[23-24]。同时,大量分泌的Th2型细胞因子与以IFN-γ为主的Th1型细胞因子形成拮抗[25]。此外,经上述反应后,效应T细胞在外周血中呈高表达状态,可诱导Th1型细胞凋亡并使Th2型细胞含量上升[26-27]。因此,抑制Th2型细胞因子表达、调控肥大细胞活化、减轻炎症反应在抑制AD的发生发展中至关重要。本研究结果显示,在DNCB的刺激下,小鼠真皮层增厚并伴大量炎症细胞浸润,皮损炎症程度评分升高,肥大细胞数量增加,脾脏指数上升,小鼠血清IgE、Th2型细胞因子IL-4水平上升,Th1型细胞因子IFN-γ水平下降,说明DNCB能够加速肥大细胞脱颗粒进程,促进其活化,并同时对Th1/Th2炎症平衡造成影响。结果显示,地黄饮可改善小鼠皮肤组织炎炎症细胞浸润情况,降低皮损炎症程度评分,减少肥大细胞数量,降低小鼠血清IgE、IL-4水平而升高IFN-γ水平,说明地黄饮能够减轻肥大细胞活化,并可能通过影响脾脏功能而降低淋巴细胞的募集,促进倾斜于Th2型细胞的免疫环境回正,改善炎症反应。且地黄饮高剂量组的效果较优。同时,血清IgE、IL-4与小鼠皮损炎症程度评分呈正相关关系,IFN-γ与小鼠皮损炎症程度评分呈负相关关系,亦证明地黄饮可能通过调控Th1/Th2免疫平衡环境而对AD起到治疗作用。
综上所述,地黄饮能够明显减轻AD小鼠的皮肤炎症细胞浸润,改善皮肤病理情况,降低淋巴细胞募集、B细胞的产生及肥大细胞活化,降低血清IgE水平并调控炎症环境。地黄饮可能通过减少肥大细胞浸润,使免疫环境向Th2型细胞偏移的程度降低,减少Th2型炎症因子分泌而对AD起到治疗作用。



