谭玉婷,鲁卫星,赵俊男
1 北京中医药大学,北京100029;2 北京中医药大学第三附属医院
谭玉婷1,鲁卫星2△,赵俊男1
1 北京中医药大学,北京100029;2 北京中医药大学第三附属医院
目的:观察龙牙木总皂苷、MitoKATP激活剂二氮嗪(DZ)、MitoKATP抑制剂5-羟基癸酸(5-HD)、龙牙+5-HD对大鼠缺血再灌注损伤(ischemia reperfusion injury,IRI)心肌线粒体细胞色素C和膜电位的影响,并探讨龙牙木总皂苷在减轻MIRI中的作用及其机制。方法:将60只雄性Wistar大鼠随机分为对照组(假手术组)、模型组、DZ组、5-HD组、龙牙组和龙牙+5-HD组,每组10只,建立Langendorff离体心脏灌流模型。对照组只穿线不结扎,以改良K-H液持续平衡灌流105分钟;其余5组均穿线结扎冠状动脉停灌30分钟,再分别以改良K-H液、DZ、5-HD、龙牙木总皂苷、龙牙+ 5-HD复灌75分钟(其中龙牙+ 5-HD组以5-HD复灌15分钟继以龙牙木总皂苷复灌60分钟)。提取线粒体,western-blot半定量测定线粒体内细胞色素C水平,荧光酶标仪测线粒体膜电位。结果:龙牙组线粒体细胞色素C释放减少,膜电位较高,与模型组、5-HD组、龙牙+ 5-HD组相比差异有统计学意义(P<0.05),与DZ组相比差异无统计学意义(P>0.05)。结论:龙牙木总皂苷在MIRI时起到保护作用,能减少MIRI时细胞色素C的释放,稳定线粒体膜电位,其作用可能与mitoKATP的开放有关。
龙牙木总皂苷;缺血再灌注损伤;线粒体;细胞色素C;膜电位
近年来冠心病(CHD)发病人数日渐增多,急性心肌梗死(AMI)患者呈多发、高危、集中的趋势,在临床上也常以AMI的死亡率来代表冠心病的死亡率。随着溶栓疗法、经皮冠状动脉介入治疗、冠脉搭桥、心肺脑复苏、心脏外科体外循环等治疗手段在心血管疾病治疗中的应用越来越广泛,如何防治缺血再灌注损伤(IRI)成为临床常见问题。线粒体是细胞进行氧化磷酸化反应的主要场所,同时也是心肌能量供应场所,在维持钙稳态的平衡、调控膜电位、抑制细胞凋亡、进行细胞内信息传递等方面发挥重要的作用,线粒体结构和功能的变化是IRI发生和发展的重要因素。线粒体内膜上存在ATP敏感性钾通道 (MitoKATP),MitoKATP是一种受细胞内ATP调控,对K+高度通透的(聚)多亚基蛋白复合体[1],对生物膜的稳定性、线粒体及心肌细胞正常功能的维持都有非常重要的作用。研究表明,MitoKATP是IRI防治的重要靶点,开放MitoKATP对缺血再灌注损伤心肌有保护作用。细胞色素C是线粒体呼吸链的重要组成部分,释放到胞质后触发Caspase级联,导致细胞程序性死亡[2]。膜电位是评价线粒体的重要指标,反映线粒体的功能。龙牙楤木总皂苷为五加科植物,味辛性平有小毒,具有补气安神,强精滋肾,祛风除湿,活血止痛,健胃利水之功,现代药理研究表明其有抗心肌缺血的作用[3]。本文通过测定大鼠缺血再灌注损伤(MIRI)心肌细胞线粒体中细胞色素C的相对表达量及线粒体膜电位,探讨龙牙楤木总皂苷在MIRI中的作用。
1 材料与方法
1.1 动物 雄性Wistar大鼠60只,购自北京华阜康生物科技股份有限公司,实验动物许可证号:SCXK(京)2009-0007。
1.2 试剂 线粒体-胞浆蛋白制备试剂盒(C1260)、RIPA裂解缓冲液(C1053)、蛋白酶抑制剂混合物(P1265)、BCA法蛋白定量试剂盒(P1511)、5×SDS-PAGE非还原性蛋白上样缓冲液(B1030)、1M Tris-Hcl PH6.8(B1002)、1M Tris-Hcl PH8.0 (B1011)、ImBlotter-NC硝酸纤维素膜(P2115)、Super ECL超敏发光液(P1020)、柯达X光胶片(E1112)均购自北京普利莱基因技术有限公司;山羊抗小鼠IgG、5×上样缓冲液、10×电泳缓冲液、10×TBST 均购自北京赛诺博公司;Cytochrome C (SC-13156)、DAB显色试剂盒(9017),购自北京中山金桥生物技术有限公司;线粒体内参COX IV (A01060),购自武汉艾美捷科技有限公司;彩色预染超低分子蛋白质分子量标准(AR1117),购自武汉博士德生物工程有限公司;胎牛血清白蛋白BSA(0332),购自Amresco;线粒体膜电位检测试剂盒(JC-1)购自北京泛博生物化学有限公司。
1.3 仪器 Langendorff,AD Instruments Pty Ltd实验室,ML870B2 Langendorff System;恒温水浴,LETIC公司;蠕动泵,Gilson公司;多导生理仪(美国Biopac公司);Fresco低温冷冻离心机(Thermo公司);全波长酶扫描仪(Thermo公司);湿转电泳槽(Cavoy);电泳仪(Bio-Rad);37℃生化培育箱(上海福玛实验设备有限公司);水平脱色摇床、涡旋震荡器,其林贝尔仪器制造有限公司;荧光分光光度计(Hitachi Limited公司);核酸蛋白分析仪(Beckman Coulter公司);电子显微镜(奥林巴斯公司);保湿盒(协力塑料制品厂);石蜡切片机、自动封片机,Leica公司;手持电动匀浆器(宁波新芝生物科技股份有限公司);10、200 μL、1 mL移液枪(Eppendorf);电子天平(上海精密科学仪器有限公司)。
1.4 实验方法
1.4.1 动物分组 采用随机数字表法将大鼠随机分为6组,分别为对照组、模型组、DZ组、5-HD组、龙牙组和龙牙+ 5-HD组,每组10只。
1.4.2 动物模型制备 建立Langendorff离体心脏灌流模型。将大鼠称重,1×103U/kg腹腔注射肝素,充分肝素化后按1 mg/kg腹腔注射戊巴比妥麻醉。动物固定,开胸暴露主动脉弓,镊子夹紧主动脉弓分支前,剪断主动脉,将取下的心脏放入预冷的K-H液中去血。提着主动脉断端插入Langendorff灌注管中,0号线固定心脏,逆行灌入含有95% O2和CO2的37℃K-H液平衡20分钟(流速为10 mL/min)。剪开右心耳流出灌流液,剪开左心耳,破开二尖瓣,将心室内压球囊放入左心室,压力感受器连接多导生理仪,记录心脏电生理活动。入组标准为:心律齐,心率≥220次/min,左室收缩压≥60 mmHg(1 mmHg=0.133 kPa)[4]。对照组:只穿线不结扎,以改良K-H液持续平衡灌流105分钟。模型组:穿线结扎冠状动脉左前降支近分支处停灌30分钟,K-H液复灌75分钟。DZ组:穿线结扎冠状动脉左前降支近分支处停灌30分钟,以含50 μmol/L二氮嗪的K-H液复灌75分钟。5-HD组:穿线结扎冠状动脉左前降支近分支处停灌30分钟,以含100 μmol/L 5-HD的K-H液复灌75分钟。龙牙组:穿线结扎冠状动脉左前降支近分支处停灌30分钟,以含5 mg/L龙牙楤木总皂苷的K-H液复灌75分钟。龙牙+5-HD组:穿线结扎冠状动脉左前降支近分支处停灌30分钟,先予含100 μmol/L 5-HD的K-H液复灌15分钟,再以含5 mg/L龙牙楤木总皂苷的K-H液复灌60分钟。
1.4.3 线粒体内蛋白的提取 从液氮罐中取出冻存的心肌组织,称重后放在平皿内,迅速在冰上将其剪成碎块,放入预冷的玻璃匀浆器中。加入1.5 mL预冷的mito solution,在冰水浴中上下研磨20次左右至浆液状,将其移入离心管中。4℃离心机离心5分钟。弃沉淀,上清转移到新的离心管中。4℃离心机再次离心5分钟,弃去沉淀,上清转移到新的离心管。4℃离心机离心10分钟,上清为胞浆成分,沉淀即为线粒体。沉淀中加200 μLmito solution,涡旋震荡,4℃离心机离心10 分钟进行线粒体的洗涤,弃去上清,沉淀为洗涤后的线粒体。沉淀中加入100 μL RIPA裂解缓冲液,涡旋震荡,冰水浴中静置10分钟,4℃离心机离心10分钟,上清为裂解的线粒体,吸取分装。
1.4.4 蛋白定量 (BCA法) 将标准蛋白倍比稀释,线粒体蛋白进行10倍稀释。BCA Reagent与Cu Reagent 50∶1混合配成工作液。96孔板中加入工作液和标准品、样品,37℃反应30分钟。放入酶标仪中,测570 nm的光密度(OD)值,绘制标准曲线,计算出样品的实际蛋白浓度(mg/mL)。
1.4.5 western-blot半定量测线粒体内细胞色素C 配15%分离胶和5%浓缩胶,线粒体蛋白上样。电泳恒压100 mV,跑至浓缩胶和分离胶之间改为恒压170 mV,继续电泳时间约1小时。恒流300 mA转膜1小时,转膜完成后丽春红染色试剂对膜进行染色,观察转膜效果。洗去丽春红染液,将膜完全浸没在3%BSA-TBST中,室温轻摇30分钟进行封闭。孵育一抗,一抗(Cytochrome C)稀释滴度为1∶40 000(线粒体),线粒体内参COX IV(鼠单抗)稀释滴度为1∶5 000。室温孵育10分钟,放4℃过夜。第2天从4℃拿出膜,TBST洗5次,10 min/次。5%脱脂奶粉-TBST稀释二抗(山羊抗鼠IgG,HRP标记),二抗稀释滴度为1∶10 000,孵育1小时。
TBST洗膜6次,5 min/次。ECL显影,光密度扫描定量分析。
1.4.6 线粒体膜电位的测定 应用上海杰美基因提供的线粒体提取试剂盒提取纯化线粒体。线粒体膜电位检测试剂盒 (JC-1)检测线粒体膜电位:1)JC-1染色工作液(200×)在25℃水浴箱中完全溶解,按每50 μL加入8 mL超纯水的比例稀释JC-1,涡旋振荡充分混匀,将配好的JC-1染色工作液用JC-1染色缓冲液5倍稀释,冰槽静置。2) 0.9 mLJC-1染色工作液加入0.1 mL总蛋白量为10~100 μg纯化线粒体。3)荧光酶标仪检测:检测JC-1单体时将激发光设置为490 nm,发射光设置为530 nm。检测JC-1聚合物时将激发光设置为525 nm,发射光设置为590 nm。
1.5 统计学方法 应用SPSS 17.0统计软件分析,计量资料以表示,组间比较用单因素方差分析或秩和检验,P<0.05表示差异有统计学意义。
2 结果
2.1 线粒体内细胞色素C表达 线粒体细胞色素C相对量模型组低于对照组、DZ组和龙牙组,差异有统计学意义(P<0.05);模型组高于5-HD组、龙牙+5-HD组,差异有统计学意义(P<0.05);DZ组与龙牙组比较,差异无统计学意义(P>0.05)。5-HD组与龙牙+ 5-HD组比较,差异无统计学意义(P>0.05)。见表1、图1—2。
表1 线粒体和胞浆细胞色素C表达相对量
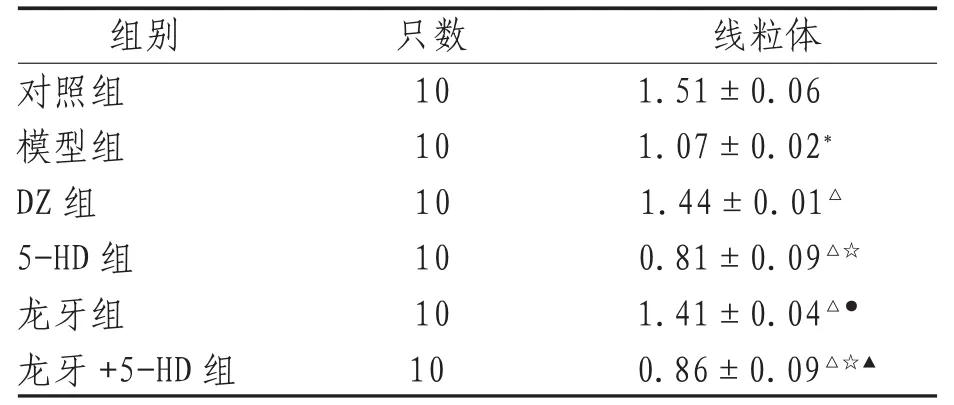
表1 线粒体和胞浆细胞色素C表达相对量
注:*表示与对照组比较,P<0.05;△表示与模型组比较,P<0.01;☆表示与模型组、DZ组、龙牙组比较,P<0.01;●表示与DZ组比较,P>0.05;▲表示与5-HD组比较,P>0.05 (下同)。
?

图1 线粒体细胞色素C及内参COXIV
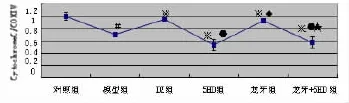
图2 线粒体细胞色素C相对表达量
2.2 线粒体膜电位 用绿红荧光的相对比例衡量膜电位,激发光490 nm发射光530 nm得到的数值与激发光525 nm发射光590 nm得到的数值作一个相对值,数值越大,膜电位越低。结果显示模型组膜电位明显降低,与对照组比较,差异有统计学意义(P<0.01)。DZ组、龙牙组膜电位有所下降,与模型组比较,差异有统计学意义(P<0.01)。5-HD组、5龙组膜电位明显降低,与模型组、DZ组、龙牙组比较,差异有统计学意义(P<0.01)。DZ组与龙牙组比较,差异无统计学意义(P>0.05)。5-HD组与5龙组比较,差异无统计学意义(P>0.05)。见表2、图3。
表2 线粒体膜电位
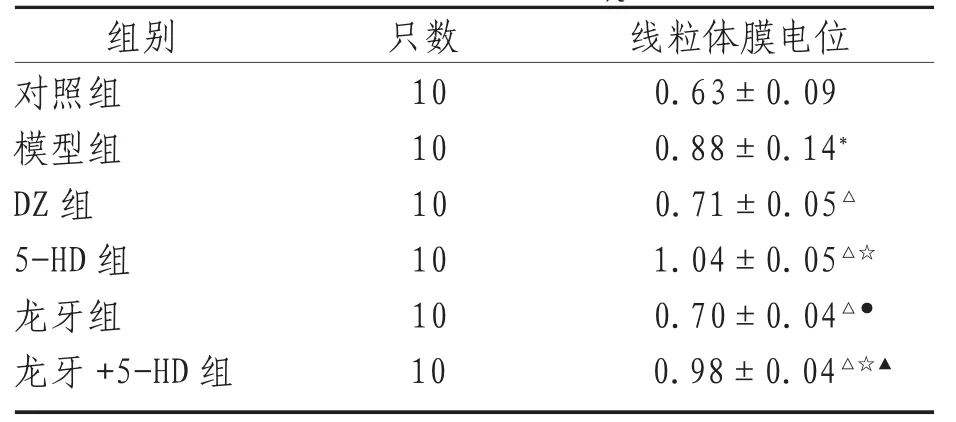
表2 线粒体膜电位
?
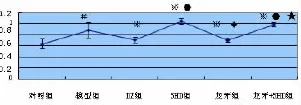
图3 线粒体膜电位
3 讨论
细胞色素C是呼吸链中传递电子的载体,它结合于线粒体内膜的外侧而不能通过外膜。国内外的大量研究已证实MitoKATP在心肌缺血再灌注损伤中有重要的保护作用,抑制MitoKATP能够促使线粒体膜电位崩溃和细胞色素C的释放[3-6]。释放到胞浆中的细胞色素C与细胞凋亡蛋白活化因子Apaf-1聚合,激活Caspase-9及Caspase-3,引起Caspase级联反应[7],引发细胞凋亡。杨睿瑶[8]通过建立大鼠在体缺血再灌注损伤模型并给予心肌缺血预处理,观察细胞色素C的表达,得出细胞色素C与细胞凋亡关系密切,MitoKATP开放剂二氮嗪能有效保护心肌缺血再灌注损伤。本实验通过western-blot免疫印迹检测线粒体中细胞色素C的相对含量,得出MIRI发生时,线粒体释放细胞色素C到胞浆中,本来在胞浆中含量极少的细胞色素C增加,MitoKATP激活剂二氮嗪和龙牙楤木总皂苷能明显减少细胞色素C的释放,保护线粒体功能,减轻MIRI,但这种作用会被MitoKATP抑制剂所抑制。
线粒体跨膜电位(△Ψm)的形成是由位于线粒体内膜的质子泵将线粒体内的质子泵到外室形成的,跨膜电位内负外正。正常的跨膜电位是维持线粒体功能所必须的。当MIRI发生时,氧自由基使线粒体膜发生脂质过氧化反应,大量Ca2+进入线粒体内,激活磷脂酶进一步损伤膜磷脂,线粒体膜通透性增加,膜内外的电势差下降,膜电位降低,线粒体正常功能受到严重损伤。Ozcan等[9]发现二氮嗪预处理后的缺血再灌注大鼠ROS明显减少,这种作用能被MitoKATP抑制剂5-HD拮抗。Calderone等[10]通过实验证实MitoKATP开放剂二氮嗪在心肌缺血再灌注大鼠能降低线粒体内Ca2+的含量,这种作用与二氮嗪用量呈正相关。MitoKATP对跨膜电位的稳定作用可能与减轻氧化应激和钙损伤有关。JC-1是一种广泛用于检测线粒体膜电位的理想荧光探针,在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,可以产生红色荧光,在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,可以产生绿色荧光,常用红绿荧光的相对比例来衡量线粒体去极化的比例,从红色荧光到绿色荧光的转变作为细胞凋亡早期的一个检测指标。本实验说明MIRI发生时,线粒体膜电位明显下降,龙牙楤木总皂苷能减轻膜电位降低,稳定线粒体膜,保护线粒体功能。
本实验结果证实龙牙楤木总皂苷能够在MIRI起到保护作用,能减少MIRI时细胞色素C的释放,稳定线粒体膜电位,其作用可能与MitoKATP的开放有关。本实验为中医药防治缺血再灌注损伤提供了新的思路和方法,但仍有尚未解决的问题有待继续探索。
[1] 张治国,齐颖.ATP敏感性钾通道抗心肌缺血再灌注损伤机制研究进展[J].包头医学院学报,2011,27(5):116-118.
[2] 常青,王晓良.细胞色素C、线粒体与凋亡[J].中国药理学通报,2003,19(3):241-244.
[3] 李明,鲁卫星.龙牙楤木药理研究进展[J].医学综述,2009,15(20):3157-3160.
[4] 李寒,徐序杰,张载高.离体心脏灌注模型的制备[J].海军总医院学报,2006,19(3):133-135.
[5] 黄康.线粒体通透性转换孔在缺血再灌注损伤中的地位及意义[J].海南医学,2011,23(3):39-42.
[6] 张娜,章怡祎,韩向辉,等.ATP敏感性钾通道与心肌保护的研究新进展[J].中华中医药学刊,2010,28(5):998-1000.
[7] Susin SA,Lorenzo HZ,Zamzami N,et al.Mitochondrial release of caspase-2 and caspase-9 during the apoptotic process[J].Exp Med,1999,189(2):381-394.
[8] 杨睿瑶.线粒体ATP敏感性钾通道在缺血预适应中对心肌缺血-再灌注损伤的保护效应[J].四川医学,2008,29(6):646-648.
[9] Ozcan C,Bienengraeber M,Petras P,et al.Potassium channel openers protect cardiac mitochond ria by attenuation oxidant stress at reoxygenation[J].Am J Physiol Heart Circ Physiol,2002,282(2):531-539.
[10] Calderone V,Testail L,Martelli A,et al.Antiischemic properties of a new spirocyclic benzopyran activator of the cardiac mito-KATP channel[J].Biochem Pharmacol,2010,79(1):39-47.
Study of Effects and Function Mechanism of Aralosides on Mitochondrial Cytochrome C and Membrane Potential of IRI Rat Cardiac Muscle Cells
TAN Yuting1,LU Weixing2△,ZHAO Junnan1
1 Beijing University of Chinese Medicine,Beijing 100029,China; 2 The Third Affiliated Hospital of Beijing University of Chinese Medicine
Objective: To observe the effects of aralosides, MitoKATPDZX, MitoKATP5-HD, LongYa plus 5-HD on mitochondrial cytochrome C and membrane potential of IRI rat cardiac muscle cells, and explore the function and mechanism of aralosides on relieving MIRI. Methods: All 60 male wister rats were randomly divided into the control group( sham operation group), the model group, DZ group, 5-HD group, aralosides group, aralosides plus 5-HD group, each group 10 rats, Langendorff reperfusion model in isolated heart was built. The control group was given threading, not ligation, persistent and balanced perfusion by improved K-H liquid for 105 min. The other five groups were given threading and ligation for coronary artery, perfusion stopped for 30 min, then reperfusion by improved K-H liquid, DZ, 5-HD, aralosides and aralosides plus 5-HD for 75 min( the aralosides plus 5-HD group was reperfused for 15 min, also reperfused by aralosides for 60 min). Mitochondria were extracted, mitochondrial cytochrome C was measured by western-blot semiquantitative analysis. Mitochondrial membrane potential was measured by microplate system. Results: The release of mitochondrial cytochrome C in aralosides group reduced, membrane potential increased, compared with the control group, 5-HD group and aralosides plus 5-HD group, there were statistical differences(P<0.05), compared with DZ group, there were no statistical differences(P>0.05). Conclusion: Aralosides can protect MIRI, reduce the release of mitochondrial cytochrome C in MIRI, stabilize mitochondrial membrane potential, its function might be related to MitoKATPopen.
aralosides; IRI; mitochondria; cytochrome C; membrane potential
R285.5
A
1004-6852(2016)12-0009-04
2016-07-27
国家自然科学基金课题(编号81273691)。
谭玉婷(1988—),女,在读博士研究生。研究方向:心血管疾病的中西医结合治疗。
△通讯作者:鲁卫星(1959—),男,硕士学位,教授,主任医师。研究方向:心血管疾病的中西医结合治疗。



