罗玉清,梁文菲,张 熙,谭梅鑫,刘锦清,夏艺菲,朱芙蓉,熊 武△
1 湖南中医药大学第一附属医院,湖南 长沙 410007; 2 广州中医药大学东莞医院,广东 东莞 523000;3 湖南省脑科医院,湖南 长沙 410007; 4 湖南中医药大学临床医学院,湖南 长沙 410007;5 湖南中医药大学中西医结合学院,湖南 长沙 410208
糖尿病是一类由多种因素引起的以长期血糖浓度升高为主要特征的慢性代谢性疾病,随着社会经济的不断发展,人民生活水平不断提高,糖尿病发病率逐年升高,且趋于年轻化[1]。目前研究表明高糖能诱发一系列氧化应激反应,从而对机体细胞造成损伤。间充质干细胞(mesenchymal stem cells,MSCs)是一类具有自我更新和多向分化潜能的成体干细胞,具有高度增殖能力。有研究表明MSCs可在特定条件下诱导定向分化为内皮细胞并参与血管损伤部位的修复和再生,且能通过分泌肝细胞生长因子(hepatocyte growth factor,HGF)促进内皮细胞增殖、迁移和细胞外基质合成[2-3]。进一步研究发现高糖环境下MSCs 增殖、黏附、迁移和分泌等功能受损。黄芪甲苷(astragaloside IV,AS-IV)是中药黄芪的主要活性成分,具有抗炎、促生长和抗应激等功效[4-5]。刘海萌等[6]研究发现AS-IV可增强骨髓来源MSCs,修复大鼠脑缺血再灌注损伤功能。然而AS-IV 能否改善高糖受损MSCs 功能,目前尚不确定。本研究旨在探讨AS-IV对高糖受损人脐带血MSCs生物学功能及其分泌HGF的影响,为AS-IV用于糖尿病及其并发症的治疗提供依据。
1 材料与方法
1.1 主要药品试剂黄芪甲苷(纯度≥98%,上海源叶生物科技有限公司,批号:S31401);青霉素-链霉素双抗溶液(中国南京凯基生物科技发展有限公司,批号:KGY002);PBS 缓冲液、DMEM/F12 培养基(美国Hyclone 公司,批号:SH30256.01B、SH30023.01B);胎牛血清、胰酶(美国GIBCO 公司,批号:10270-106、15050-057);成脂诱导分化培养基、成骨诱导分化培养基、成软骨诱导分化培养基(美国Cyagen公司,批号:RASMD-90031、HUXMA-90021、HUXUB-90042);茜素红染液、油红O 溶液(美国Sigma 公司,批号:130-22-3RT、O1391-250ML);阿利新蓝染液(中国MesGen 公司,批号:MAS0981);Cell Counting Kit-8(日本同仁公司,批号:CK04);HGF ELISA 试剂盒(上海江莱生物科技有限公司,批号:JL10756)。
1.2 主要仪器XD-101 型CO2培养箱(日本SANYO 公司);5111918 型酶联免疫检测仪(美国Thermo Fisher 公司);BX51 型生物倒置显微镜(日本OLYMPUS 公司);5804 型台式低速离心机、5415R型4 ℃离心机(德国Eppendorf Centrifuge公司);WH-2型振荡器(中国上海沪西分析仪器厂);YXQ-LS-50 型立式压力锅(中国上海博讯公司);101AS-3 型电热鼓风干燥箱(中国上海圣欣公司)。
1.3 方法
1.3.1 hUCBMSCs 培养 无菌条件下取足月健康新生儿胎盘脐带血10 mL(标本采集获产妇和家属同意并签署知情同意书,本研究获得医院伦理委员会批准,批准文号:HN-LL-GZR-201902),加入肝素抗凝,室温下静置30~60 min,取1.077 g/mL淋巴细胞分离液5 mL加入15 mL离心管中,将10 mL细胞悬液(脐带血与PBS 液1∶1 混合稀释)缓慢加入淋巴细胞分离液中。经密度梯度离心后取单个核细胞,移入含5%胎牛血清、1%青霉素-链霉素双抗溶液的DMEM/F12 培养基中,37 ℃培养箱中培养7 天后传代到第3 代冻存。将冻存的P3 代人脐血间充质干细胞(Human umbilical cord blood mesenchymal stem cells,hUCBMSCs)进行细胞复苏后,移入培养皿中,标明细胞名称hUCBMSCs P4代,放入37 ℃培养箱中继续培养。
1.3.2 hUCBMSCs 鉴定 将P4 代hUCBMSCs 冻存细胞复苏,当细胞融合到80%左右时,使用胰酶消化,接种到明胶包被的24 孔板,每组设4 个复孔,置37 ℃,5%CO2培养箱中培养,当细胞融合到60%~70%时,分别按照人脐带血间充质干细胞成骨、成软骨、成脂肪诱导分化培养基试剂盒说明书要求,将细胞移入相应培养基中培养,每3天更换1次培养基,观察细胞形态变化及生长情况,分别用茜素红、阿尔新蓝及油红O 染色以确定细胞成骨、成软骨、成脂肪染色效果。在荧光显微镜下观察染色效果并拍照。
1.3.3 高糖受损hUCBMSCs 模型建立 将鉴定成功的hUCBMSCs用30 mmo1/L的葡萄糖在DMEM/F12培养基培养120 h,建立高糖受损hUCBMSCs 细胞模型。
1.3.4 黄芪甲苷最适浓度确定 将高糖受损hUCBMSCs 取对数生长期细胞胰酶消化,离心收集制成细胞悬液并铺在24 孔板上,分别加入浓度为0、50、100、200、300、400 mg/L 的AS-IV 进行干预,培养48 h 后每孔加入10 μL CCK-8 溶液,4 h 后参照CCK-8试剂盒说明书用酶标仪测定450 nm处的吸光度,并绘制增殖曲线图以确定AS-IV 促hUCBMSCs增殖的最适浓度。
1.3.5 实验分组及处理 将高糖受损hUCBMSCs随机分为实验组和模型组,实验组用最适浓度AS-IV干预,模型组用等体积PBS液处理。并设置正常组,即正常hUCBMSCs(将鉴定成功的hUCBMSCs在5.5 mmo1/L 葡萄糖DMEM/F12 培养基中培养120 h)用等体积PBS液处理。
1.4 高糖受损hUCBMSCs 增殖能力参照CCK-8试剂盒说明书,取对数生长期细胞,使用胰酶消化后,离心收集制成细胞悬液,实验组加入最适浓度AS-IV,模型组和正常组用等量PBS 液处理,48 h后各组均加入10 μL CCK-8溶液,4 h后用酶标仪测定各组细胞在450 nm 处的吸光度。
1.5 高糖受损hUCBMSCs 黏附能力将各组hUCBMSCs 细胞悬液铺在24 孔板上,37 ℃、5%CO2条件下培养1 h,实验组加入最适浓度AS-IV干预,模型组和正常组用等量PBS液处理,培养8 h后将各组hUCBMSCs 接种在含有大鼠纤维连接蛋白的培养板中,37 ℃下静置30 min,随机取2 个200倍视野计数贴壁细胞数目。
1.6 高糖受损hUCBMSCs 迁移能力实验器械消毒灭菌后,用马克笔在6 孔板背后每隔1 cm 划横线一道,横线需横穿过孔,同时每孔至少穿过5 条横线。取对数生长期的hUCBMSCs 置于孔中,每孔约加入5×105个hUCBMSCs细胞,置于37 ℃、5%的CO2培养箱中培养过夜,再用无菌200 μL 枪头在培养孔底部正中央划一道痕迹,PBS液冲洗3次后去除脱落细胞。实验组加入最适浓度AS-IV,模型组和正常组用等量PBS 液处理,培养48 h 后在生物倒置显微镜(200 倍)下测量0 h 和48 h 的划痕面愈合情况。用迁移宽度表示细胞迁移能力。
1.7 高糖受损hUCBMSCs 分泌HGF 含量参照ELISA试剂盒说明书,实验组加入最适浓度AS-IV,模型组和正常组用等量PBS液处理,48 h后取各组细胞上清液,在15 min内使用酶标仪测定450 nm的OD值。
1.8 统计学方法采用SPSS 24.0 软件分析数据,计量资料以xˉ±s表示,采用单因素方差分析,组间两两比较采用LSD-t法,P<0.05 为差异有统计学意义。
2 结果
2.1 hUCBMSCs 培养光学显微镜下P3 代细胞边缘清晰,形态均一,排列整齐,呈典型的长梭状结构,排列呈漩涡状。见图1。
2.2 hUCBMSCs鉴定P4代hUCBMSCs成骨诱导分化后经茜素红染液染色呈红色结节沉积,经成软骨诱导分化后阿利新蓝染液染色呈蓝色,经成脂诱导分化后油红O 染液染色呈红色,三者共同鉴定细胞为正常间充质干细胞。见图2。
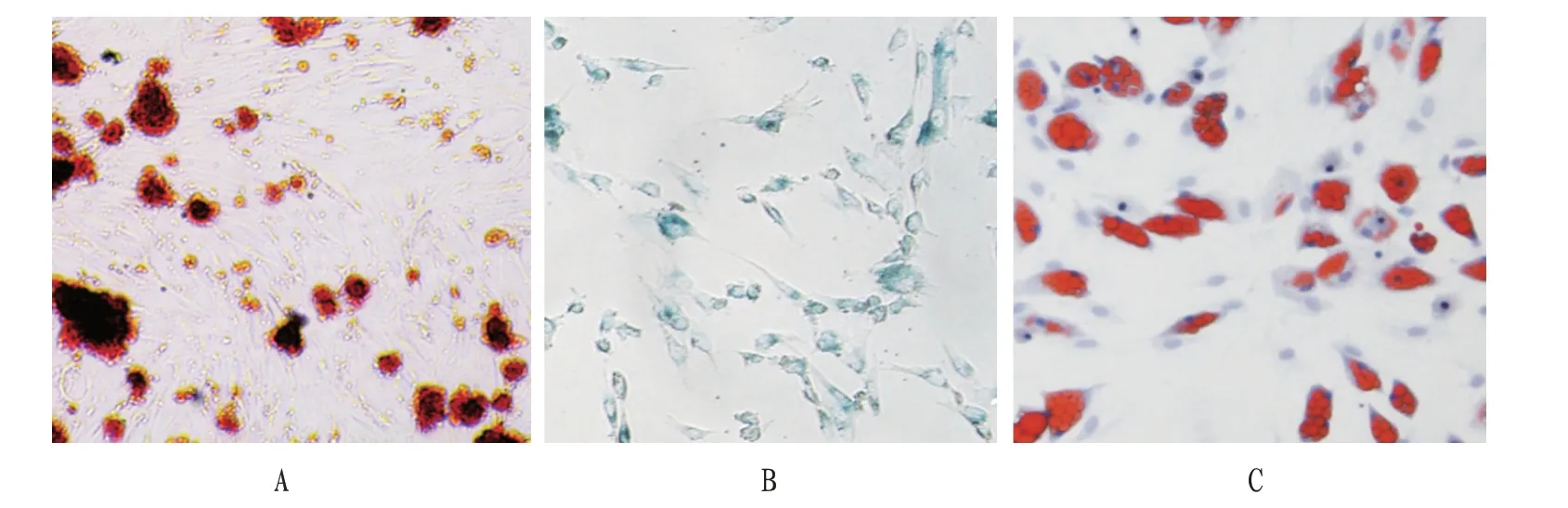
图2 hUCBMSCs成骨、成软骨和成脂肪诱导分化情况(荧光镜,×400)
2.3 不同浓度AS-IV 对高糖受损hUCBMSCs 增殖的影响当AS-IV浓度在0~300 mg/L之间时,随着AS-IV 浓度的增加,高糖诱导损伤hUCBMSCs 增殖OD 值逐渐增大,当AS-IV 浓度为300 mg/L 时,OD 值最大。当AS-IV 浓度为400 mg/L 时OD 值下降,随后随着AS-IV 浓度的增加增殖OD 值下降。因此,AS-IV 促高糖受损hUCBMSCs 增殖的最适合浓度是300 mg/L。见图3。
2.4 最适浓度AS-IV 对高糖受损hUCBMSCs 生物学功能及分泌HGF 的影响与正常组相比,模型组高糖受损hUCBMSCs 增殖(OD 值)、细胞黏附数、细胞实际迁移宽度、分泌HGF 均下降(P<0.05);与模型组相比,实验组细胞增殖(OD 值)、细胞黏附数、细胞实际迁移宽度、分泌HGF增加(P<0.05)。见表1。

表1 各组细胞增殖、细胞黏附数、细胞实际迁移宽度与HGF比较
3 讨论
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有自我复制和多向分化潜能的多能干细胞,存在于骨髓和其他组织器官中,可通过自我更新保持其细胞干性,因其具有高度增殖能力和多向分化潜能,是临床干细胞疗法中重要的细胞来源。目前研究表明在创伤修复方面,间充质干细胞不仅能向病变部位迁移并增殖分化成为成骨的种子细胞,直接参与损伤组织重建,而且能以旁分泌形式分泌大量生物活性因子间接参与修复[7]。有研究证实MSCs 可在体内或体外,经特定条件下诱导分化成为内皮细胞,从而参与血管损伤部位的修复和再生重建,并能通过分泌HGF 促进内皮细胞增殖、迁移[8]。HGF 在1984 年由Nakanura 等学者首次发现提出,它是一种多功能细胞因子,在全身各器官内均有表达[9]。间充质干细胞可通过旁分泌HGF 发挥促进细胞增殖、迁移和抗凋亡等作用[10-12]。齐文文等研究表明,人间充质干细胞分泌的HGF 可逆转高糖诱导的足细胞凋亡和损伤,从而起保护足细胞作用[13]。然而在高糖环境下,MSCs 的生物学功能和分泌功能受到不同程度抑制[14]。毕见海[15]报道经高糖诱导培养MSCs 后,MSCs 的增殖、迁移、分化功能下降,细胞凋亡率上升。这与赵同平等[16]研究发现的高糖对MSCs 的增殖产生明显抑制作用相吻合。可见如何保护高糖受损间充质干细胞,恢复其生物学功能和分泌功能,是MSCs 对创伤组织发挥修复和再生重建作用的关键。
AS-IV 是黄芪中最主要的活性成分,具有抗炎[17]、抗氧化[18]、抗细胞凋亡[19]及促生长[20]等功能。而AS-IV具有诱导MSCs向心肌样细胞和神经细胞分化、促进MSCs 增殖以及抑制其凋亡的作用。赵静苗等[21]证实AS-IV 体外可诱导大鼠骨髓来源的MSCs 分化为心肌样细胞。李鹏涛等[22]证实AS-IV可体外诱导小鼠骨髓来源的MSCs分化为神经细胞,其机制可能与提高β-catenin 蛋白及其mRNA 的表达以及抑制Notch1 蛋白及其mRNA 表达有关。此外,何文涓等[23]证实一定浓度的AS-IV可使兔脂肪来源的MSCs 处于增殖期的细胞比例增加,处于静止期的细胞比例减少。彭小娟等[24]证实一定浓度AS-IV 可以促进人骨髓来源的MSCs增殖,其作用机制可能与AS-IV 促进MSCs 对干细胞因子、血管内皮生长因子、基质细胞衍生因子的mRNA 表达有关。黄灿等[25]证实AS-IV 可抑制无血清及缺氧诱导的MSCs 凋亡,其机制可能与抑制线粒体膜电位降低有关。然而,AS-IV 能否恢复高糖诱导损伤MSCs功能,目前尚无相关报道。
本研究通过设计不同浓度梯度的AS-IV,干预高糖诱导损伤的人脐血MSCs,发现用300 mg/L AS-IV 处理高糖受损hUCBMSCs 促进体外增殖效果最强。用300mg/L AS-IV干预高糖受损hUCBMSCs,发现高糖环境可导致hUCBMSCs 增殖、黏附、迁移和分泌HGF 功能下降,而AS-IV 对高糖受损hUCBMSCs 具有保护作用,即AS-IV 干预下高糖受损hUCBMSCs 增殖、黏附、迁移和分泌HGF 功能恢复,其生物学功能和分泌HGF 功能甚至可以超过正常水平,这与中药活性成分AS-IV 具有的“促生长”作用相关。可见AS-IV 具有保护高糖诱导损伤的hUCBMSCs 的作用,然其具体作用机制不明,有待进一步研究。同时,本实验为体外实验,仍存在一定局限性,需通过动物实验进行进一步验证。



