曹志然,王 洁,王 蓓,戎瑞雪,唐志远,王 海
(河北大学 基础医学院,河北 保定 071000)
近年来,中药多糖的抗肿瘤及免疫调节作用日益受到人们的关注。从中药中提取的活性多糖,其抗肿瘤活性主要是通过其对机体免疫系统的保护和调节作用实现的[1],多无毒,对正常细胞没有杀伤作用,可以克服化疗、放疗过程中对正常细胞的损伤[2],成为近几年抗肿瘤药物研究的热点之一。国内已对多种多糖的抗肿瘤及免疫调节作用进行了研究,但多数研究大都限于某种中药多糖成分,或仅仅是2种多糖简单的组合,如当归多糖、黄芪多糖、柘树根多糖、甘草多糖,对从中药方剂中提取的复合多糖抗肿瘤免疫调节作用的研究还比较少。中药多系按照中医理论组方用药,复方是中药的精髓,最能体现中医用药特色。现有研究表明,多糖复合作用时,效果比单味多糖更佳,具有显着的抗肿瘤、提高免疫功能的作用,且其之间的药理作用呈现协同性[3]。本研究依据中药复方的理念,从经典的补血益气方剂十全大补汤中提取复合多糖,通过建立荷瘤小鼠模型及体外细胞培养的方法对复合多糖体内外抗肿瘤活性及免疫调节作用进行了初步探讨,旨在为研制复合多糖抗肿瘤药物及免疫辅助药物的临床应用提供理论和实验基础。
1 材料与方法
1.1 材料
1.1.1 动物及瘤株 昆明种雄性小鼠,体重20g±2.0g,40只,由河北医科大学实验动物中心提供,许可证号 SCXK(冀)2008-1-003,合格证号901027。H22(小鼠肝癌实体型瘤株)和 Hela(人宫颈癌细胞株)由河北医科大学提供。
1.1.2 药品、试剂及主要仪器 人参、白术、茯苓、甘草、当归、川芎、白芍、熟地黄、黄芪、肉桂购自保定市药材公司,经本院冯天铸教授鉴定均合格。RPMI-1640培养液干粉(美国 Gibco公司);新生牛血清(杭州四季青生物工程材料有限公司),MTT(AMRESCO公司)。刀豆蛋白 A、脂多糖均为Solarbio公司产品,HF90二氧化碳培养箱(上海力申科学仪器有限公司)。倒置显微镜(日本Olympus),ELX-800全自动酶标仪(美国宝特有限公司)。
1.2 方法
1.2.1 复合多糖的提取 人参32g,白术32g,茯苓 32 g,甘草 16g,当归 48g,川芎 16 g,白芍 32g,熟地黄48g,黄芪32g,肉桂8g(共296g),加20倍体积水回流提取 3次,分别为 1h,1h,0.5h,合并提取液,放冷后高速离心(6000r/min);将上清液减压回收至5倍体积,加乙醇至含醇量为80%,静置24h,高速离心(6000r/min);将上述沉淀加5倍体积水溶解,加硫酸铵至无沉淀产生,加0.5%活性炭脱色,加热、抽滤后弃去沉淀;将滤液加乙醇至含醇量为80%静置24h,高速离心(6000r/min);少量80%乙醇洗涤多次,去除多余硫酸铵,沉淀以少量水溶解,冷冻干燥,即为精多糖部分,重量为56g,多糖获得率为18.92%。
1.2.2 H22荷瘤小鼠模型的建立 无菌条件下抽取接种7d,生长良好的H22荷瘤小鼠腹水(活癌细胞数>95%),用无菌生理盐水制成细胞数为5×106·ml-1的细胞悬液,小鼠右腋部皮下接种,0.2ml/只。
1.2.3 分组与给药途径 40只雄性昆明种小鼠接种肿瘤细胞24h后称重,随机分为5组:1组为模型对照组;2-5组为用药组(2组为顺铂(DDP)阳性对照组;3组为顺铂+高剂量复合多糖组;4组为顺铂+中剂量复合多糖组;5组为顺铂+低剂量复合多糖组)。3组 ~5组分别用168.4mg.ml-1、84.2 mg.ml-1、42.1mg·ml-1复合多糖灌胃给药,每天每只0.5ml,连续10 d;2组~5组腹腔注射顺铂,每天每只0.02mg,连续10d,1组用等量温开水灌胃和生理盐水腹腔注射。
1.2.4 复合多糖对荷瘤小鼠肿瘤生长及一般状况的影响 末次给药后24h将小鼠称重,眼眶取血,全自动血细胞分析仪计数白细胞、红细胞、血红蛋白;脱颈处死小鼠,75%乙醇浸泡消毒,解剖摘取瘤块、用滤纸吸干后称重,计算抑瘤率。同时观察实验过程中实验动物的一般情况及进食量。

1.2.5 复合多糖对荷瘤小鼠脾指数及T、B淋巴细胞增殖的影响 采用 MTT法[4]。无菌摘取小鼠脾脏并称重,制备脾细胞悬液,用1640完全培养液调整细胞密度为5×106·ml-1,将细胞悬液加至96孔培养板中,90μl/孔,设 Con A刺激组(终浓度为 5μg· ml-1)、LPS 刺激组 (终浓度为 10μg·ml-1)和无血清培养液对照组,每组3个复孔。将96孔板置于培养箱中培养68h后加入5mg·ml-1的MTT 15ul,继续培养4h,培养结束后弃上清,每孔加DMSO 150ul,震荡5min,酶标仪测490nm波长下的OD值,计算刺激指数。

1.2.6 复合多糖体外抑瘤作用 采用MTT比色法。Hela细胞用1640完全培养液(含10%热灭活胎牛血清,0.2%NaHCO3,100U·ml-1青霉素、100μg·ml-1链霉素、3mmol·l-1L-谷氨酰胺),置37℃、5%CO2培养箱中,按贴壁方法培养。收集对数生长期的细胞,制备单细胞悬液,调整细胞密度为2 ×104·ml-1,以 90μl/孔接种于 96 孔培养板中,置37℃,5%CO2培养箱中培养24h后,复合多糖组分别加入终浓度为 200μg·ml-1、100μg·ml-1、50μg·ml-1、25μg· ml-1、12.5μg· ml-1的 复 合 多 糖10μl,每个浓度设3个复孔,对照组加入等量无血清1640培养液;置培养箱中继续培养,分别于20h、44h、68h 取出培养板,每孔加 5mg·ml-1的 MTT 15μl,4h 后终止培养,弃上清加 DMSO 150μl,震荡5min,酶标仪测490 nm波长下的光密度(OD)值,并计算细胞增殖抑制率(IR)。

1.2.7 数据处理 用SPSS16.0软件处理,各组数据由s表示,组间两两比较采用方差分析中的两两比较t检验。
2 结果
2.1 复合多糖对H22荷瘤小鼠体重及瘤重的影响
表1显示,小鼠接种瘤细胞4d后饮食减少、皮毛无光泽,均可触及皮下肿块。用药组荷瘤小鼠增重量均较模型对照组低,高、中剂量多糖组与顺铂合用组与单纯顺铂组比较,小鼠体重明显增加(P<0.05)。用药组与模型对照组相比,瘤重均明显减轻(P<0.05),单独使用顺铂抑瘤率为22%,当顺铂和不同剂量的复合多糖联用时,高、中剂量组抑瘤率分别增加至36%、37%。
表1 复合多糖对H22荷瘤小鼠体重及瘤重的影响(s)
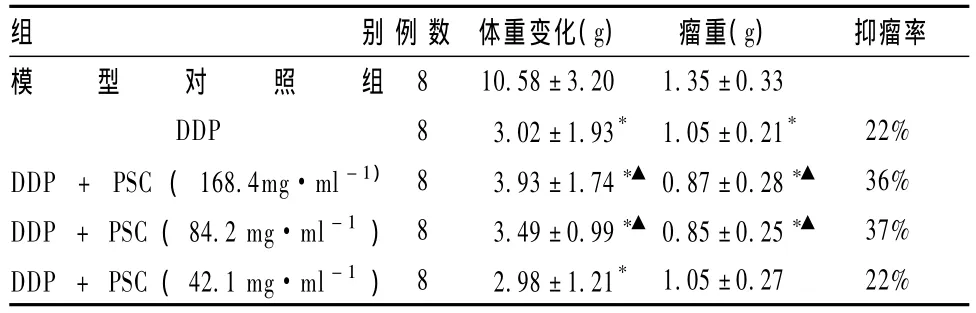
表1 复合多糖对H22荷瘤小鼠体重及瘤重的影响(s)
注:与模型对照组比较:*P<0.05;与顺铂组比较:▲P<0.05
组抑瘤率模型对照组别 例 数 体重变化(g)瘤重(g)DDP 8 3.02±1.93* 1.05±0.21* 22%DDP + PSC(168.4mg·ml-1) 8 3.93±1.74*▲ 0.87±0.28*▲ 36%DDP +PSC(84.2 mg·ml-1)8 3.49±0.99*▲ 0.85±0.25*▲ 37%DDP+PSC(42.1 mg·ml-1)8 2.98±1.21*1.05±0.27 22%
2.2 复合多糖对荷瘤小鼠 WBC、RBC、HGB数及脾指数的影响
表2显示,与模型对照组相比,顺铂组小鼠白细胞数显着降低(P<0.05),复合多糖组没有显着性差异;与顺铂组相比,不同剂量复合多糖组白细胞数显着增加(P<0.05),中剂量复合多糖组红细胞、血红蛋白数增加明显。顺铂组的脾指数显着低于模型对照组(P<0.01),复合多糖+顺铂组脾指数显着高于顺铂组(P<0.05),且随复合多糖药物浓度的增大而增大。
表2 复合多糖对荷瘤小鼠WBC、RBC、HGB数及脾指数的影响(s)
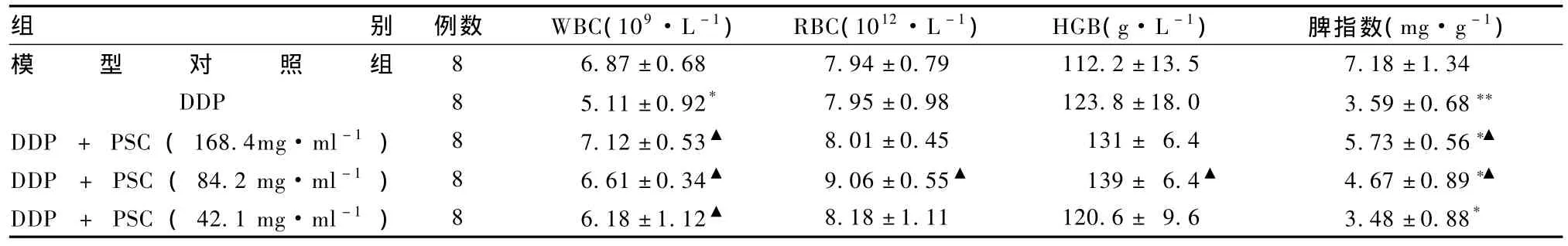
表2 复合多糖对荷瘤小鼠WBC、RBC、HGB数及脾指数的影响(s)
注:与模型对照组比较:*P<0.05,**P<0.01;与顺铂组比较:▲P<0.05
组别 例数 WBC(109·L-1)RBC(1012·L-1)HGB(g·L-1)脾指数(mg·g-1)6.87±0.68 7.94±0.79 112.2±13.5 7.18±1.34 DDP 8 5.11±0.92* 7.95±0.98 123.8±18.0 3.59±0.68**DDP + PSC(168.4mg·ml-1)8 7.12±0.53▲ 8.01±0.45 131± 6.4 5.73 ±0.56*▲DDP + PSC(84.2 mg·ml-1)8 6.61±0.34▲ 9.06±0.55▲ 139± 6.4▲ 4.67±0.89*▲DDP + PSC(42.1 mg·ml-1)8 6.18±1.12▲ 8.18±1.11 120.6± 9.6 3.48±0.88模型对照组8*
2.3 复合多糖对荷瘤小鼠T淋巴细胞、B淋巴细胞增殖的影响
表3 复合多糖对荷瘤小鼠T淋巴细胞、B淋巴细胞增殖的影响(s)
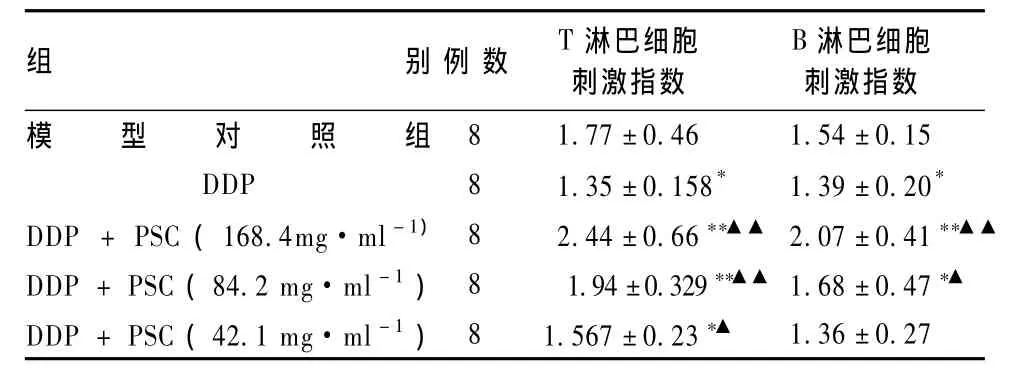
表3 复合多糖对荷瘤小鼠T淋巴细胞、B淋巴细胞增殖的影响(s)
注:与模型对照组比较:*P<0.05,*P<0.01;与顺铂组比较:▲P<0.05,▲▲P<0.01
模型对照组DDP 8 1.35±0.158* 1.39±0.20*DDP +PSC(168.4mg·ml-1) 8 2.44 ±0.66**▲▲ 2.07 ±0.41**▲▲DDP+PSC(84.2 mg·ml-1)8 1.94 ±0.329**▲▲ 1.68 ±0.47*▲DDP+PSC(42.1 mg·ml-1)8 1.567 ±0.23*▲1.36±0.27
表3显示,与模型对照组比较,高中剂量复合多糖治疗后荷瘤小鼠的脾淋巴细胞转化能力显着高于模型对照组(P<0.01),而顺铂治疗后转化能力明显降低(P<0.05);与顺铂组比较,顺铂和不同浓度的复合多糖联用可显着增强脾淋巴细胞的转化能力(P<0.05或 P<0.01)。
2.4 复合多糖对肿瘤细胞增殖的抑制作用
表4显示,同一作用时间下,细胞增殖抑制率随复合多糖浓度的增加而显着提高;相同复合多糖浓度下,随作用时间的延长,抑制率有明显增大趋势。
3 讨论
恶性肿瘤目前以手术、放疗、化疗为主,手术多适用于早期癌症患者,放疗、化疗只对敏感瘤株有效,且会出现严重的毒副反应和后遗症,同时肿瘤的发生、发展往往伴有机体免疫功能的降低。近年来,国内外学者证实多糖不仅是一种良好的抗肿瘤物质,而且其促进和恢复机体免疫功能的作用较为突出,因此中药活性多糖的抗癌作用受到越来越多的重视。
表4 复合多糖对肿瘤细胞增殖的抑制作用(s)
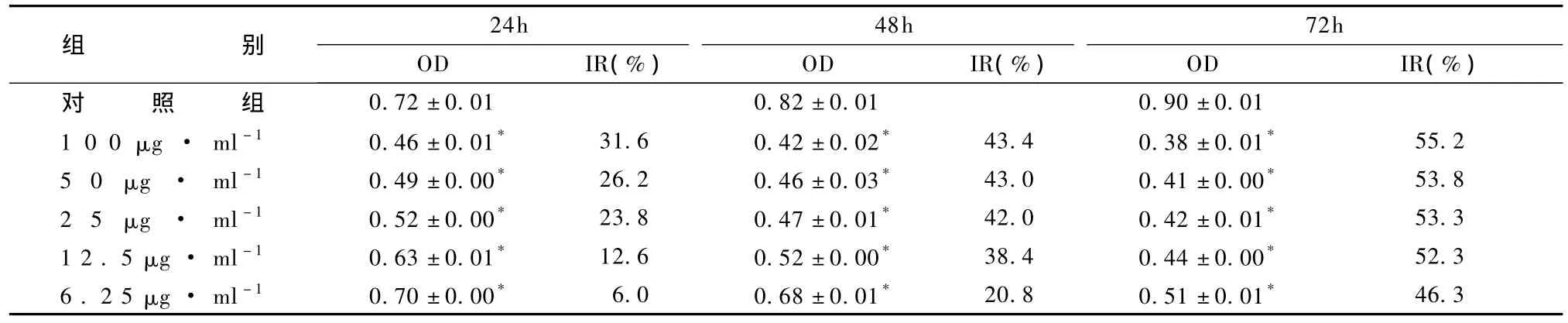
表4 复合多糖对肿瘤细胞增殖的抑制作用(s)
注:与对照组比较:*P<0.01
组别24h 48h 72h OD IR(%)OD IR(%)OD IR(%)对照组46.3 0.72±0.01 0.82±0.01 0.90±0.01 1 0 0 μg · ml-1 0.46±0.01* 31.6 0.42±0.02* 43.4 0.38±0.01* 55.2
本研究中的复合多糖从经典的补血益气方剂-十全大补汤中提取,其组成成分黄芪、当归、甘草等均具有确切的抗肿瘤活性。根据中药复方配伍的理念,复合多糖提高了对肿瘤细胞的抑制和杀伤作用。本实验对复合多糖进行了体内外抗肿瘤及免疫调节功能的研究,复合多糖体外实验结果显示,其对Hela细胞增殖有明显抑制作用,且呈时间-剂量依赖性。体内实验结果显示,复合多糖与顺铂联用具有协同抗小鼠H22肝癌的作用,在荷瘤小鼠用药10d后,与顺铂组比较,顺铂联合复合多糖3个剂量组均能显着提升脾指数、白细胞数,拮抗顺铂引起的免疫抑制作用。同时复合多糖可使ConA和LPS激发的T细胞、B细胞增殖反应明显增强,表明复合多糖对T细胞、B细胞的功能具有增强作用,可以通过增强荷瘤小鼠的细胞免疫、体液免疫功能而发挥一定的抗肿瘤效应。观察各组小鼠还发现,复合多糖组小鼠一般状态良好,外观、毛色、大便、活动、体重增长等均较顺铂组明显改善,说明复合多糖可拮抗顺铂的毒副作用。
综上所述,中药复合多糖体内外均显示明显的抗肿瘤活性,与顺铂联用可产生协同增效作用,具有良好的应用前景。
[1]宫丹,杜培革,崔新颖.植物多糖的免疫调节及抗肿瘤活性研究[J]. 北华大学学报:自然科学版,2004,5(4):326-329.
[2]马红樱,张德禄.植物活性多糖的研究进展[J].西北师范大学学报,2004,40(3):112-118.
[3]苏富琴,崔红霞,刘吉成.复合多糖的免疫协同作用[J].中药新药与临床药理,2004,15(5):317-319.
[4]尹源明,何国庆.复合食用菌多糖抗肿瘤作用的研究[J].中国食品学报,2005,5(2):90-93.



