李 云,杨胜远*,陈郁娜,刘祥流,麦真真,陈 燕
(韩山师范学院生物系食品与发酵工程研究所,广东 潮州 521041)
产谷氨酸脱羧酶片球菌的鉴定及其酶学性质
李 云,杨胜远*,陈郁娜,刘祥流,麦真真,陈 燕
(韩山师范学院生物系食品与发酵工程研究所,广东 潮州 521041)
从发酵蔬菜中分离一株产谷氨酸脱羧酶(glutamate decarboxylase,GAD)的乳酸菌HS2,其菌体细胞转化Glu 1h,转化液中γ-氨基丁酸含量可达(3.114±0.133)g/L,通过形态培养特征、生理生化特征、16S rDNA序列比对及系统发育分析,鉴定菌株HS2是戊糖片球菌(Pediococcus pentosaceus)。菌株HS2 GAD最适作用温度为35℃,最适作用pH4.5。酶的热稳定较好,在pH4.0~6.5于50℃处理4h,酶活基本稳定。Ca2+对酶有激活作用,5mmol/L 和50mmol/L Ca2+浓度使酶活分别提高了37.21%和23.02%。Mg2+和Mn2+在50mmol/L浓度时激活作用明显,而Co2+在5mmol/L浓度激活作用较好。
谷氨酸脱羧酶;戊糖片球菌;γ–氨基丁酸;菌种鉴定
谷氨酸脱羧酶(glutamate decarboxylase,GAD)是存在于生物的一种重要的脱羧酶,催化L-谷氨酸(Glu)脱羧生成γ-氨基丁酸(γ-aminobutyric acid,GABA)和CO2[1]。GAD广泛分布于动物、植物和微生物体内。在哺乳动物中枢神经系统,其脱羧产物GABA是一种主要的抑制性神经递质,具有重要的生理功能[2]。在植物中,GABA 的合成与植物生长的逆境生理有重要关系[3]。细菌细胞内的GAD酶系统是细菌对酸性环境的应激反应,维持体内pH值稳态的机制之一[4]。在真核微生物中,GAD在孢子的萌发过程中参与能量代谢和起代谢调控作用[5]。由于GAD在生物体内存在的普遍性,对不同来源GAD的结构、功能及基因表达调控机制的阐明已成为当前研究的热点之一。
微生物来源的GAD中,乳酸细菌(lactic acid bacterium,LAB)产GAD受到大量研究者的关注。乳酸菌在自然界中分布很广泛,是人和动物肠道正常菌群。寻找高GAD活性的食品安全的乳酸菌株,或者采用基因工程技术获得高GAD活力的基因工程菌,能够开发安全高效的生物合成GABA工艺及富含GABA的保健食品。另外,阐明简单低等生物GAD结构与功能的关系,能为复杂高等生物中GAD研究提供重要的线索。文献已报道乳球菌属(L a c t o c o c c u s)[6-7]、链球菌属(Streptococcus)[8]、乳杆菌属(Lactobacillus)[9-12]等的多种乳酸菌具有GAD活性,研究集中在GAD酶学性质、基
因克隆和表达等方面,然而尚未见有关于戊糖片球菌(Pediococcus pentosaceus)产GAD方面的报道。本实验从自然发酵的蔬菜中分离和鉴定产GAD的戊糖片球菌,并研究其GAD粗酶的酶学性质。
1 材料与方法
1.1 培养基
MRS培养基、M17培养基、SL培养基、番茄汁培养基和脱脂牛乳培养基参照文献[13]进行配制。
1.2 试剂与仪器
色谱纯试剂 美国Tedia 和 Honeywell International INC 公司;DNA纯化试剂盒 北京天为时代科技有限公司;γ-氨基丁酸(纯度99.0%) Sigma公司;其他试剂为分析纯。
PTC-100TMPCR仪 MJ Research公司;Agilent 1100 Series高效液相色谱仪(XDB-C18柱,15cm×4.6mm,5μm) Agilent公司;Sigma2-16离心机 Sigma公司;UY92-2D超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.3 PCR引物
采用细菌1 6 S r D N A的通用引物:2 7 F:5'-GAGAGTTTGATCCTGGCTCAG-3',1541R:5'-AAGGAGGTGATCCAGCCGCA-3'。由上海生工生物工程技术服务有限公司合成。
1.4 方法
1.4.1 乳酸菌的分离
取自然发酵蔬菜(固体样品预先破碎,菌较少样品预先用适当培养基富集),于无菌生理盐水做10倍梯度稀释。取合适稀释度的稀释液1mL分别注入无菌培养皿中,以无菌操作加入已加入1g/100mL CaCO3熔化的MRS琼脂培养基(预冷至50℃以下),培养基倒入平皿后摇匀。待培养基凝固后,倒置于32℃培养箱中培养48h。挑取周围有CaCO3溶解圈的菌落,于MRS平板上划线纯化。取纯化后的菌落,涂布,革兰氏染色,镜检,保留G+的菌株,于脱脂牛乳培养基保藏。
1.4.2 产GAD乳酸菌的筛选
取待筛选的菌株斜面培养18~24h活化后,接种于MRS液体培养基活化18~24h。分别吸取1mL经活化的菌液至装有100mL MRS培养基的250mL锥形瓶中,32℃培养24h,于4℃、8000×g离心15min收集菌体,0.9g/100mL的生理盐水洗涤,于4℃、8000×g离心15min收集菌体,重复洗涤3次。按菌体量与谷氨酸钠1∶10(V/V)的比例,加入1g/100mL L-谷氨酸钠(溶于0.2mol/L pH4.5乙酸-乙酸钠缓冲液中),混匀后,于35℃转化1h,离心取上清液,得转化液。
采用新华一号层析纸,吸取转化后的上清液1μL进行点样,用10mmol/mL GABA标准溶液和1g/100mL谷氨酸钠溶液作对照,按0.4g/100mL的比例将显色剂茚三酮加入展开剂中,展开剂的组成:正丁醇、冰醋酸、水体积比12∶3∶5,展程15~18cm。展开后于90℃条件下显色10min。具有与GABA标样展程一致的斑点的待测样品,定性为具有产GAD活性的菌株。参照文献[14]采用高效液相色谱法对转化液中的GABA进行定量分析。
1.4.3 形态培养特征及生理生化特征实验
形态、培养及基本生理生化特征实验参照文献[12,15]。生化特征实验采用法国梅里埃vitek 32微生物自动鉴定系统鉴定。
1.4.416 S rDNA序列比对及系统发育分析
按文献[16]方法提取细菌基因组DNA,采用细菌16S rDNA的通用引物27F和1541R进行扩增。扩增体系为10mmol/mL MgCl23μL,10×PCR buffer 5μL,dNTP (2.5μmol/L)4μL,TaqTM(5U/μL)0.25μL,上游引物和下游引物(2.5μmol/L)各1μL,模板DNA 1μL,最后加双蒸水至50μL,混合后瞬间离心,置于PCR仪上95℃变性5min,然后94℃变性30s、52℃退火30s、72℃延伸1min,共30个循环,最后72℃延伸10min反应结束。PCR产物经1%琼脂糖凝胶电泳,于凝胶成像系统下观察并拍照记录结果。PCR产物通过电泳,利用北京天为时代科技有限公司凝胶回收试剂盒割胶回收纯化。委托上海生工进行生物工程技术服务有限公司测序。将16S rDNA序列与GenBank+EMBL+DDBJ+PDB数据库中的核苷酸序列进行同源性分析(http∶//www.ncbi.nlm. nih.gov/blast),利用BioEdit_7.0.0 软件的Clustal W程序进行多重比对,然后利用Clustal X1.8软件采用Neighbour-joining方法构建系统发育树,并进行bootstrap分析,重复次数为1000次。
1.4.5 GAD制备
将湿菌体3g悬浮到30mL pH5.0的0.2mol/L 乙酸-乙酸钠缓冲液中,内含0.01mmol/L磷酸吡哆醛(pyridoxal phosphate,PLP),1mmol/L二硫苏糖醇,冰浴中超声波破碎(400W,工作5s,间隔15s,全程90min),4℃放置过夜,4℃离心(8000×g,20min)收集上清液,作为GAD酶液。
1.4.6 GAD活力测定
GAD酶转化反应体系总体积400μL,其中GAD酶液100μL,L-Glu溶液(pH4.5,40mmol/L,含0.02mmol/L PLP)100μL,pH4.5的0.2mol/L乙酸-乙酸钠缓冲液200μL。混合后于35℃反应4h,加入4倍体积预冷的冰冻无水乙醇终止反应,然后参照文献[14]采用高效液相色谱法测定GABA。在测定条件下1h生成1μmol
GABA所需酶量定义为1个酶活力单位(U)。以相对酶活力比较不同条件处理的GAD活力大小。
2 结果与分析
2.1 产GAD乳酸菌的分离筛选
从自然发酵蔬菜中,分离到112株革兰氏阳性、接触酶阴性的菌株,初步确定为乳酸菌。待测乳酸菌经菌体细胞转化谷氨酸钠,转化液纸层析定性检测,有9株菌转化液样与GABA标准有相同的迁移率,说明这些菌株具有GAD活力。转化液的GABA含量测定结果(图1)表明,菌株HS2的GAD活力最大,于35℃、0.2mol/L pH4.5乙酸-乙酸钠缓冲液中转化1h,转化液中GABA的含量达(3.114±0.133)g/L。

图1 产GAD菌株转化液的GABA含量Fig.1 The concentration of GABA in transformed liquid with GAD-producing strains
2.2 菌株HS2的鉴定
2.2.1 形态特征
菌株HS2于35℃ MRS培养基生长24h,菌落细小,表面平滑、呈圆形、灰白色、边缘整齐,培养48h菌落直径约1~2mm。革兰氏染色观察表明菌株HS2为革兰氏阳性、无芽孢、圆球形、菌体直径约1μm;细胞呈对生,非链状排列,沿两个垂直方向分裂形成的四联排列(图2)。

图 2 菌株HS2菌体形态(×1000)Fig.2 Morphology of strain HS2 (×1000)
2.2.2 菌株HS2培养及生理生化特征
参照文献[12,15]进行培养及生理生化特征实验,生理生化特征由vitek 32鉴定系统鉴定,结果见表1,各项特征符合文献[12,15]关于片球菌(Pediococcus)的描述。
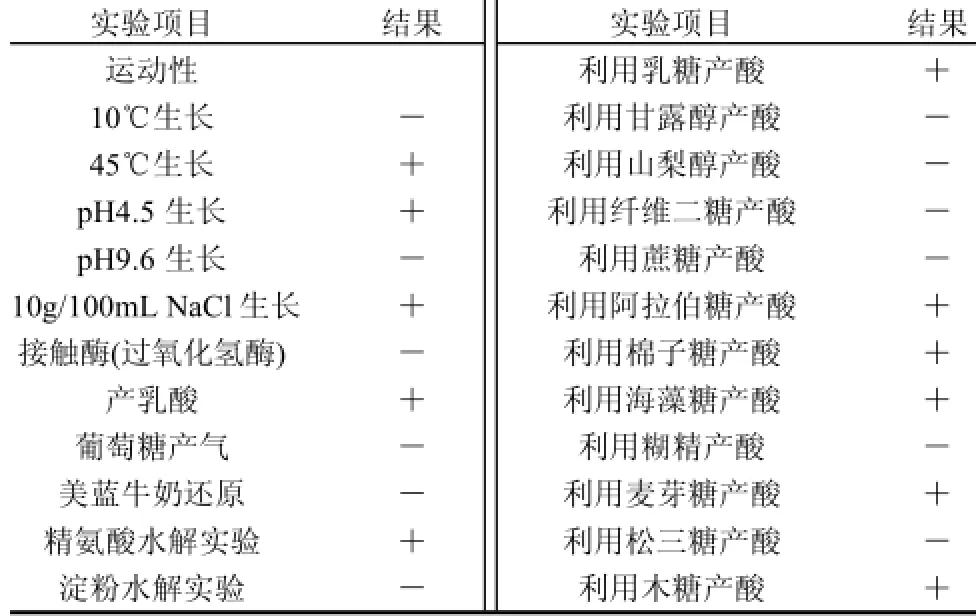
表 1 菌株HS2的培养及生理生化特征Table 1 Physiological and biochemical characteristics of strain HS2
2.2.316 S rDNA序列比对及系统发育分析
以菌株HS2总DNA为模板,利用细菌16S rDNA通用引物进行PCR扩增,扩增产物大小在1.5kb左右(图3)。经测序,菌株HS2的16S rDNA序列为1484bp,已在GenBank中登记,登记号(GenBank accession number)为:GQ465207。将菌株HS2的16S rDNA序列与GenBank+EMBL+DDBJ+PDB数据库中报道的16S rDNA核苷酸序列进行比对,结果与数据库中9株Pediococcus pentosaceus相似度最高(达99%),初步将菌株HS2鉴定为Pediococcus pentosaceus。
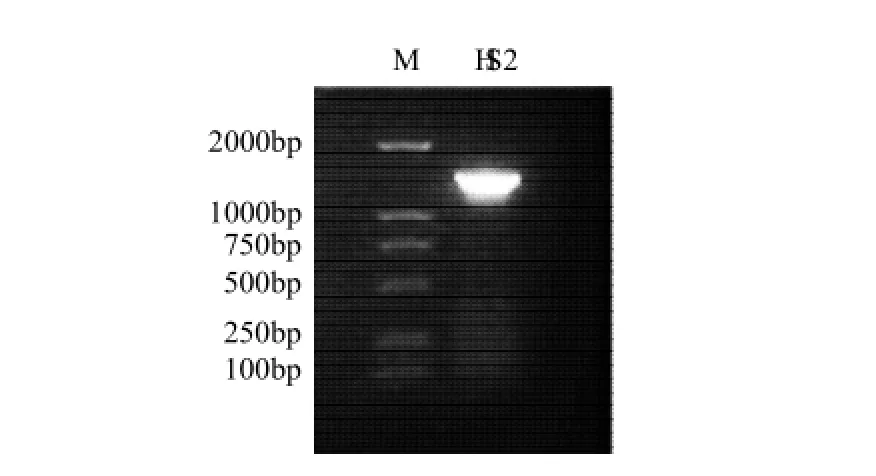
图3 菌株HS2 16SrDNA PCR扩增结果Fig.3 PCR of 16SrDNA of strain HS2

表 2 菌株HS2的16SrDNA序列与GenBank+EMBL+DDBJ+PDB数据库比对结果Table 2 Comparison of 16SrDNA sequence of strain HS2 and the data from GenBank+EMBL+DDBJ+PDB database
以菌株HS2、片球菌属(Pediococcus)各个种和部分已报道产GAD的球菌的16S rDNA核苷酸序列为基础构建系统发育树,结果显示,菌株HS2与Pediococcus pentosaceus位于同一簇群,1000次bootstrap分析完全支持该分枝,与片球菌属其他种的发育关系相对较远(图4)。
根据16S rDNA序列比对及系统发育分析结果,结合形态特征、培养及生理生化特征,对照文献[12,15],鉴定菌株HS2为戊糖片球菌(Pediococcus pentosaceus)。2.3菌株HS2 GAD的性质
2.3.1 温度对菌株HS2酶活力的影响
GAD酶液在不同温度(25、30、35、40、45、50、60℃)中作用于底物L-Glu测定酶活力,结果如图5所示。菌株HS2 GAD酶最适反应温度为35℃,在35~40℃范围内酶活力变化不大,超过40℃酶活力下降较快,60℃时相对酶活力仅35.30%。GAD酶液在不同温度(4、40、50、60、70℃)保温4h,再于35℃测定酶活力,结果表明在温度低于50℃以下保温,酶活力基本保持稳定,损失不大,说明菌株HS2 GAD的热稳定较好。高于此范围酶活力快速下降,60℃酶活力损失变大,70℃几乎完全失去酶活。
2.3.2 pH值对菌株HS2 GAD酶活力的影响
用不同pH值(3.5~6.5)的缓冲液配制酶反应体系,于35℃测定酶活力,图6表明该酶的最适反应pH值为4.5,pH4.5~5.0较适宜GAD进行催化反应,酶活力都在90%以上。当pH值低于4.5时酶活力逐渐下降,pH值高于5.0时酶活力急剧下降。菌株HS2 GAD在pH4.0~6.5间酶活力相对较稳定,经不同pH值的缓冲溶液于35℃处理4h,相对酶活力仍保留90%以上;当pH值低于4.0或高于6.5时,GAD严重失活。

图 5 温度对菌株HS2粗GAD酶活力的影响Fig.5 Effect of temperature on the activity of crude GAD from strain HS2

图 6 pH值对菌株HS2粗GAD酶活力的影响Fig.6 Effect of pH on the activity of crude GAD from strain HS2
2.3.3 金属离子对菌株HS2 GAD酶活力的影响
在酶反应体系中分别加入5mmol/L和50mmol/L不同种类的金属离子,测定酶活力。
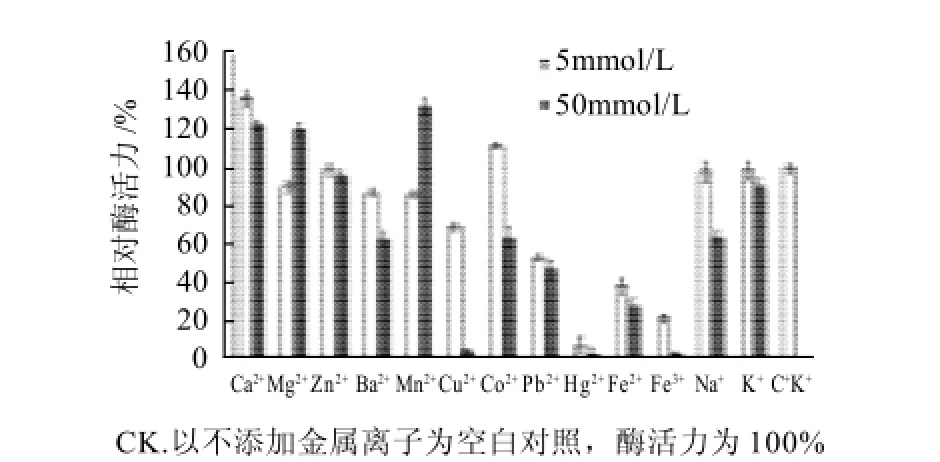
图 7 金属离子对菌株HS2粗GAD酶活力的影响Fig.7 Effects of metal ions on the activity of crude GAD from strain HS2
图7显示:当金属离子浓度为5mmol/L时,Ca2+和Co2+对菌株HS2 GA D有激活作用,Zn2+、Na+、K+、
Mn2+、Ba2+、Mg2+对酶活力的影响不大,Cu2+、Pb2+、Hg2+、Fe2+、Fe3+对酶活力都有抑制作用,其中Hg2+对GAD酶活性的抑制作用最强,几乎完全抑制GAD活性;当金属离子浓度为50mmol/L时,Ca2+、Mg2+、Mn2+对酶活力有明显的激活作用,Zn2+和K+对酶活的影响不大,而Ba2+、Co2+、Pb2+、Na+、Cu2+、Hg2+、Fe3+对GAD酶活力都有不同程度的抑制作用,其中Fe3+、Hg2+几乎完全抑制GAD活性。由此可知,Ca2+在两个浓度均对酶有激活作用,酶活力分别提高了37.21%和23.02%。Mg2+和Mn2+在较高浓度时激活作用明显,而Co2+在较低浓度激活作用较好。结果表明GAD受金属离子的影响较大。
3 讨 论
已报道的乳酸菌GAD[6,10-11,17]的最适作用温度大多在其最适生长温度附近,本实验中的戊糖片球菌HS2的GAD最适温度也符合其生长温度条件。微生物来源的GAD 最适反应pH值在3.8~5.0[18],已报道的乳酸菌的GAD[6,10-11,17]最适pH值在4.0~5.0。菌株HS2 GAD最适pH值为4.5,与乳酸菌来源GAD一致。金属离子在一定的浓度下,对酶的活性有激活和抑制作用,特别是重金属离子容易使酶失活。Ca2+对有HS2 GAD酶激活作用,Mg2+和Mn2+在较高浓度时激活作用明显,而Co2+在较低浓度激活作用较好。与文献[19]报道5mmol/L 的Mg2+对Lactococcus lactis SYFS1.009的GAD具有激活作用较为一致。
片球菌(Pediococcus)在乳酸菌的分类地位上,属于干酪乳杆菌-片球菌群(L.casei-Pediococcus group),对动植物不致病,常用于蔬菜、奶酪、肉和腊肠等产品的发酵,是一类应用于食品工业安全的微生物。片球菌的代谢产物细菌素片球菌素(pediocin) 具有天然安全及其耐热耐酸的特性,作为一种生物防腐剂在食品发酵和食品保藏中得到广泛的研究及应用[20]。戊糖片球菌(P. pentosaceus)常分离自植物和成熟的干酪,本实验从发酵蔬菜中分离到安全的产G A D戊糖片球菌(P. pentosaceus)HS2,对于利用其GAD催化谷氨酸脱羧生物合成食品级GABA,以及开发富含GABA的发酵保健食品,具有较好的应用前景。
[1]HIROSHI U. Enzymatic and structural aspects on glutamate decarboxylase [J]. Journal of Molecular Catalysis B∶ Enzymatic, 2000, 10(1/3)∶ 67-79.
[2]杨胜远, 陆兆新, 吕凤霞, 等. γ-氨基丁酸的生理功能和研究开发进展[J]. 食品科学, 2005, 26(9)∶ 546-551.
[3]GUT H, DOMINICI P, PILATI S A, et al. Common structural basis for pH and calmodulin-mediated regulation in plant glutamate decarboxylase [J]. Journal of Molecular Biology, 2009, 392(2)∶ 334-351.
[4]HEAVIN S B, BRENNAN O M, MORRISSEY J P, et al. Inhibition of Listeria monocytogenes by acetate, benzoate and sorbate∶ weak acid tolerance is not influenced by the glutamate decarboxylase system[J]. Letters in Applied Microbiology, 2009, 49(2)∶ 179-185.
[5]KUMAR S, PUNEKAR N S, SATYA N V, et al. Metabolic fate of glutamate and the evaluation of flux through the 4-aminobutyrate (GABA) shunt in Aspergillus niger[J]. Biotechnol Bioeng, 2000, 67(5)∶575-584.
[6]NOMURA M, KABAYASHI M, OHMOMO S, et al. Inactivation of the glutamate decarboxylase gene in Lactococcus lactis subsp. Cremoris[J]. Applied and Environmental Microbiology, 2000, 66(5)∶ 2235-2237.
[7]NOMURA M, NAKAJIMA I, FUJITA Y, et al. Lactococcus lactis conteins only one glutamate decarboxylase gene[J]. Microbiol, 1999, 145(6)∶ 1375-1380.
[8]YANG S Y, LU F X, LU Z X, et al. Production ofγ-aminobutyric acid by Streptococcus salivarius subsp. thermophilus Y2 under submerged fermentation[J]. Amino Acids, 2008, 34(3)∶ 473-478.
[9]PARK K B, OH S H. Cloning, sequencing and expression of a novel glutamate decarboxylase gene from a newly isolated lactic acid bacterium, Lactobacillus brevis OPK-3[J]. Bioresource Technology, 2007, 98(2)∶312-319.
[10]HUANG Jun, MEI Lehe, SHENG Qing, et al. Purification and characterization of glutamate decarboxylase of Lactobacillus brevis CGMCC 1306 isolated from fresh milk[J]. Chin J Chem Eng, 2007, 15(2)∶ 157-161.
[11]KOMATSUZAKI N, SHIMA J, KAWAMOTO S, et al. Production of γ-aminobutyric acid (GABA) by Lactobacillus paracasei isolated from traditional fermented foods[J]. Food Microbiology, 2005, 22(6)∶497-504.
[12]SE-HEE K, BO-HYE S, YEON-HEE K, et al. Cloning and expression of a full-length glutamate decarboxylase gene from Lactobacillus brevis BH2[J]. Biotechnology and Bioprocess Engineering, 2007, 12 (6)∶ 707-712.
[13]凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法[M]. 北京∶ 中国轻工业出版社, 1999.
[14]ROSSETTI V, LOMBARD A. Determination of glutamate decarboxylase by high-performance liquid chromatography[J]. J Chromatogr B, 1996, 681(1)∶ 63-67.
[15]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京∶ 科学出版社, 2001.
[16]萨姆布鲁克 J, 拉塞尔 D W. 分子克隆实验指南[M]. 黄培堂, 译. 3版. 北京∶ 科学出版社, 2002.
[17]UENO Y, HAYAKAWA K, TAKAHASH S, et al. Purification and characterization of glutamate decarboxylase from Lactobacillus brevis IFO12005[J]. Biosci Biotechnol Biochem, 1997, 61(7)∶ 1168-1171.
[18]杨胜远, 陆兆新, 吕风霞, 等. 微生物谷氨酸脱羧酶研究进展[J]. 食品科学, 2007, 28(1)∶ 354-359.
[19]许建军. Lactococcus lactis 生物合成γ–氨基丁酸及谷氨酸脱羧酶的性质研究[D]. 无锡∶ 江南大学, 2004.
[20]ANASTASIADOU S, PAPAGIANNI M, FILIOUSIS G, et al. Growth and metabolism of a meat isolated strain of Pediococcus pentosaceus in submerged fermentation∶ Purification, characterization and properties of the produced pediocin SM-1[J]. Enzyme and Microbial Technology, 2008, 43(6)∶ 448-454.
Identification and Enzymological Characterization of Glutamate Carboxylase-producing Pediococcus
LI Yun,YANG Sheng-yuan*,CHEN Yu-na,LIU Xiang-liu,MAI Zhen-zhen,CHEN Yan
(Food and Fermentation Engineering Institute of the Department of Biology, Hanshan Normal University, Chaozhou 521041, China)
A glutamate decarboxylase (GAD)-producing lactic acid bacteria (LAB) strain HS2 was isolated from pickled vegetable. When the biotransformation was conducted in cells with strain HS2 for 1 h, the content of γ-aminobutyric acid in biotransformation solution of strain HS2 was (13.114±0.133) g/L. Base on morphological, physiological and biochemical characteristics, 16S rDNA and phylogenic analysis, the strain HS2 was identified as Pediococcus pentosaceus. The optimal temperature and pH for GAD activity were 35 ℃ and 4.5. The GAD from strain HS2 was stable at 50 ℃ for 4 h and resistant to pH in the range of 4.0-6.5. In addition, calcium ions could result in a significant increase of GAD activity, which resulted in an enhancement of GAD activity by 37.21% and 23.02% at the concentrations of 5 mmol/L and 50 mmol/L Ca2+. Similarly, Mg2+and Mn2+also could increase GAD activity at the concentration of 50 mmol/L, whereas Co2+could improve GAD activity at the concentration of 5 mmol/L.
glutamate decarboxylase;Pediococcus pentosaceus;γ–aminobutyric acid;strain identification
Q939.9
A
1002-6630(2010)09-0187-05
2009-09-25
广东省自然科学基金项目(8452104101001546);国家星火计划项目(2008GA780032);韩山师范学院科研基金资助项目
李云(1977—),男,讲师,硕士,研究方向为应用微生物学和发酵工程。E-mail:fgtmyself@yahoo.com.cn
*通信作者:杨胜远(1972—),男,教授,博士,研究方向为食品微生物学及生物技术。E-mail:yshengyuan2004@yahoo.com.cn



