李 峰,明艳红,李媛媛,潘 瑶,陈 奇
(淮北煤炭师范学院生命科学学院,资源植物学安徽省重点实验室,安徽 淮北 235000)
产果香菌株的初步鉴定及香味成分分析
李 峰,明艳红,李媛媛,潘 瑶,陈 奇
(淮北煤炭师范学院生命科学学院,资源植物学安徽省重点实验室,安徽 淮北 235000)
对从安徽砀山果园土壤中分离出的产果香菌进行纯化和菌种形态特征研究,初步鉴定该菌株为地霉属。采用顶空-固相微萃取法(HS-SPME)结合气-质联用技术(GC-MS)分析产生的具有水果香味的物质,结果表明,其主要成分为酯类和醇类,其中最多的是酯类,共32种,占总量的73.84%;醇类物质8种,占12.53%。
产果香菌株;生长曲线;香气成分;气-质联用技术
随着经济的发展和人们生活水平的提高,消费者在追求食品健康、营养、卫生的同时也看重色泽、口味。各种可以食用的香料和人工色素在食品配料中所占的比例虽然很小,但却对食品色泽、口味起着举足轻重的作用。香料对原有食物的口味有辅助、稳定、补充等作用[1]。香料的主要成分为脂类和醇类;香料的生产方法主要有化学合成、动植物提取以及微生物发酵法。随着生物技术日新月异的发展,生物法生产香料的工作已取得了很多进展。目前,已经得到应用的产香微生物主要包括生香活性干酵母(生香ADY)[2]、假丝酵母、乳酸菌、黑曲霉等。这些产香微生物主要应用于酒类、食醋、香料、面包、烟用香料以及果汁等。如用娄地青霉生产甲基酮;以5-十二酮酸为起始原料,采用面包酵母生产R-δ-十二酸酐;用热带假丝酵母(Candida tropicalis)发酵相应的烷烃生产二梭酸;以乳酸菌发酵生产丁二酮和乙醛[3-4],以棕桐酸为原料,由球拟酵母(Torulopsis bombicola)将其转化为相应的酯或十六烷;用微生物细胞或生物酶催化合成甜味、水果型香料。酵母菌可以部分代谢L-苯基苯胺,包括脱氨基、脱羧基,然后还原,用溶剂萃取发酵液的方法回收产品。这一工艺采用了丰富、价廉的苯基苯胺,它也用于生产高强度甜味剂阿斯巴甜。微生物发酵法与化学合成、动植物提取相比具有很大的优势,这主要是因为微生物的生长周期短、培养简单,不受原料限制;利用微生物制取的香料产物天然、健康安全,既可以降低成本,又可以提高香料的产量,弥补资源的不足,有利于香料大量地被利用,使生产厂家与消费者均受益。固相微萃取(SPME)与气-质联用仪(GC-MS)联用的方法对水果的香气成分测定简单有效,已被应用在欧李、菠萝等水果的香气成分测定上[5-6]。虽然产香菌已经在一些领域得到了很好的应用,但其领域仍不够广泛,有待于进一步拓宽。并且,有些参数还需要进一步的进行实验,以达到更好的效果。
本研究对从安徽砀山果园土壤中分离出的产果香菌进行分离纯化、菌种鉴定以及生长曲线的描绘,利用顶空-固相微萃取法(HS-SPME)结合气-质联用技术(GCMS)分析所产生的水果香味的成分,旨在为该菌在食用香料生产中的应用提供科学依据。
1 材料与方法
1.1材料与仪器
1.1.1 菌株
菌株PY03分离于果树下15cm的土壤中。
1.1.2 培养基
初筛培养基:YEPD培养基[7],外加硫酸链霉素1‰;纯化培养基:YPD培养基;摇瓶培养基:PDA培养基。
1.1.3 仪器与设备
SW-CJ-IF型净化工作台 苏州安泰空气技术有限公司;CCS4S恒温培养摇床 长沙科威实业有限公司;HPX-9272MBE数显不锈钢电热培养箱、YXQ-LS-75SII立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;HS-SFME装置 美国Supelco公司;TraceMS气相色谱-质谱联用仪 美国Finnigan质谱公司。
1.2 方法
1.2.1 菌株筛选
从果园中果树下15cm的土壤中采集土样,通过初筛培养基进行初步筛选,重复3次;再通过纯化培养基进行菌株纯化,重复3次;然后进行菌落的含水状态、外观形态、与培养基结合程度、颜色、正反面颜色、透明度、边缘、气味观察以及通过采用纯化培养基制备显微镜小室通过培养进一步观察;重复以上步骤。最后对这株果香菌进行生长曲线的绘制以及采用PDA培养基斜面在4℃进行菌株保存。
初筛和复筛都是在28℃进行培养,其他没有特别说明培养温度均为28℃。
1.2.2 产物的生理生化分析
1)形态学鉴定:进行菌落的观察以及显微镜小室培养观察;2)生理生化鉴定:根据真菌学知识[8]对实验菌株生理生化特性进行实验和观察;3)对菌株生长曲线的测定:将纯化菌株接种于液体培养基中,摇瓶培养12h。无菌条件下,以10%的体积分数将菌悬液加入到液体培养基中扩大培养,每3h取样,以5000r/min的速度离心15min,倒出上清液用蒸馏水清洗沉淀物两次后,收集菌丝体置于60℃电热鼓风干燥箱中烘干至恒质量,电子天平准确称量,得菌丝湿质量(生物量)。以时间为横坐标,以菌丝湿质量为纵坐标,绘生长曲线。
1.2.3 菌发酵液的初步分析
取菌发酵液200mL,置于1000mL分液漏斗中,分别用150、100、40mL二氯甲烷萃取3次;然后用无水硫酸钠干燥,使用旋转蒸发仪进行浓缩,得到具有香味的淡红色液体,取10滴加入含饱和氯化钠溶液的试管中。
1.2.4 菌发酵液香味成分的GC-MS分析
1.2.4.1 菌发酵液香气成分的固相微萃取[9-10]
首先将固相微萃取装置的萃取头在气相色谱的进样口老化,老化温度250℃,老化时间2h。取6mL菌液,置于15mL样品瓶中,放入转子在45℃恒温。将固相微萃取器的萃取头插入到样品瓶中,抽出纤维头(注意萃取头不要碰到菌液),打开磁力搅拌使转子在菌发酵液中迅速转动,吸附36min,随后缩回纤维头,从样品瓶中拔出萃取头,再将萃取头直接插入气相色谱仪,推出纤维头,于250℃解析2min,用于GC-MS分析。
1.2.4.2 色谱条件
气谱条件:色谱柱:PEG(30m×0.25m,0.25μm);程序升温:40℃保持4min,5℃/min升温至90℃,10℃/min升温至230℃,保持5min。载气He,流速0.80mL/min,检测器温度250℃,入口温度250℃。
质谱条件:EI电离源,电子能量70eV。离子源温度200℃。
2 结果与分析
2.1 菌株的形态学鉴定
2.1.1 菌落观察
生长较快,培养12h即可长出白色菌落,菌落平板如图1。
图1 菌株平板划线观察Fig.1 Observation of strain of streak plate
2.1.2 显微镜小室培养观察
将分离到的菌种,于显微镜下观察;结果如图2A、2B
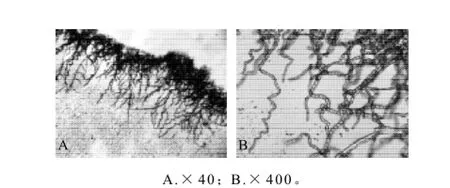
图2 菌体形态Fig.2 Morphology of the strain
该菌菌落呈平面扩散、生长快、扁平、乳白色、短绒状或近于粉状、干燥。有同心圈和放射线,有的
呈中心突起。在液体培养基中生白醭,褶皱薄膜,培养液混浊,呈絮状沉淀。光学显微镜下观察,有单细胞和多细胞真菌丝及假菌丝混杂在一起,裂殖,菌丝为有横隔的真菌丝,有的为二叉分枝。菌丝成熟后断裂成单个或成链、长筒形、末端钝圆的节孢子。
2.2 产物的生理生化特性分析
菌株的糖发酵实验和部分生理生化实验结果分别见表1~3。

表1 菌株的糖发酵实验Table 1 Sugar fermentation test of strains

表2 菌株对碳源的同化Table 2 Carbon assimilation of strains
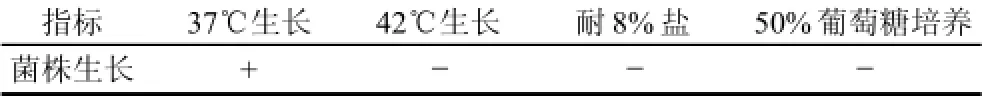
表3 菌株生理实验Table 3 Physiologycal experiments of strains
由表1~3可知:菌株对对糖发酵的能力较弱,对碳源的同化能力较弱,对温度、NaCl、葡萄糖的耐性也较差。
根据实验结论结合真菌学知识[8]鉴定该菌为半知菌亚门,丝孢纲,丝孢目,丛梗孢科,地霉属。
2.2.1 液体发酵实验观察
将纯化菌株接种于摇瓶液体培养基中(250mL三角瓶中加入100mL液体培养基),200r/min,26℃,振荡培养3d。培养12h即可观察到发酵液变浑浊并开始慢慢变红,培养24h即可闻到菠萝和香蕉的香味。
2.2.2 生长曲线的绘制
从该菌的生长曲线可以看出,该地霉属菌株24h即可进入稳定期,48h后进入衰亡期。
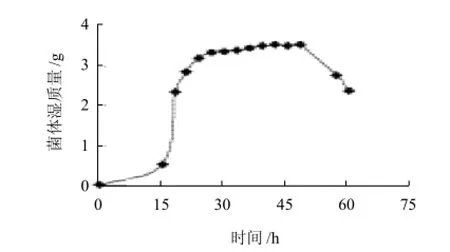
图3 菌株的生长曲线Fig.3 Growth curve of the strain
2.3 菌液产物的分析
2.3.1 产物的初步分析
具有香味的淡红色液体加入含饱和氯化钠溶液的试管后出现分层现象,上层为红色的发酵液,下层为水。红色的发酵液能够被饱和氯化钠溶液萃取,根据相似相溶原理可知红色的发酵液应为非极性物质。
2.3.2 GC-MS结果分析
采用HS-SPME结合GC-MS从菌株发酵液中提取并分离得到51种化合物,如图4所示。通过NIST/WELLY标准谱库数据处理系统,并结合有关文献标准图谱进行核对分析,共鉴定出其中46种香气组分。采用色谱面积归一化法计算已定性的香气物质的相对含量,结果见表4。
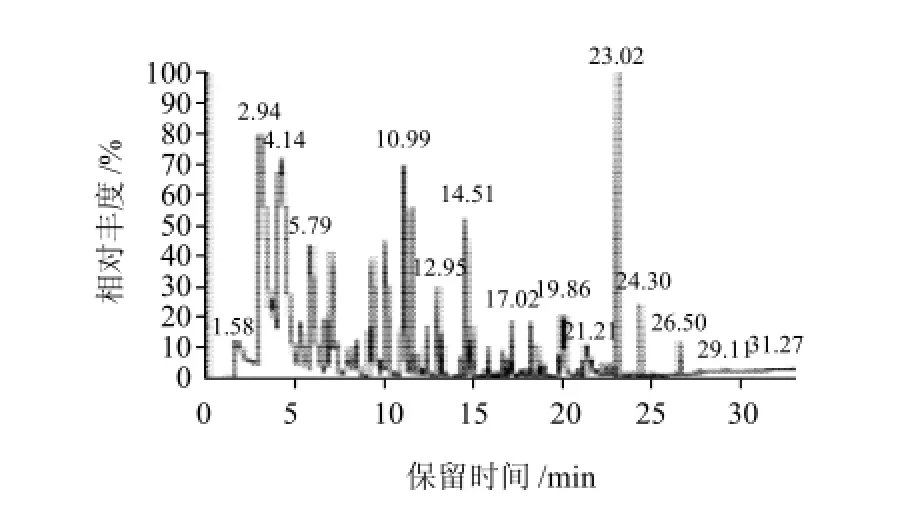
图4 菌株发酵液香气成分GC-MS总离子流图Fig.4 GC-MS total ion current chromatogram of aroma components from fermented media
香气成分通常是指那些通过味觉和嗅觉感觉到的物质。挥发性香气物质约2 0 0 0种,包括酯类、醛类、内脂类、萜类、醇类、羰基化合物和一些含硫化合物等[11]。表4显示,鉴定出的46种组分峰面积之和占总离子流出色谱峰面积的88.11%。这些香气成分包括酯类、醇类、醛类、萜类、芳香烃类等成分。在已鉴定的香气组分中,种类最多的是酯类,共32种,其含量占总量的73.84%;醇类物质8种,占12.53%;萜类物质3种,占1.70%;醛类物质1种,占0.33%;芳香烃类物质2种,占0.31%。
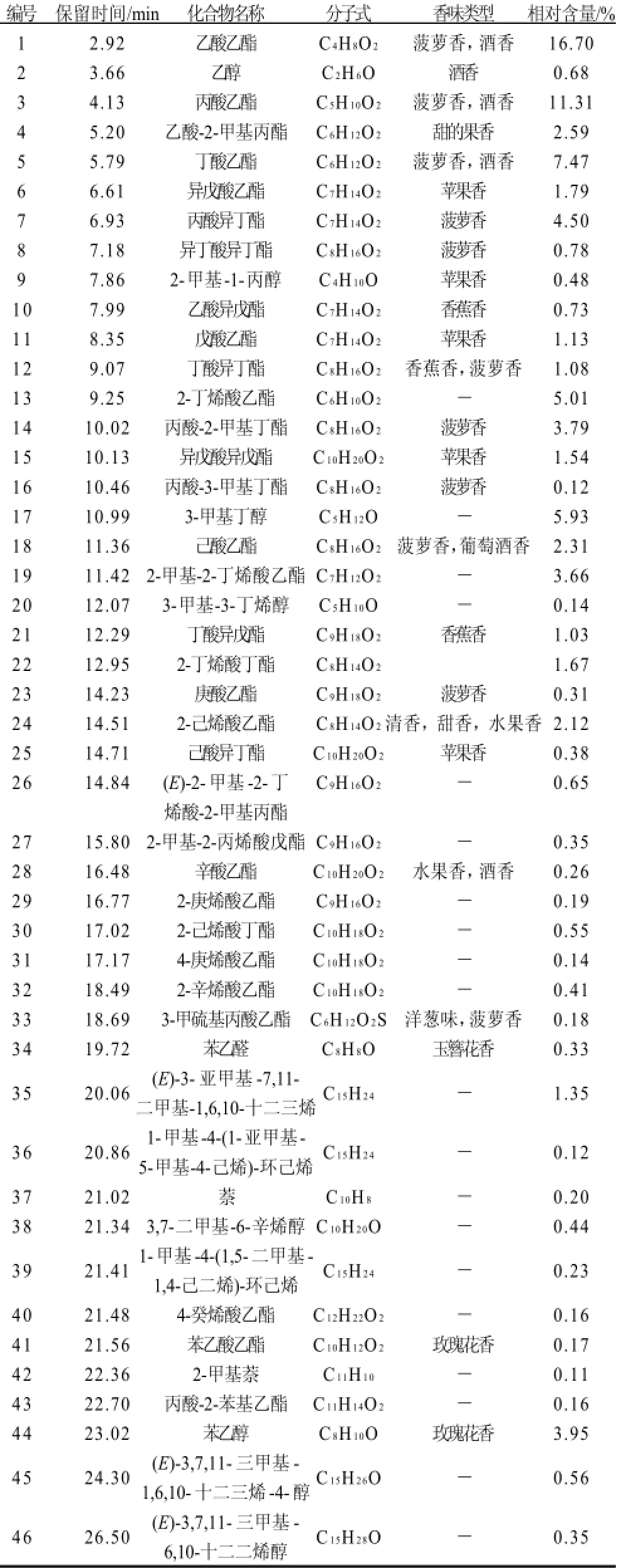
表4 菌株发酵液主要香气成分GC-MS分析结果Table 4 GC-MS analysis results of aroma components from fermented media
从单一香气成分及香气成分的感官特征方面分析,菌发酵液中主要香气物质为:乙酸乙酯(16.70%)、丙酸乙酯(11.31%)、丁酸乙酯(7.47%)、2-丁稀酸乙酯(5.01%)、丙酸异丁酯(4.50%)、丙酸-2-甲基丁酯(3.79%)、2-甲基-2-丁烯酸乙酯(3.66%)、乙酸-2-甲基丙酯(2.59%)、己酸乙酯(2.31%)以及苯乙醇(3.95%)、3-甲基丁醇(5.93%)。这些香气物质含量占总量的67.22%。由此可见,主要香气成分为酯类和醇类。这也是该菌发酵液散发出浓郁水果香味的重要原因。
本次测定得到的46种香气成分中,乙酸乙酯、丁酸乙酯、己酸乙酯、3-甲硫基丙酸乙酯等化合物常出现在香蕉、菠萝、草莓等果品的香气成分中。苯乙醇是一种具有花香的液体,它具有柔和、愉快而持久的玫瑰香味从而被广泛应用于各种食用香精和烟用香精中。
3 讨 论
从果园的泥土中筛选得到的地霉属菌株,生长条件简单,可以利用工业上的废料解决环境污染问题[12-13],生长速度快、周期短、成本低,在工业上应用十分广泛。发酵12h后能够产生红色色素,24h后能够产生天然的香蕉、菠萝等香味,这在其他资料上也有报道[14]。
菌发酵液感官特征由芳香成分的种类、含量、感官阈值及各成分间的相互作用所决定。由于芳香物质易于挥发,同时菌的生长受到各种条件的影响,使得菌发酵液芳香物质的生物合成过程受到不同程度的影响,可导致部分香气成分难以定性,但是主要的香气成分是稳定的,是能够测量的。本次测定的菌发酵液香气总含量已经占总峰值的88.11%,包括酯类、醇类、醛类、萜类、芳香烃类等成分,这些成分都具有浓厚的水果型香味。
通过从发酵液中提纯所得到的酯类混合物所散发出的香味是天然合成的复合香味,这是人工化学合成方法很难合成出来。运用气相色谱-质谱联用仪的手段确定菌发酵液芳香物质组分以及含量为下一步在实践中应用提供了科学依据。该菌株所具有的增香、增色功能,可以应用到酱油、醋等调味品的生产中,同时可以作为食品添加剂等,应用到食品工业的许多方面,具有潜在经济价值。值得注意的是在混合物中有一种化合物含有硫元素,它是否在菌发酵液中起到重要作用,有待于进一步实验证实。
[1]贺荣平. 香料与香精的应用[J]. 农产品加工, 2008(9)∶ 12-13.
[2]DICKINSON J R, SALGADO L E J, HEWLINS M J E. The catabolism of amino acids to long chain and complex alcohols in Saccharomy-
ces cerevisiae[J]. Biol Chem, 2003, 278(10)∶ 78-81.
[3]GARDE S, AVILA M, FERNANDEZ-GARCIA E, et al. Volatile compounds and aroma of Hispanico cheese manufactured using lacticin 481-producing Lactococcus lactis subsp. lactis INIA 639 as an adjunct culture[J]. Int Dairy J, 2007, 17(6)∶ 717-726.
[4]GARDINI F, LANCIOTTI R, GUERZONI M E, et al. Evaluation of aroma production and survival of Streptococcus thermophilus, Lactobacillus delbrueckii subsp bulgaricus and Lactobacillus acidophilus in fermented milks[J]. Int Dairy J, 1999, 9(2)∶ 125-134.
[5]薛洁, 涂正顺, 常伟, 等. 中国特有野生水果欧李(Cerasus humilis)香气成分的GC-MS分析[J]. 中国食品学报, 2008, 8(1)∶ 125-128.
[6]何应对, 魏长宾, 李绍鹏, 等. 菠萝香气成分的GC-MS分析[J]. 福建分析测试, 2007, 16(4)∶ 1-4.
[7]刘天明, 王慧, 刘庆军, 等. 产香白地霉发酵无醇绿啤饮料研究[J].酿酒科技, 2007(10)∶ 78-80.
[8]周与良, 邢来君. 真菌学[M]. 北京∶ 高等教育出版社, 1986∶ 417-439.
[9HOWARD K L, MIKE J H, RIESEN R. Validation of a solid-phase microextraction method for headspace analysis of wine arom a components [J]. Am J Enol Vitic, 2005, 56(1)∶ 37-44.
[10]YARROW D. Method for the isolation, maintenance and identification of yeasts[M]//KURTZMAN C P, FELL J W. The yeasts∶ a taxonomic study. 4th ed. Amsterdam∶ Elsevier Sciences, 1998.
[11]贾惠娟. 水果香气物质研究进展[J]. 福建果树, 2007(2)∶ 31-34.
[12]DAIGLE P, GELINAS P, LEBLANC D, et al. Production of aroma compounds by Geotrichum candidum on waste bread crumb[J]. Food Microbiology, 1999, 16∶ 517-522.
[13]曲静然, 刘玉, 宋俊梅. 豆腐废水发酵生产白地霉的研究[J]. 食品研究与开发, 2005, 26(3)∶ 99-102.
[14]王庆国, 刘天明, 韩小龙, 等. 两株产果香菌株的初步鉴定及香味成分分析[J]. 食品研究与开发, 2007, 28(6)∶ 16-19.
Preliminary Identification and Aroma Component Analysis in an Aroma-producing Strain
LI Feng,MING Yan-hong,LI Yuan-yuan,PAN Yao,CHEN Qi
(Anhui Key Laboratory of Plant Resources and Biology, College of Life Sciences, Huaibei Coal Industry Teacher’s College, Huaibei 235000, China)
An aroma-producing strain was isolated and purified from soil samples collected from Dangshan Anhui province in China and prliminarily identified as Geotrichum based on morphological characteristivs. Hs-S-SPME and GC-MS results indicated that major aroma components were esters and alcohols. The esters exhibited the highest content, which were about 32 species and accounted for 73.84%. In addition, the alcohols were 8 species, which were accounted for 12.53%.
fruity aroma-producing strain;growth curve;aroma components;GC-MS
Q93.331
A
1002-6630(2010)09-0219-05
2010-02-03
安徽高校省级自然科学研究重点项目(KJ2008A086)
李峰(1970—),男,副教授,博士,主要从事微生物生理、发酵和分子遗传学研究。E-mail:rx2500@163.com



