梁淑轩,马二红,许成燕,赵燕燕,孙汉文,*
枸杞多糖的硒化及其对人宫颈癌细胞的抑制作用
梁淑轩1,马二红1,许成燕1,赵燕燕2,孙汉文1,*
(1.河北大学化学与环境科学学院,河北省分析科学重点实验室,河北 保定 071002;2.河北大学医学部实验中心,河北 保定 071002)
在硝酸催化作用下,利用亚硒酸钠对枸杞多糖进行分子修饰,合成硒化枸杞多糖,反应条件为硝酸体积分数0.5%,70℃反应10h,透析24h。采用体外抗肿瘤实验测定硒化枸杞多糖对人宫颈癌细胞生长的抑制作用。结果显示硒化枸杞多糖对人宫颈癌细胞具有一定的抑制作用,与未硒化的枸杞多糖相比有显着性差异,且呈一定的剂量依赖性。
枸杞多糖;硒化枸杞多糖;人宫颈癌细胞;抑制
枸杞子是一种药食两用的食物,枸杞中含有大量的VC、β-胡萝卜素、铁等有益成分,长期食用可以改善体质。枸杞多糖作为枸杞子的主要活性成分,日益得到重视,它具有显着的降血糖、降血脂、抗癌、减肥、抗氧化等[1-3]作用,其广泛的药理作用展示了其在新药及功能性食品的研究上具有广阔的前景。
硒是生命必需的微量元素[4],具有清除自由基、保护细胞拮抗毒性、提高人体免疫功能,保护骨髓造血功能及潜在的抗癌、防衰老等多种作用[5]。而硒多糖作为一种有机硒化合物,能发挥微量元素硒和多糖的双重功能,生物活性普遍高于硒和多糖,更易于为机体吸收和利用[6-7]。
目前硒多糖的研究在国内外尚处于起步阶段,但由于硒多糖独特的生物活性,近几年已成为研究热点,其在抗氧化、抗衰老、抗肿瘤等方面发挥越来越多的作用[8-9]。硒多糖主要来源于天然硒多糖和合成硒多糖[10],本实验将李光友等[11]合成海洋硒多糖的方法应用在枸杞多糖,并进行适当的改进,以合成硒化枸杞多糖,该合成工艺简单、安全、对环境污染较小、产物回收率较高;并采用MTT法测定硒化枸杞多糖对人宫颈癌细胞的抑制作用,探讨硒化后提高枸杞多糖生物活性的可能。
1 材料与方法
1.1 材料与试剂
枸杞多糖由本实验室用宁夏枸杞子以超声辅助水提取制备[12]。
亚硒酸钠、盐酸、硝酸、无水乙醇、氯仿、正丁醇、二甲基亚砜(DMSO)均为分析纯;实验用水均为二次去离子水;人宫颈癌Hela细胞 河北大学医学部;DMEM培养基 上海坤肯生物化工有限公司;新生小牛血清 杭州四季青生物工程有限公司;四甲基偶氮唑盐(MTT) 北京索莱宝科技有限公司。
1.2 仪器与设备
EQUINOX 55红外光谱分析仪 德国Bruker光谱仪器公司;UV-265型紫外分光光度计 日本岛津公司;Heidolph 4002旋转蒸发仪 德国Heidolph公司;FD-1台式冷冻干燥机 北京博医康实验仪器有限公司;MCO-18AIC型CO2培养箱 日本三洋设备有限公司;CKX41型倒置显微镜 日本奥林巴斯有限公司;Fax2100酶联免疫检测仪 美国Awareness公司;MD 34-3500透析袋北京索莱宝科技有限公司。
1.3 方法
1.3.1 枸杞多糖的纯化
按Sevag法脱蛋白[13]:称取一定量的枸杞多糖,按枸杞多糖水溶液20%体积加入氯仿,随之加入氯仿体积20%的正丁醇,混合物剧烈振荡20min,离心,倾出上清液,除去中间变性蛋白和下层氯仿,重复操作到中间层无变性蛋白为止,收集上清液,浓缩,冷冻干燥得枸杞多糖(LBP)。
1.3.2 硒化枸杞多糖的制备
称取2.0g LBP置于三口烧瓶中,加入硝酸体积分数为0.5%的水溶液50mL加热搅拌形成透明溶液,加入1.6g亚硒酸钠,加热到70℃搅拌反应10h,反应冷却后,减压蒸馏至10~20mL,加入3倍体积的无水乙醇,使其完全沉淀。离心分离,沉淀用无水乙醇洗涤3次,加少量的水溶解,用去离子水透析24h,未透液经浓缩、冷冻干燥得硒化枸杞多糖(Se-LBP)。
1.3.3 硒含量的测定
1.3.3.1 样品处理
准确称取0.1g Se-LBP样品于锥形瓶中,加2mL浓硝酸浸泡,盖上坩埚盖,放置过夜,次日于电热板上加热近干,冷却,加0.5mL H2O2,继续消化至冒白烟,当消化液呈淡黄色或无色时取下冷却,用少量的去离子水冲洗杯壁,再蒸发至冒白烟将余酸赶尽,冷却,用去离子水将消化液转移至10mL量瓶中,定容。
1.3.3.2 测定方法
准确移取上述消化液1.0mL于25mL比色管中,依次加入2mL 4mol/L盐酸、3mL 1mol/L碘化钾、3mL 2mol/L乙酸钠、2mL 0.1g/L聚乙烯醇及2mL 0.002g/L孔雀绿溶液,用二次去离子水稀释至刻度,摇匀。放置40min后,用1cm比色皿,以空白试剂为参比,在波长670nm处测定吸光度[14],根据硒标准曲线计算出样品中硒的含量。
1.3.4 硒化枸杞多糖对Hela细胞增殖的抑制作用
1.3.4.1 细胞培养
Hela细胞置于37℃温箱,饱和湿度,含5%的CO2孵箱中培养,DMEM培养基含体积分数10%胎牛血清、青霉素、链霉素各100U/mL。根据细胞生长状态每4~5d传代1次。取生长状态稳定呈对数生长期细胞用于实验。
1.3.4.2 MTT法测定细胞抑制率[15]
取对数生长期的Hela细胞,经0.25%胰蛋白酶消化后,用培养液调整细胞浓度至2×104个/mL,接种于96孔培养板中,每孔90μL。待细胞完全贴壁后,将枸杞多糖、硒化枸杞多糖按实验设计的所需浓度分别加入各孔,质量浓度分别为25、50、100、200μg/mL,每组设4个复孔,另外设阴性对照组和不加细胞的空白对照组,在CO2培养箱中培养48h,倒置显微镜下观察,然后每孔加入10μL 0.5%的MTT溶液,继续培养4h。取出96孔板,弃去培养液,每孔加入100μL DMSO,置摇床上低速振荡10min,使结晶物充分溶解。用酶联免疫检测仪在波长570nm处测量各孔的吸光度。每次实验重复3次,计算细胞生长抑制率:
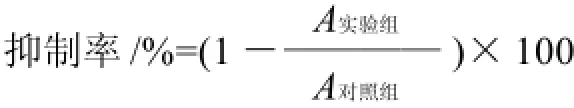
2 结果与分析
2.1 硒化枸杞多糖合成工艺条件研究
2.1.1 温度的影响
改变反应的温度,按1.3.2节中其他反应条件进行硒化反应,按1.3.3.2节的实验方法测定产物硒含量,硒标准溶液线性回归方程Y=0.1706+0.84X,相关系数R=0.99863。硒含量在0~0.5μg/mL服从比尔定律。产物中含硒量结果见表1。

表1 温度对含硒量的影响Table 1 Effect of reaction temperature on the content of Se
2.1.2硝酸体积分数的影响
改变硝酸的体积分数,按1.3.2节中其他反应条件进行硒化反应,测定产物中的硒含量,结果见表2。

表2 硝酸体积分数对含硒量的影响Table 2 Effect of HNO3concentration on the content of Se
2.1.3 亚硒酸钠用量的影响
改变亚硒酸钠用量,按1.3.2节中其他反应条件进行硒化反应,测定产物中的硒含量,结果见表3。

表3 亚硒酸钠用量对含硒量的影响Table 3 Effect of Na2SeO3on the content of Se
从表1~3可以看出,不同反应条件下硒多糖的硒含量相差较小,70℃时反应得到的硒多糖中硒含量最高。酸性条件下硒化时多糖降解,酸度和反应温度增加,硒化时多糖水解程度加强,降解后的低聚寡糖被透析除去,硒含量和硒多糖收率较低,透析时间太短,小分子无机硒化物不能完全脱附,当透析时间由1d到3d,按1.3.2节方法合成的硒多糖中含硒量下降,因此确定硒化反应的条件是温度70℃,硝酸体积分数0.5%,透析24h,参考文献[11]中多糖硒化的反应条件,选择反应时间为10h。
2.2 硒化枸杞多糖结构表征
2.2.1 紫外光谱分析
LBP、Se-LBP样品溶于水,在UV-265型紫外分光光度计扫描分析图(1、2)。
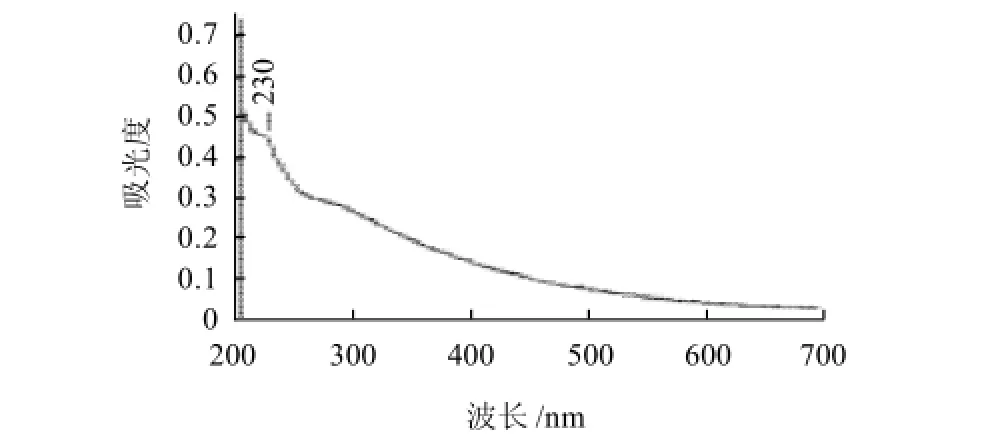
图2 硒化枸杞多糖的紫外光谱Fig.2 UV spectrum of selenitedLycium barbarumpolysaccharides
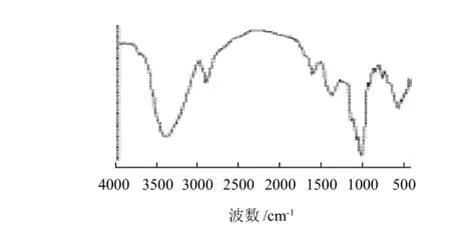
图3 枸杞多糖的红外光谱图Fig.3 IR spectrum ofLycium barbarumpolysaccharides
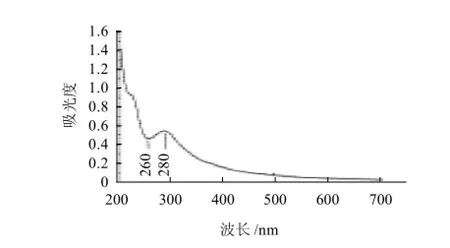
图1 枸杞多糖的紫外光谱Fig.1 UV spectrum ofLycium barbarumpolysaccharides
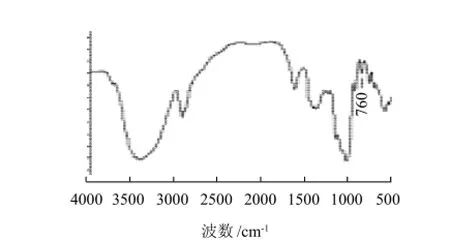
图4 硒化枸杞多糖的红外光谱图Fig.4 IR spectrum of selenitedLycium barbarumpolysaccharides
LBP的紫外光谱显示在280nm处有一个蛋白质吸收峰,在260nm处有一个核酸吸收峰[16],经过除蛋白和硒化后,两个峰消失,而在230nm处有亚硒酸酯的吸收峰,而LBP无此吸收峰位,说明Se-LBP分子中引入了亚硒酸根。
2.2.2 红外光谱分析
分别取少量LBP、Se-LBP样品,加入KBr压片在EQUINOX 55红外光谱分析仪扫描分析(图3、4)。硒化并透析24h后的Se-LBP的红外光谱在保持LBP的基本构型,多糖的特征吸收峰不变的情况下,在760cm-1处附近有亚硒酸酯特征吸收峰,证明透析后的Se-LBP中无游离的亚硒酸根,而是相互结合形成化学键,其分子中存在亚硒酸基团。Se-LBP的紫外光谱和红外光谱分析得到了相一致的结果,表明了硒与枸杞多糖的结合。
2.3 枸杞多糖和硒化枸杞多糖对Hela细胞的增殖抑制作用
在25~200μg/mL作用48h枸杞多糖对Hela细胞没有明显的抑制作用。硒化枸杞多糖对Hela细胞的抑制作用随着质量浓度的增加和含硒量的增加逐渐加强,在200μg/mL有较明显的抑制作用,其中以按1.3.2节制备的样品的抑制率最高,为24.5%,其结果见表4。

表4 LBP和硒化LBP对Hela细胞增殖抑制作用(n=4)Table 4 Inhibition effects of LBP and selenited LBP on human cervical carcinoma cells (n=4)
3 结 论
近年来,人们通过人工方法在适宜培养条件下将无机硒添加到真菌、藻类等的培养基中,通过微生物的生长代谢,对硒进行富集和生物转化,从而获得硒多糖[17-18],或者通过化学合成的方法获得硒多糖[19]。但目前国内发现及人工合成的硒多糖种类有限,各种硒多糖化学结构及其在生物体内的作用机制尚未完全清楚,因此对硒多糖进行更深入的研究,具有十分重要的意义。
本实验在温和条件下,通过化学反应使无机硒转化为有机硒,合成了硒化枸杞多糖,合成的硒多糖在安全剂量范围内对Hela细胞均有较好的抑制作用,明显优于枸杞多糖,而且抑制率随质量浓度增加而增大。为今后硒多糖在保健或药物方面的开发提供一定的参考价值,硒化枸杞多糖对Hela细胞的作用机制及活性成分的筛选有待进一步研究。
[1]罗琼, 李瑾玮, 张声华. 枸杞及其多糖对家兔血脂的影响[J]. 食品科学, 1997, 18(4)∶ 5-7.
[2]张民, 朱彩平, 施春雷, 等. 枸杞多糖-4的提取、分离及其对雌性下丘脑损伤性肥胖小鼠的减肥作用[J]. 食品科学, 2003, 24(3)∶ 114-117.
[3]严成, 严夏. 枸杞多糖提取工艺比较及体外抗氧化性研究[J]. 食品科学, 2008, 29(7)∶ 183-187.
[4]BININGER M, PILAWA S, FLOHE L. Trends in selenim biochemistry [J]. Natural Products Reports, 2002, 19∶ 693-718.
[5]TAPIERO H, TOWNSEND D M, TEW K D. The antioxidant role of selenium and selenium and seleno-compounds[J]. Biomedicine and Pharmacotherapy, 2003, 57(3/4)∶ 134-144.
[6]许峰, 张瞳, 周波, 等. 食用覃菌硒多糖研究进展[J]. 生物技术, 2006, 16(l)∶ 86-88.
[7]STAAF M, YANG Z N, HUTTUNEN E, et al. Structural elucidation of the viscous exopolysaccharide produced by Lactobacillus helveticus Lb161[J]. Carbohydrade Research, 2000, 326(2)∶ 113-119.
[8]李晓坤, 阎吉昌, 崔晓莹. 硒多糖的研究与应用进展[J]. 中草药, 2006, 37(7)∶ 6-7.
[9]MIERSCH J, TSCHIMEDBALSHIR M, BARLOCHER F, et al. Heavy metals and thiol compounds in Mucor racemosus and Articulospora tetracladia[J]. Mycological Research, 2001, 105(7)∶ 883-889.
[10]蒋京, 廖宝凉. N-含硒壳聚糖衍生物的合成、表征及其生物活性[J].广东微量元素科学, 2000, 7(5)∶ 14-17.
[11]李光友, 缪锦来, 刘发义. 硒化多糖化合物及其制备方法∶ 中国, CN 1288899C[P]. 2001-03-28
[12]孙汉文, 刘占锋. 枸杞多糖的超声波辅助水提取与分级纯化[J]. 食品工业科技, 2009, 30(3)∶ 230-233.
[13]田丽梅, 王旻. 枸杞多糖的提取分离和其组成研究[J]. 中国中药杂志, 2006, 31(19)∶ 1602-1607.
[14]金松子, 蔡振华, 蒋庆峰. 分光光度法测定富硒蛋粉中的硒含量[J].现代食品与药品杂志, 2007, 17(1)∶ 37-39.
[15]于荣, 柳庆玲, 赵冬梅. 榄香烯对人宫颈癌细胞Hela的体外抑瘤效应[J]. 滨州医学院学报, 2006, 29(2)∶ 106-107.
[16]王玲, 李欣, 钱玉昆. 枸杞多糖的分离、纯化、分析及免疫作用的研究[J]. 昆明医学院学报, 1995(6)∶ 29-31.
[17]和朝军, 李景原, 李宗义. 灵芝硒多糖的研究进展[J]. 农业科学, 2006 (3)∶ 9-11.
[18]徐峰, 张瞳, 周波. 食用蕈菌硒多糖研究进展[J]. 生物技术, 2006, 16 (1)∶ 86-88.
[19]唐家骏. 硒化角叉菜胶的制备及其理化性质和生化活性的研究[J]. 生物化学与生物物理学报, 1988, 20(3)∶ 259-264.
Selenitation of Lycium barbarum Polysaccharides and Inhibiting Effect on Human Cervical Carcinoma Cells Cervical Carcinoma Cell
LIANG Shu-xuan1,MA Er-hong1,XU Cheng-yan1,ZHAO Yan-yan2,SUN Han-wen1,*
(1. Key Laboratory of Analytical Science of Hebei Province, College of Chemistry and Environmental Science, Hebei University Baoding 071002, China;2. Medicine Experimental Center, Hebei University, Baoding 071002, China)
Lycium barbarum polysaccharides were modified by sodium selenite in the presence of nitric acid as catalyst. The optimal reaction condition was the reaction at 70 ℃ for 10 h with the following dialysis for 24 h. The anticancer activity of selenited Lycium barbarum polysaccharides was evaluated in vitro. Results indicated that selenited Lycium barbarum polysaccharides could inhibit human cervical carcinoma cells, and exhibited a significant difference from Lycium barbarum polysaccharides.
Lycium barbarum polysaccharides;selenited Lycium barbarum polysaccharides;human cervical carcinoma cell;inhibition
TS255.3
A
1002-6630(2010)09-0243-04
2009-08-27
河北省自然科学基金项目(2005000100);国家自然科学基金项目(30772006)
梁淑轩(1967—),女,教授,博士,研究方向为食品分析。E-mail:liangsx168@yahoo.com.cn
*通信作者:孙汉文(1945—),男,教授,硕士,研究方向为食品安全。E-mail:hanwen@hbu.edu.cn



