孙爱萍,郑永华,杨海燕,李学文,,*,韩 伟,张喜军
(1.新疆农业大学食品科学学院,新疆 乌鲁木齐 830052;2.南京农业大学食品科技学院,江苏 南京 210095)
1-甲基环丙烯处理对采后甜瓜活性氧相关代谢的影响
孙爱萍1,郑永华2,杨海燕1,李学文1,2,*,韩 伟1,张喜军1
(1.新疆农业大学食品科学学院,新疆 乌鲁木齐 830052;2.南京农业大学食品科技学院,江苏 南京 210095)
研究1-甲基环丙烯(1-MCP)处理对甜瓜(Cucuis melo L.ssp.melo pang)果实在贮藏过程中对其活性氧(reactive oxygen species,ROS)相关代谢的影响,在室温 (22~25℃)条件下,用1μL/L 1-MCP处理早熟甜瓜“早黄蜜”24h,贮藏于22℃,对果实中活性氧代谢的相关酶:超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)的活性及超氧阴离子(O2-·)和丙二醛(MDA)含量进行测定。结果表明:1-MCP处理抑制了甜瓜果实CAT活性的下降,贮藏前期提高了SOD活性,促进POD活性迅速升高,并使其在第4天达到峰值,贮藏过程高于对照果实。1-MCP处理可显着降低果实中O2-·的产生速率,抑制MDA的产生,延缓甜瓜果实采后衰老。
1-甲基环丙烯;甜瓜;活性氧代谢
早熟哈密瓜是典型的呼吸跃变型果实,在成熟期间伴随大量乙烯的产生,诱导果实迅速成熟,促进衰老[1]。早熟甜瓜上市早,品质优,口味正,具有浓郁的香味,深受消费者的喜爱,但夏季温度高,果实迅速衰老,品质劣变,腐烂严重,通常架期只有3~5 d。“活性氧”是引起植物膜质过氧化的主要因素,破坏膜的生物功能,加速植物的衰老[2]。水果采后品质的下降与氧化胁迫有关[3]。抗氧剂处理对保持采后无网纹香瓜品质有重要的作用[4]。
1-甲基环丙烯(1-methylcyclopropene,1-MCP)是近几年发现的新型乙烯作用抑制剂,阻止乙烯与受体结合,抑制依赖于乙烯的生理反应[5]。1-MCP处理促进了青花菜[6]、苹果[7]过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)活性的升高,延缓了青花菜,苹果的衰老。本实验以早熟甜瓜“早黄蜜”为试材,研究室温贮藏条件下,1-MCP处理对采后甜瓜果实“活性氧”代谢的影响,以探讨1-MCP延缓采后果实衰老的机理,为其在采后甜瓜果实贮运中的
应用提供理论依据。
1 材料与方法
1.1 材料与试剂
以早熟甜瓜品种“早黄蜜”为试材,于2007年7月12日采自新疆昌吉榆树沟三队。选择七成熟(绿熟)的果实,留2~3cm的果柄,用剪刀剪下,放入箱中,当天运回新疆农业大学食品科学学院实验室。挑选果实色泽基本一致,大小均匀,无机械损伤和病害的果实用于实验处理。
氯化硝基氮蓝四脞、硫代巴比妥酸、聚乙烯吡咯烷酮 国药集团化学试剂公司;核黄素(生化试剂) 北京奥博星生物技术责任有限公司;其他试剂均为分析纯;双蒸水。
1.2 仪器与设备
电子天平 梅特勒-托利多仪器(上海)有限公司;5415R型高速冷冻离心机 德国Eppdorf公司;UV-1240型紫外-可见分光光度仪 日本岛津公司;HH-4型数显水浴锅 常州国华电器有限公司。
1.31 -MCP处理
1-MCP处理参照Menniti的方法[8]进行,处理浓度及处理时间按预实验的结果进行。将甜瓜果实放入塑料周转箱(每箱8个)中,放置在由PE膜(0.1mm厚)制成的密封的1m3帐中,将精确称量的1.6g 1-MCP粉剂(0.14%,聪明鲜粉剂 AgroFresh Inc公司) 放入50mL烧杯中,放入PE帐内,按1:5(m/V)加入无离子水,轻摇,迅速密封PE帐,其产生的1-MCP量为1μL/L,在25℃条件下,熏蒸24h后,揭开PE帐,通风30min,贮藏于室温(22~25℃,RH 35%~45%)下。每隔2d测定相关指标,以不加1-MCP的为对照。实验重复3次,每个处理72个果实。
1.4 指标测定
1.4.1 过氧化氢酶(catalase,CAT)活性测定
参照李合生的方法(高锰酸钾滴定法)[9]:准确称取甜瓜果肉1g,加入5mL 0.05mol/L的磷酸缓冲液(pH7.8)、0.5g石英沙,冰浴研磨,12000×g离心20min,上清液待用。取0.5mL上清液,加5mL磷酸缓冲液(含H2O2),25℃水浴15min后,加2mL 10% H2SO4溶液终止反应,用1.85mmol/L的高锰酸钾溶液滴定,空白:0.5mL失活酶液加入5mL磷酸缓冲液(含6mmol/L H2O2),25℃水浴15min后加10% H2SO4溶液2mL终止反应,用1.85mmol/L的高锰酸钾溶液滴定。以H2O2消失量表示CAT活性(H2O2mg/(min·g mf))
1.4.2 过氧化物酶(peroxidase,POD)活性测定
用愈创木酚法测定过氧化物酶[10]。准确称取甜瓜果肉1g,加5mL的0.2mol/L的硼酸缓冲液(pH8.7,含5mmol的亚硫酸氢钠),冰浴研磨,12000×g离心10min,取2mL 0.2mol/L pH5.4的醋酸缓冲液,加入1mL的愈创木酚、0.5mL的酶液,在30℃水浴10min后,加入0.5ml H2O2混匀,立即比色,于460nm处测定OD值的变化(测定3min),以每分钟△OD460增加0.001为一个酶活性单位(U),酶活性用U/(min·g mf)表示。
1.4.3 超氧化物歧化酶(superoxide dismutase,SOD)活性测定
用氮蓝四唑光还原法测定SOD的活性[11]:准确称取甜瓜果肉1g,加5mL 50mmol的磷酸缓冲液(pH7.8),研磨匀浆,10000×g离心20min,上清液待用。以不加酶液(磷酸缓冲液代替)为最大还原管,用磷酸缓冲液为空白。在3000lx的光照培养箱中光照15min。取出后迅速测定560nm处的OD值,以抑制NBT光还原50%为一个酶活性单位(U/(min·g mf))
1.4.4 超氧阴离子自由基(O2-·)产生速率测定
参照王爱国等[12]的羟胺法测定:准确称取甜瓜果肉2g,加入5mL 5%三氯乙酸,冰浴研磨后,12000×g离心10min,取上清液待用。取清液1mL加入0.85mL 1.25%氢氧化钠溶液和1mL 1mmol/L的盐酸羟胺溶液,25℃条件下水浴30min反应后,取出加入1mL 40μmol/L亚硝酸钠溶液,吸取混合液1mL,加入1mL 40μmol/L亚硝酸钠和1mL 7mmol/L α-萘胺,25℃反应20min,取出测定A530。超氧阴离子自由基产生速率用nmol/(min·g mf)表示。
1.4.5 丙二醛含量的测定
丙二醛含量的测定[9]:称取1g果肉,加入5mL 5%的三氯乙酸溶液研磨,离心后取上清液2mL,加入2mL 0.67%的硫代巴比妥酸(5%三氯乙酸配制),混匀后在沸水浴上煮沸30min后,冷却后,离心,在450、532、600nm处测定吸光度。空白:以2mL蒸馏水水代替酶液作为空白。丙二醛含量用μmol/g mf表示。
2 结果与分析
2.11 -MCP处理对甜瓜CAT活性的影响
1-MCP处理甜瓜果实的CAT活性在前6d低于对照,呈下降趋势,6d后呈缓慢上升(图1)。对照果实的CAT活性在整个贮藏期间快速下降,从第2天的0.18 H2O2mg/ (min·g mf)降低到第10天的0.06H2O2mg/(min·g mf),下降了66%。1-MCP处理果实CAT活性在整个贮藏阶段总体有轻微的上升的趋势,第2天为0.15H2O2mg/ (min·g mf),贮藏结束为0.16 H2O2mg/(min·g mf)。1-MCP处理6d后,1-MCP处理果实的CAT活性大
于对照果实的CAT活性,第8天后显着高于对照果实(P<0.05)。

图1 1-MCP处理对甜瓜过氧化氢酶活性的影响Fig.1 Change in CAT activity in control and 1-CMP-treated melon fruits during storage at 22 ℃
2.21 -MCP处理对甜瓜POD活性的影响
甜瓜果实采后POD活性,初期(处理后前4d)呈现上升阶段,1-MCP处理果实的POD活性迅速上升,并于贮藏第4天时达到高峰,接着下降,但一直高于对照(图2)。达到高峰时1-MCP处理果实的POD活性为335.5 U/(min·g mf)是对照(247.08 U/(min·g mf))的1.35倍。处理后第4~8天,处理的POD活性显着(P<0.05)高于对照。

图2 1-MCP处理对甜瓜过氧化物酶活性的影响Fig.2 Change in POD activity in control and 1-CMP-treated melon fruits during storage at 22 ℃
2.31 -MCP处理对甜瓜SOD活性的影响
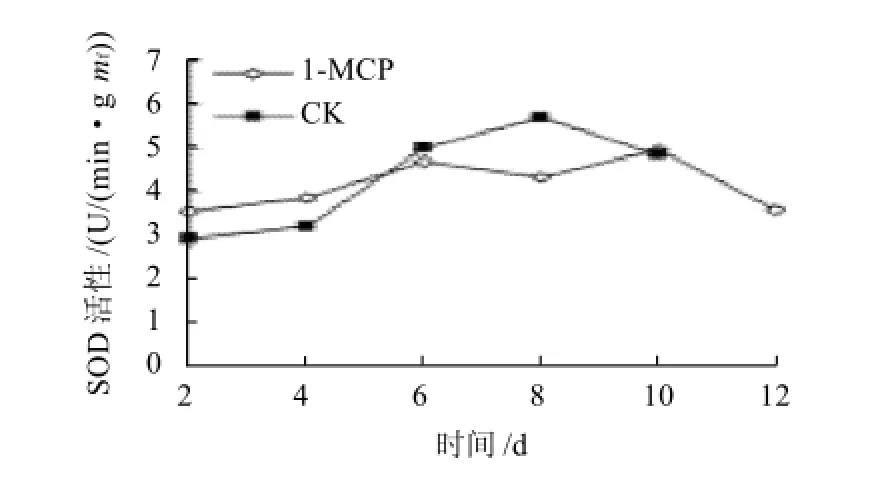
图3 1-MCP处理对甜瓜SOD酶活性的影响Fig.3 Change in SOD activity in control and 1-CMP-treated melon fruits during storage at 22 ℃
1-MCP处理果实的SOD活性在贮藏的前10d呈现缓慢的上升,随后开始下降(图3)。对照果实SOD活性在前期升高较快,并于第8天达到高峰后迅速下降。贮藏的前6d,1-MCP处理的果实SOD活性高于对照,随后对照的SOD活性高于处理果实,并于第8天达到峰值,其峰值为0.382U/(min·g mf),比处理的高30%。
2.41 -MCP处理对甜瓜超氧阴离子自由基产生速率的影响
1-MCP处理对甜瓜果实超氧阴离子自由基的产生有明显的抑制作用(图4)。贮藏初期(前4d)对照果实O2-·产生速率呈现缓慢的变化,第4天急剧上升,于第8天达到峰值,随后迅速下降。1-MCP处理的甜瓜果实O2-·产生速率在贮藏的前8d变化平缓,随后有缓慢的上升。在贮藏的前10d,对照果实O2-·产生速率都显着高于1-MCP处理(P<0.05)。

图4 1-MCP处理对甜瓜超氧阴离子自由基产生速率的影响Fig.4 Change in superoxide anion radical production rate in control and 1-CMP-treated melon fruits during storage at 22 ℃
2.51 -MCP处理对甜瓜果实丙二醛含量的影响
甜瓜果实采后果实丙二醛含量呈现缓慢的上升(图5)。1-MCP处理对甜瓜果实丙二醛(MDA)的产生有明显的抑制作用,在贮藏期间,处理果实MDA的含量显着低于对照(P<0.05)。

图5 1-MCP处理对甜瓜果实丙二醛含量的影响Fig.5 Change in MDA content in control and 1-CMP-treated melon fruits during storage at 22 ℃
3 讨 论
1-MCP处理能够抑制多种采后果蔬乙烯的产生,延缓衰老,保持果实的品质[13-15]。1-MCP促进苹果在贮藏初期SOD活性的升高,显着增加了POD和CAT活性[7],相似的结果也在梨上出现[17],这与1-MCP在甜瓜上的结果相一致。
果蔬采后质量的下降与氧化胁迫有密切的联系[5]。植物有多条途径产生ROS如超氧阴离子、羟自由基,它们在脂质过氧化、多糖裂解、核酸及蛋白质的分解中起着重要的作用。植物体中的防御酶系统可以清除植物体内的ROS,主要有SOD,POD,CAT、抗坏血酸过氧化物酶(APX)等,SOD消除O2-·产生H2O2,而H2O2可被CAT分解,POD也可将H2O2分解为H2O,所以称这些酶为保护酶。经1-MCP处理的甜瓜CAT活性在第4天显着过于对照,对于清除甜瓜组织中H2O2起到重要作用。POD与植物的生长、发育、成熟衰老和抗逆性具有密切关系。1-MCP处理甜瓜的POD活性高于对照果实,这与在猕猴桃[17]上的结果相一致。1-MCP处理甜瓜SOD活性前期高于对照(第6天),后期低于对照,这可能与对照(第8天)产生大量O2-·有关。有人认为SOD为诱导酶,当植物体内自由基上升时,从而诱导SOD活性的上升[18]。SOD活性升高是果实衰老的产物和标志[19]。
保护酶在清除ROS,避免氧化伤害方面起到重要的作用。在甜瓜果实中,经1-MCP处理促进CAT、POD活性的增加,保持SOD酶活性,抑制O2-·产生,减少了膜脂过氧化产物丙二醛的产生,保护膜系统的完整性,延缓了果实的衰老。1-MCP如何对抗氧途径起作用,是一个需要深入研究的问题,对于更好的理解果实采后衰老机理及1-MCP对跃变型果实的生理影响有重要意义。
[1]SEYMOUR G B, MCGLASSON W B. Melons, in biochemistry of fruit ripening[M]. Cambridge: Cambridge Univ Press, 1993: 273-290.
[2]王建华, 刘鸿先, 徐周. 超氧化物歧化酶(SOD)在植物逆境和衰老生理中的作用[J]. 植物生理学通讯, 1998, 3(3): 72-76.
[3]HODGES D M, LESTER G E, MUNRO K D, et al. Oxidative stress: importance for postharvest quality[J]. Hort Science, 2004, 39: 924-929.
[4]SISLER E C, SEREK M, DUPILLE E. Comparison of cyclopropene, 1-methylcyclopropene, and 3,3-dimethylcyclopropene as ethylene anta gonists in plants[J]. Plant Growth Regul, 1996, 18: 169-174.
[5]LACAN D C, BACCOU J. High levels of antioxidant enzymes correlates with delayed senescence non-netted muskmelon fruit[J]. Planta, 1998, 204: 377-382.
[6]汪俏梅, 郭得平, KYIK Y I, 等. 1-甲基环丙烯延缓青花菜衰老的效应及机理[J]. 园艺学报, 2004, 31(2): 205-209.
[7]VILAPLANA R, VALENTINES C. Antioxidant potential and peroxidative state of ol den smoothee a pples treated with 1-methylcyclopropene[J]. J AMER Soc Hort Sci, 2006, 13(1): 104-109.
[8]MENNITI A M, GREGORI, DONATI R I. 1-Methylcyclopropene retards postharvest softening of plums[J]. Postharvest Biology and Technology, 2004, 31: 269-275.
[9]李合生, 孙群, 张文华. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2005.
[10]邹琦. 植物生理生化实验指导[M]. 北京: 中国农业出版社, 2000.
[11]朱广廉. 植物生理学实验[M]. 北京: 北京大学出版社, 1995.
[12]王爱国, 罗广华. 植物的超氧自由基与羟胺反应的定量关系[J]. 植物生理学通讯, 1990(6): 55-57.
[13]LI Dong, LURIE S, ZHOU Hong-wei. Effect of 1-methylcyclopropene on ripening of canino apricots and Royal Zee plums[J]. Postharvest Biology and Technology, 2002, 24: 135-145.
[14]BARITELLE A L, HYDEG M, FELLMAN J K, et al. Using 1-MCP to inhibit the Influence of ripening on impact properties of pear and apple tissue[J]. Postharvest Biology and Technology, 2001, 23: 153-160.
[15]HARRIS D R, SEBERRY J A, WILL R B H, et al. Effect of fruit maturity on efficiency of 1-methylcyclopropene to delay the ripening of bananas[J]. Postharvest Biology and Technology, 2000, 20: 303-308.
[16]LARRIGAUDIERE C, VILAPLANA R, SORIA Y, et al. Oxidative behaviour of blanquilla pears treated with 1-methylcyclopropene during cold storage[J]. J Sci Food Agr, 2004, 84: 1871-1877.
[17]樊秀彩, 张继澍. 1-甲基环丙烯对采后猕猴桃果实生理效应的影响[J]. 园艺学报, 2001, 28(5): 399-402.
[18]方充中. 自由基与酶[M]. 北京: 科学技术出版社, 1989.
[19]石海燕, 冯双庆. 气调贮藏对“紫花”芒果SOD、POX、CAT酶活性的影响[J]. 中国农业大学学报, 1998, 3(3): 72-76.
Effect of 1-MCP Treatment on Reactive Oxygen Metabolism and Related Enzymes in Melon during Postharvest Storage
SUN Ai-ping1,ZHENG Yong-hua2,YANG Hai-yan1,LI Xue-wen1,2,*,HAN Wei1,ZHANG Xi-jun1
(1. College of Food Science, Xinjiang Agricultural University, Urumqi 830052, China;2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
The fruits of Zaohuangmi melon, an early ripening melon cultivar, were treated with 1 μ L/L 1-methylcyclopropene (1-MCP) for 24 h at ambient temperature (22-25 ℃) and then stored at 22 ℃. The activities of reactive oxygen species (ROS) metabolism related enzymes: SOD, POD, CAT and POD, superoxide anion radical production rate and the content of MDA in the treated melon fruits were measured periodically during 22 days of storage. The results showed that exposure of melon fruits to 1-CMP prevented the decline of CAT activity, caused the increase of SOD activity at the beginning of storage and significantly increased POD activity, reaching a peak value after 3 days. The POD activity of 1-CMP-treated melon fruits was higher than that of control fruits over the entire storage period. 1-CMP-treated melon fruits exhibited significantly lower superoxide anion radical production rate and lower MDA content and thus, the postharvest senescence of melon fruits was postponed.
1-methylcyclopropene (1-MCP);melon fruit;reactive oxygen species (ROS) metabolism
S661.2
A
1002-6630(2010)10-0326-04
2008-11-22
孙爱萍(1983—),女,硕士研究生,主要从事果蔬贮藏保鲜研究。E-mail:sunap-21@sohu.com
*通信作者:李学文(1964—),男,副教授,主要从事果蔬采后生理与贮藏保鲜研究。E-mail:xjndsp@sina.com



