赵一楠,丛 苑,孔维嘉,尚 楠,张 旭,李平兰*
(中国农业大学食品科学与营养工程学院,北京 100083)
青霉可以污染多种果蔬及其制品,是导致柑橘类水果发生腐败变质的主要原因。青霉主要在采摘及包装过程中侵染果体,并在贮运过程中导致腐败变质,是腐败变质过程中的优势菌丛[1]。
目前,控制食品腐败变质的方法主要有物理方法、化学方法和生物方法。物理方法容易影响食品的风味、质地和营养价值;化学防腐剂虽效果显着,但已有部分杀真菌剂因为可能存在的毒性风险而被禁止使用,此外,特定种类杀菌剂的反复使用也导致了青霉耐药性菌群的出现[2-3]。而采用生物防腐保鲜剂对采后果蔬进行贮藏保鲜,不但可以避免对食品本身风味等的影响,还能减轻或消除采后果蔬中的化学药剂残毒对人体危害的担忧,更为安全有效。
生物杀真菌剂主要来源于植物、动物及微生物。与植物和动物相比,微生物生长周期短、不受季节限制及代谢物产量大的特点使其成为生物杀真菌剂中的研究热点。芽孢杆菌营养要求简单,抗逆性强,在生长过程中能产生多种抗菌物质及酶类,是生物杀菌剂研究中的佼佼者。国内外已有一些利用枯草芽孢杆菌、地衣芽孢杆菌等进行柑橘类水果、水蜜桃等防腐保鲜的应用研究[4-5],主要是利用芽孢杆菌发酵上清液作为保鲜剂,但对果品的颜色产生了一些影响,菌株的安全性也有待考察。因此,寻找来源安全、抑菌谱广、抑菌物质提取方法简单的芽孢杆菌用以开发安全、有效的生物防腐保鲜剂显得十分必要。
1 材料与方法
1.1 材料、试剂与仪器
样品:小蜜橘、进口红提、荸荠、玫瑰香葡萄、红提、草莓、木瓜、香蕉、香水菠萝、甜甜柚、脐橙、四川草莓、樱桃西红柿、青提、芒果、雪莲果、水晶梨、鸭梨、转色前赤霞珠、全麦面包、亚麻籽面包、山药、党参、太子参、陈皮、枸杞、灵芝、薏仁、黄芪、生地。
菌种:LPL40菌株在本研究中筛选分离得到。青霉标菌为实验室保藏。细菌培养基:LB培养基(蛋白胨10g/L,酵母膏5g/L,NaCl 10g/L,pH7.2~7.4);真菌培养基:PDA培养基(马铃薯200g/L,葡萄糖200g/L,自然pH值),固体培养基中加入20g/L琼脂粉,121℃,20min灭菌备用。
PCR 反应用的各种试剂(分析纯) 上海英骏生物技术有限公司;蛋白胨、酵母膏 北京奥博星生物技术有限责任公司;NaCl、葡萄糖(分析纯) 北京化工厂。
DK-8B电热恒温水槽 上海精宏实验设备有限公司;SCL-1300型垂直流洁净工作台 北京赛伯乐实验仪器有限公司;TG16W微量高速离心机 长沙平凡仪器仪表有限公司;LRH生化培养箱 上海一恒科学仪器有限公司;TC512型PCR仪 Barloworld Scientific公司。
1.2 方法
1.2.1 芽孢杆菌的分离
取1g样品用无菌研钵研碎并加入到9mL无菌生理盐水中,充分振荡,80℃水浴15min,用无菌生理盐水梯度稀释后吸取0.1mL涂布LB平板,37℃培养24~72h,挑取单菌落划线纯化。对已纯化菌株革兰氏染色后镜检,确认产生芽孢后保存待用。
1.2.2 抗青霉芽孢杆菌的筛选
青霉的培养及孢子液的制备:青霉接入PDA斜面(180mm×18mm),28℃培养4d,待孢子充分形成后,每个试管中加入5mL无菌的体积分数0.5% Tween-80溶液,充分振荡后以血球计数板计数并以无菌水调整至107个/mL,4℃保存。
抗青霉芽孢杆菌优良菌株的初筛:当熔化的PDA培养基降至55℃左右时,按1%的比例加入107个/mL青霉孢子液,使混有孢子液培养基孢子浓度为105个/mL,倒入培养皿,每皿约20mL。待凝固后,将分离自食品的132株芽孢杆菌及实验室保存的85株芽孢杆菌点种在平板表面。37℃培养8h后,28℃培养3d,观察芽孢杆菌菌落周围是否存在抑菌圈并用十字测量法测量芽孢杆菌菌落直径及抑菌圈直径。
抗青霉芽孢杆菌优良菌株的复筛:发酵液的抑菌效果测定采用杯碟法,用双层平板。底层为5mL融化的PDA培养基;上层同初筛平板,定量至15mL。挑取初筛筛选出的抑菌效果好的芽孢杆菌斜面保存的菌株,接入装有50mL LB液体培养基的300mL三角瓶中,28℃140r/min振荡培养48h。发酵液在4℃条件下经10000r/min离心10min,再经0.22μm滤膜过滤,无菌滤液杯碟法测定发酵液的抑菌活性。每个牛津杯中加入100μL无菌滤液,4℃过夜后,28℃培养72h后十字交叉法测量抑菌圈直径,以未接种培养基上清液作为空白对照,每处理3次平行。
1.2.3 菌株LPL40的鉴定
形态学鉴定:挑取少量目标菌株在LB平板上划线,28℃培养20h后观察单菌落形态并镜检。继续培养至24h后进行芽孢染色并镜检。
生理生化鉴定:生理生化的相关研究包括糖醇发酵、接触酶、酪氨酸水解、酪素水解、吐温-80降解、卵磷脂降解、柠檬酸盐利用、生长温度范围测定及耐盐性等实验,具体实验方法参见文献[6]。
16S rDNA鉴定:用于PCR扩增的引物为通用引物,正向引物16Sf:5'-AGAGTTTGATCCTGGCTCAG-3';反向引物16Sr:5'-AAGGAGGTGATCCAGCCGCA-3'。PCR反应体系(25μL)为:10×Buffer 2.5μL、10mmol/L dNTP 2.0μL、10μmol/L引物各2.5μL、Taq酶0.25μL、模板1.0μL、ddH2O 14.25μL,空白不加模板。PCR反应条件[5]为:94℃变性5min;94℃变性30s、54℃引物复性1min、72℃延伸2min,35个循环;最后72℃延伸10min。所得PCR 产物用琼脂糖凝胶电泳在标准条件下进行检测后送至北京市擎科生物技术有限公司测序。所得序列利用BLAST程序在GenBank基因库中进行比对,选取相似性较高的几株菌株的16S rDNA序列,用MEGA3.1软件构建系统发育树。
2 结果与分析
2.1 芽孢杆菌的分离、筛选
从木瓜、柑橘、葡萄、全麦面包、太子参、陈皮等食品及中草药共计30个样品中分离得到132株菌落纯芽孢杆菌,并分别进行了斜面保藏和沙土管保藏。
通过平板点种法,从分离的132株芽孢杆菌和实验室保存的85株芽孢杆菌中,初筛出74株有清晰透明圈形成的芽孢杆菌。通过计算抑菌圈直径与芽孢杆菌菌落直径的比值来确定抑菌效果,结果获得18株抑菌效果显着(抑菌圈直径与菌落直径比值大于3)的菌株。其中比值大于4的有3株,比值在3~4之间的有15株,具体见表1。

表1 抗青霉芽孢杆菌优良菌株的初筛结果Table1 Primary screening of Bacillus sp.strains with high antifungal activity against Penicillium sp.
通过对菌种LPL40、LPL43及LPL54进行发酵上清液抑菌活性的测定,发现LPL43上清液没有明显的抑菌圈出现,考虑到初筛实验是青霉与芽孢杆菌共同生长,推断可能是微生物之间的生长竞争所致。共同生长过程中青霉的存在诱导了LPL43产生抑菌物质。菌种LPL40与LPL54上清液抑菌效果相差不多,LPL40上清液的效果稍好于LPL54。为了定量分析抑菌效果和确定最终的目标菌株,本研究进行了初步的硫铵沉淀实验并以二倍稀释法测定抑菌效价,结果显示,菌株LPL40硫铵沉淀粗提物抑菌效价为1280AU/mL,而菌株LPL54硫铵沉淀粗提物抑菌效价为320AU/mL,因此确定菌种LPL40为最终的目标菌株,具体结果见表2。
表2 发酵上清液的抑菌效果(± s)Table2 Antifungal activity of fermentation supernatants of 3 selected strains with higher antifungal activity against Penicillium sp.(± s)

表2 发酵上清液的抑菌效果(± s)Table2 Antifungal activity of fermentation supernatants of 3 selected strains with higher antifungal activity against Penicillium sp.(± s)
注:-.没有抑菌圈。
菌种编号 LPL40 LPL43 LPL54抑菌圈直径/mm 13.94±1.90 - 13.63±0.88
2.2 目标菌株的鉴定
2.2.1 菌落形态学鉴定结果
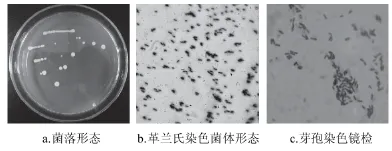
图1 芽孢杆菌LPL40形态学鉴定结果Fig.1 Morphological identification of Bacillus sp.LPL40
由图1可知,菌株LPL40在LB平板上生长时形成淡黄色半透明圆形菌落,菌落突起,边缘整齐,表面光滑、黏稠,以接种环挑起时呈拉丝状,培养基不变色。镜检结果表明,该菌为革兰氏阳性菌,菌体呈短杆状,染色均匀,可形成内生芽孢,芽孢囊膨大,呈椭圆形,游离芽孢表面着色弱。
2.2.2 菌株LPL40的生理生化鉴定
菌株LPL40的生理生化鉴定结果见表3。鉴定结果表明,其接触酶反应、酪素水解、卵磷脂水解成阳性,能够利用葡萄糖及淀粉,不能在4、10、55℃生长,不能在7% NaCl溶液中生长但能够在5% NaCl溶液中生长,这些结果与《常见细菌系统鉴定手册》[6]比对显示菌株LPL40为解淀粉芽孢杆菌。

表3 菌株LPL40生理生化鉴定结果Table3 Physiological and biochemical characteristics of Bacillus sp.LPL40
2.2.3 16S rDNA同源性的鉴定
LPL40菌染色体DNA用PCR扩增出单一条带,PCR产物回收纯化后经DNA测序,序列长度为1447bp。以16S rRNA序列同源性为基础构建系统发育树。菌株LPL40与B.amyloliquefaciens和B.subtilis同源性最高,分别为99.93%和99.34%,使用MEGA3.1计算序列相似性并作系统发育分析,结果如图2。

图2 以16S rDNA序列为基础的菌株LPL40系统发育树Fig.2 Phylogenetic tree of Bacillus sp.LPL40 based on 16S rDNA sequence
3 讨 论
自1945年Johnson等[7]报道枯草芽孢杆菌产生抗菌物质后,近半个世纪以来各国的研究工作者对它能否成为一种生物控制因素寄予了极大兴趣和关注。近年来多篇文献报道了包括蜡样芽孢杆菌[8]、地衣芽孢杆菌[9]、多黏芽孢杆菌[10]在内的多种芽孢杆菌均能够产生活性抑菌物质。
本实验所选的芽孢杆菌分离自食品及中草药,主要是考虑到几下几个因素:1)青霉主要侵染水果、水果制品及面包等食品;2)新鲜、完整的水果表面存在的芽孢杆菌有可能在延缓水果腐败变质方面起到一定的作用;3)食品、中草药源的芽孢杆菌具有一定的安全性。
从本实验结果可以看出,芽孢杆菌经初筛后有超过1/3的菌株对青霉显现出了拮抗作用,而经复筛后最终确定的目标芽孢杆菌LPL40菌株,其菌体细胞及发酵上清液均对青霉表现出强烈的抑制效果,通过生理生化实验及16S rDNA鉴定,确定该菌种为解淀粉芽孢杆菌。但在比对过程中也发现,芽孢杆菌LPL40与枯草芽孢杆菌的相似性也达到99%以上。《伯杰细菌鉴定手册》[11]把解淀粉芽孢杆菌与枯草芽孢杆菌分开,是由于这个种的DNA的G+C的含量为43.5%~44.9%,DNA-DNA杂交仅有15%的同系物,α-淀粉酶的性质不同,产生量很大。解淀粉芽胞杆菌和枯草芽胞杆菌同源性高,内含很多相同或相似的基因,可以通过部分基因特异性序列分析进行区分[12],因此,在必要的情况下可以对菌株LPL40进行进一步的鉴定。
目前,国内外学者已分离到对真菌具有拮抗作用的解淀粉芽孢杆菌,研究方向集中在对其抑菌物质的分离、纯化上。已被报道的抑菌物质有抗真菌蛋白[13]、脂肽类[14]、几丁质酶[15]等。本实验室已对菌株LPL40进行了硫铵沉淀和透析处理,粗提物显示出了较高的抑菌活性,为进一步研究抑菌物质的成分及其结构奠定了前期基础。
在研究中还发现,菌株LPL40除了对青霉有显着抑制作用外,对其他食品腐败菌如根霉、毛霉、黄绿曲霉,植物病原菌如立枯丝核菌、瓜果腐霉、刺腐霉等均有较为强烈的抑菌效果,并且对辣椒在苗期有一定的促生长作用,显示出了较为宽广的应用前景。
4 结 论
本实验从食品及中草药共计30个样品中分离得到132株芽孢杆菌,通过平板对峙法及用杯碟法测定其发酵液的抑菌效果,最终筛选出一株芽孢杆菌LPL40,其发酵上清液对青霉的抑菌圈直径达到(13.94±1.90)mm,通过形态学、生理生化指标测定及16S rDNA序列分析,最终将该菌株鉴定为解淀粉芽孢杆菌L P L 4 0(Bacillus amyloliquefaciensLPL40)。
[1] WICHITRA L, PUNPEN H, SAMERCHAI C.Growth inhibitory properties ofBacillus subtilisstrains and their metabolites against the green mold pathogen (Penicillium digitatumSacc.) of citrus fruit[J].Postharvest Biology and Technology, 2008, 48: 113-121.
[2] HOLMES G J, ECKERT J W.Sensitivity ofPenicillium digitatumandP.italicumto postharvest citrus fungicides in California[J].Phytopathology, 1999, 89: 716-721.
[3] KINAY P, MANSOUR M F, GABLER F M, et al.Characterization of fungicide-resistant isolates ofPenicillium digitatumcollectedin California[J].Crop Protection, 2007, 26: 647-656.
[4] 张丽, 郁志芳, 姜丽, 等.淀粉液化芽孢杆菌ES-2发酵产物对贮藏期间“湖锦蜜露”水蜜桃品质和生理生化特性的影响[J].食品科学, 2009, 30(20): 421-425.
[5] LIU Bing, QIAO Hongping, HUANG Lili, et al.Biological control of take-all in wheat by endophyticBacillus subtilisE1R-j and potential mode of action[J].Biological Control, 2009, 49(3): 277-285.
[6] 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京: 科学出版社, 2001:67-69.
[7] JOHNSON F H, CAMPBELL D H.The retardation of protein denaturation by hydrostatic pressure[J].Journal of Cellular Comparative Physiology, 1945, 26: 43-46.
[8] 黄运红, 王俊明, 龙中儿.蜡样芽孢杆菌发酵液对苹果保鲜作用的初步研究[J].食品科学, 2006, 27(11): 516-519.
[9] VAISHALI J P, SACHIN R T, BHARAT B C.Bioprocess development for the production of an antifungal molecule byBacillus licheniformisBC98[J].Journal of Bioscience and Bioengineering, 2004, 98(4): 231-235.
[10] 毛亮, 周怡, 张婷婷, 等.多黏性芽孢杆菌HT16抗真菌物质的分离及特性研究[J].食品科技, 2009, 34(10): 2-9.
[11] 布坎南 R E, 吉本斯 N E.伯杰细菌鉴定手册[M].8版.中国科学院微生物研究所, 译.北京: 科学出版社, 1984: 751-752.
[12] 权春善, 王军华, 徐洪涛, 等.一株抗真菌解淀粉芽孢杆菌的分离鉴定及其发酵条件的初步研究[J].微生物学通报, 2006, 46(1): 7-12.
[13] WONG J H, HAO J, CAO Z, et al.An antifungal protein fromBacillus amyloliquefaciens[J].Journal of Applied Microbiology, 2008, 105 (6):1888-1898.
[14] LEE S C, KIM S H, PARK I H.Isolation and structural analysis of bamylocin A, novel lipopeptide fromBacillus amyloliquefaciensLP03 having antagonistic and crude oil-emulsifying activity[J].Arch Microbiol,2007, 188: 307-312.
[15] WANG S L, SHIH I L, LIANG T W, et al.Purification and characterization of two antifungal chitinases extracellularly produced byBacillus amyloliquefaciensV656 in a shrimp and crab shell powder medium[J].Journal of Agricultural and Food Chemistry, 2002, 50(8): 2241 -2248.



