郭乃菲,高 兴,纪淑娟,于基成*
(1.沈阳农业大学食品学院,辽宁 沈阳 110161;2.大连民族学院生命科学学院,辽宁 大连 116600)
百菌清人工抗原的制备与鉴定
郭乃菲1,2,高 兴1,2,纪淑娟1,于基成2,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110161;2.大连民族学院生命科学学院,辽宁 大连 116600)
以杀菌剂百菌清为起始反应物,通过两步化学反应合成百菌清的衍生物(半抗原);采用活化酯法与混合酸酐法分别将半抗原与载体蛋白(牛血清蛋白、卵清蛋白)进行偶联,制备百菌清的人工抗原,同时通过免疫新西兰大白兔获得抗血清,用酶联免疫吸附法(ELISA)测定其效价。利用红外光谱(IR)、质谱(MS)、核磁共振波谱(NMR)对百菌清半抗原进行表征,并用紫外扫描的方法对人工抗原进行鉴定。结果表明,成功制备出百菌清半抗原及人工抗原,并且半抗原与载体蛋白的偶联比分别为27.86:1和12.32:1,抗血清效价约为1:1.28×104。
百菌清;半抗原;人工抗原;鉴定
百菌清(tetrachloroisophthalonethile,TCPN),化学名为2,4,5,6-四氯-1,3-二氰基苯,是一种广谱保护性杀菌剂,农业生产中主要用于防治果蔬类真菌病害。由于百菌清对植物体具有良好的黏着性和使用的广泛性,因此百菌清及其代谢产物在果蔬、土壤及水中均有较大的残留,甚至在北极地区也能检测到[1]。美国国家环境保护总署(U.S.EPA)已经把百菌清列为可能使人类致癌的物质之一,其对环境和食品安全具有潜在威胁[2]。目前,国内百菌清的检测方法主要为气相色谱法(GC)[3]和液相色谱法(HPLC)[4]等仪器分析方法。这些方法均存在样品前处理复杂、耗时、成本高等问题,不适合大量样品的快速检测,因此建立一种操作简便、快速和检测通量大的方法具有重要意义。ELISA法是目前用于农药残留分析较为常用的快速检测法,其原理是利用酶标记物同抗原或抗体复合物的免疫反应与酶的催化放大作用相结合,既保持了酶催化反应的灵敏性,又保持了抗原抗体反应的特异性,因而极大的提高了灵敏度,其方法建立的关键则是制备出一种或几种人工抗原,以获得高效价的抗血清。本研究以百菌清作为起始反应物,经过一系列化学反应获得具有特定基团的百菌清衍生物;并采用活化酯法和混合酸酐法制备其人工抗原,通过免疫新西兰大白兔获得兔抗百菌清的血清,以期为建立百菌清残留检测的ELISA方法和试剂盒的研制提供参考。
1 材料与方法
1.1 材料与试剂
百菌清(含量大于90%);乙二醇、N'N-二甲基甲酰胺(DMF)、丁二酸酐、三丁胺、氯甲酸异丁酯均为分析纯;弗氏佐剂、牛血清蛋白(BSA)、卵清蛋白(OVA)、羟基琥珀酰亚胺(NHS)、二环己基碳二亚胺(DCC)均为进口分装分析纯。
1.2 仪器与设备
LABORO 4000旋转蒸发仪 德国Heidolph公司;IKA-MS1微型旋涡混合仪 德国IKA公司;Free Zone 4.5台式冷冻干燥机 美国Labconco公司;IRPrestige-21红外光谱仪、Icms-20液相色谱-质谱仪、UV-2450紫外光谱仪 日本岛津公司;Mercury-plus400mHz核磁共振波谱仪 美国瓦里安公司;Bio-Rad 680酶标仪 美国伯乐公司;BR-4i台式高速冷冻离心机 法国Jouan公司;DF-101S集热式磁力搅拌器 大连科锐生物工程有限公司。
1.3 实验动物
新西兰大白兔(雄性,2~2.5kg) 大连医科大学实验动物中心。
1.4 方法
1.4.1 百菌清半抗原(TCPN-COOH)的合成与鉴定
将百菌清原药0.5g用20mL乙二醇溶解,搅拌反应24h。反应物再与等量的丁二酸酐在吡啶环境下反应获得百菌清半抗原,反应流程见图1。半抗原经硅胶柱层析纯化后用IR、MS和NMR进行表征。
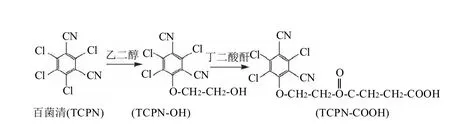
图1 百菌清半抗原(TCPN-COOH)制备的反应路线Fig.1 Synthetic route of TCPN-COOH
1.4.2 百菌清人工抗原的合成
1.4.2.1 活化酯法制备百菌清人工抗原(TCPN-COOHBSA)[5-6]
取0.053g百菌清半抗原溶解于2.0mL DMF中,加入0.023g NHS和0.041g DCC,反应5h。离心,上清液中缓慢滴入6.0mL 20.0mg/mL BSA,搅拌。反应液经离心后取上清液透析并冷冻干燥备用。
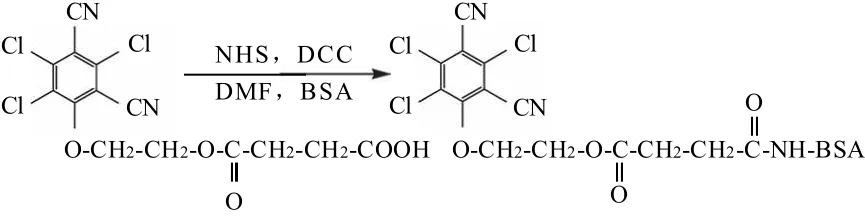
图2 活化酯法制备百菌清人工抗原反应路线Fig.2 Synthetic route of TCPN-COOH-BSA by activated ester method
1.4.2.2 混合酸酐法制备百菌清包被抗原(TCPN-COOHOVA)[7]
称取百菌清半抗原0.05g溶于2.0mLDMF中,依次加入50.0μL三丁胺和30.0μL氯甲酸异丁酯,搅拌反应1h后将其缓慢滴入6.0mL 20.0mg/mL OVA中。反应液经离心、透析和冷冻干燥后备用。
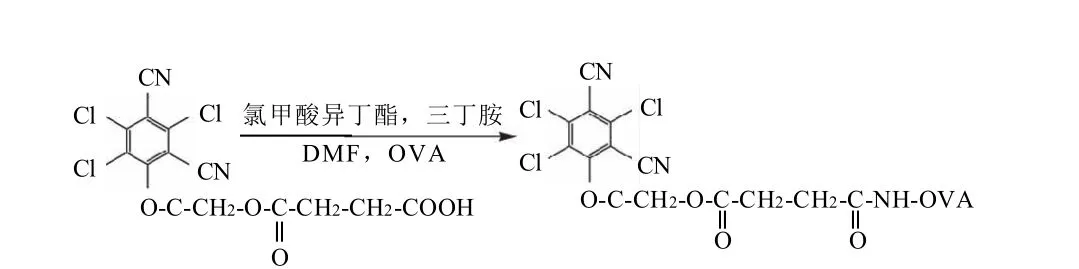
图3 混合酸酐法制备百菌清包被抗原反应路线Fig.3 Synthetic route of TCPN-COOH-OVA by mixed anhydride method
1.4.3 人工抗原的鉴定与偶联比的测定
1.4.3.1 人工抗原的鉴定
将百菌清半抗原稀释至适当浓度,在波长200~400nm范围内进行扫描,获得半抗原的紫外光谱。
1.4.3.2 人工抗原偶联比的测定
采用Bradford法[8]测定人工抗原中的蛋白质含量,以紫外光谱法测定抗原中TCPN-COOH含量,按下式估算偶联比[9](ε表示摩尔吸光系数)。
TCPN-COOH:BSA/OVA=εTCPN-COOH:εBSA/OVA
1.4.4 抗血清的制备
将TCPN-BSA用生理盐水稀释,加入等体积弗氏完全佐剂充分乳化,于新西兰大白兔背部皮下多点免疫,初次免疫剂量为0.5mg/kg。3周后加强免疫(弗氏不完全佐剂),免疫剂量为0.1~0.15mg/kg,1次/2周,共4次。从第3次加强免疫开始,免疫后7~10d耳缘静脉取血,采用间接ELISA法测定抗血清的效价。加强免疫4次后,颈主动脉放血,分离抗血清,于-20℃保存备用[10-11]。
1.4.5 ELISA法测定抗血清效价和抗血清亲和性测定
用10.0μg/mL包被原(TCPN-OVA)包被酶标板,100μL/孔,37℃温育3h。经PBST洗涤3次,用1%明胶封闭1.5h,150μL/孔,再次用PBST洗涤3次。加入不同稀释度抗血清(以阴性血清为空白),100μL/孔,37℃温育lh。洗板,加入辣根过氧化物酶标记的羊抗兔IgG(1:10000),100μL/孔,37℃温育lh后洗涤3次。最后加入显色液(邻苯二胺)100μL/孔,37℃显色15 min,加入2.0mol/L H2SO4溶液终止反应。经酶标仪测定各孔的OD490nm值。当OD490nm值为0.8左右时,抗血清的稀释倍数即为抗血清的效价[12]。在ELISA法测定过程中,分别以TCPN-OVA、BSA包被酶标板,按上述步骤测定其OD490nm值,考察抗血清对BSA和TCPN-OVA的亲和性。
2 结果与分析
2.1 百菌清半抗原的鉴定
2.1.1 红外光谱鉴定
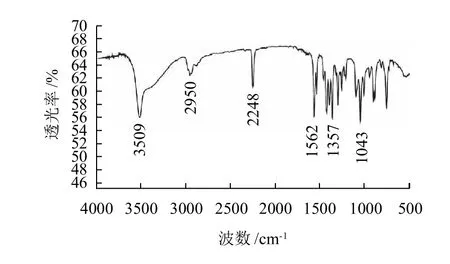
图4 半抗原TCPN-OH的红外光谱图Fig.4 IR spectrum of TCPN-OH
由图4可知,TCPN-OH的红外光谱可归属:O—H伸缩振动(3509cm-1),C—H伸缩振动(2950cm-1),C≡N伸缩振动(2248cm-1),苯环骨架振动(1562~1357cm-1),C—O—C不对称伸缩振动(1292cm-1),OH的弯曲振动(1245cm-1),C—O—C对称伸缩振动(1086cm-1),C—O(伯醇)的伸缩振动(1043cm-1),C—Cl的伸缩振动(883cm-1)。其中3509cm-1处的O—H伸缩振动及1300~1000cm-1范围内由脂肪醇引起的吸收均为百菌清中所未见的基团吸收峰,说明TCPN-OH中醇羟基引入成功[13]。
TCPN-COOH红外光谱归属:宽的O—H伸缩振动(3700~2700cm-1),C—H的伸缩振动(2956、2930、2842cm-1),C≡N伸缩振动(2230cm-1),羰基C==O伸缩振动(1736cm-1),苯环骨架振动(1560~1390cm-1),C—O伸缩振动(1261cm-1),苯环上杂原子裂分产生的吸收峰(1155~1090cm-1),C—Cl的伸缩振动(850cm-1)。由红外光谱图对比(图5)可见,TCPN-COOH图中出现了TCPNOH谱中未见羧酸特征吸收峰,说明羧酸基团引入成功。
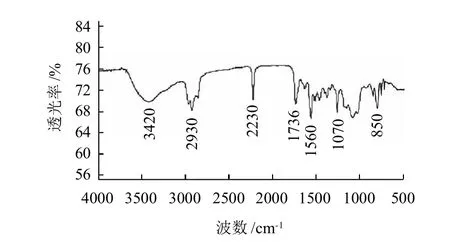
图5 半抗原TCPN-COOH的红外光谱图Fig.5 IR spectrum of TCPN-COOH
2.1.2 质谱鉴定
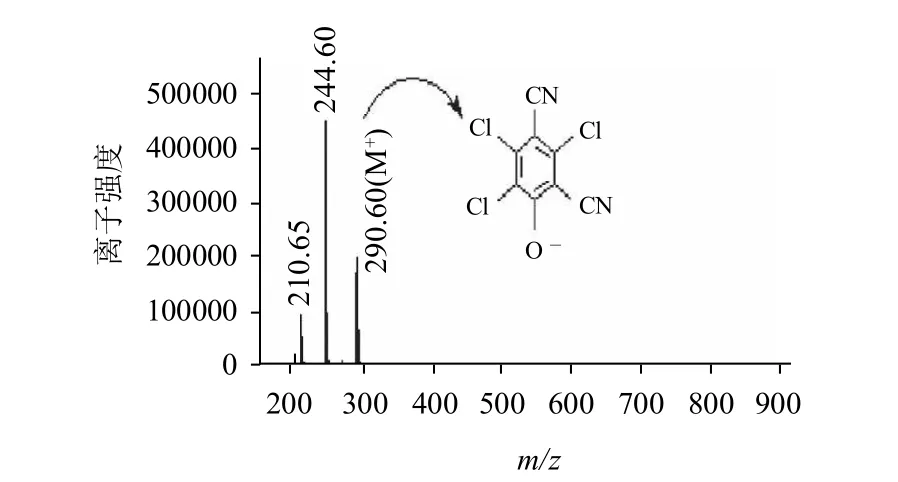
图6 半抗原TCPN-OH的质谱图Fig.6 MS spectrum of TCPN-OH
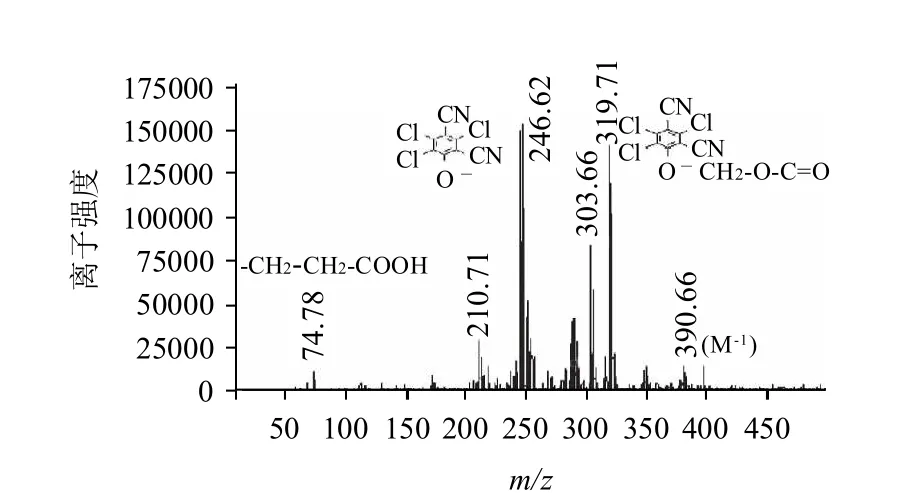
图7 半抗原TCPN-COOH的质谱图Fig.7 MS spectrum of TCPN-COOH
TCPN-OH和TCPN-COOH的相对分子质量分别为291.508和391.508,由图6、7可以看出,其[M-]离子峰分别为290.60和390.66,质谱分析表明目标化合物的相对分子质量与理论值相符。
2.1.3 核磁共振波谱表征
TCPN-OH核磁共振波谱归属:1H-NMR(400MHz,CD3COCD3,TMS,δ:ppm):3.8(d,2H,— CH2—);4.4(t,2H,— CH2—)。13C-NMR(400MHz,CD3COCD3,TMS,δ:ppm):162.88(C-1 Ar);141.74(C-5 Ar);139.48(C-3 Ar);128.19(C-6 Ar);111.692(C-4 Ar);109.649(C-2 Ar);111.95/112.41(C-9/C-10 CN);78.47(C-8);61.39(C-7)。
TCPN-COOH核磁共振波谱归属:1H-NMR(400MHz,DMSO,TMS,δ:ppm):1.271(s,2H,— CH2—);1.29(s,2H,— CH2—);4.594(s,2H,— CH2—)。13C-NMR(400MHz,DMSO,TMS,δ:ppm):181(C-9 C=O);173(C-12 COOH);169.19(C-4 Ar);150.89(C-6 Ar);142.29(C-2 Ar);119.59(C-5 Ar);114.59/115.45(C-13/C-14CN);107(C-1 Ar);101(C-3 Ar);80.83(C-7);74(C-10);61(C-11);59(C-8)。
2.2 人工抗原的鉴定及偶联比的测定
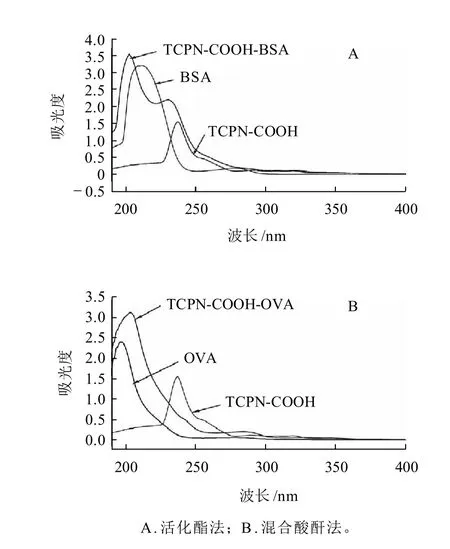
图8 活化酯法和混合酸酐法制得的人工抗原的紫外扫描曲线Fig.8 UV absorption spectra of TCPN-COOH-BSA and TCPN-COOHOVA
由图8可知,两种方法合成的抗原与载体蛋白紫外光谱相比,光谱均发生了明显变化,且都在230nm附近出现了相应的吸收峰,这是TCPN-COOH所特有的吸收峰(最大吸收值),说明载体分子上已成功连接了一定数量的TCPN-COOH。根据Bradford法测定了人工抗原和包被抗原中载体蛋白的含量,并且通过人工抗原、载体蛋白的标准曲线及TCPN-COOH的紫外吸收曲线在235nm处的摩尔吸光度,计算出相应的偶联比分别为27.86:1和 12.32:1。
2.3 抗血清效价的测定
由图9可知,以TCPN-OVA为包被原测定的抗血清OD490nm值明显高于以BSA为包被原所测得的OD490nm值,说明免疫血清中含有可跟TCPN-OVA反应的抗体,制备的抗血清与百菌清具有较高的亲和性,而与BSA亲和性较差。通过方阵滴定测得抗血清效价为1:1.28×104,说明人工抗原已具有免疫作用。Xu等[14]获得的五氯硝基苯多克隆抗体在抗血清稀释度为1:5×103时抗血清与五氯硝基苯亲和性最好,其检测的灵敏度为7ng/g。因此,本研究所获得的抗体效价可以满足ELISA检测对抗体效价方面的要求,为后续建立ELISA检测方法提供资料。
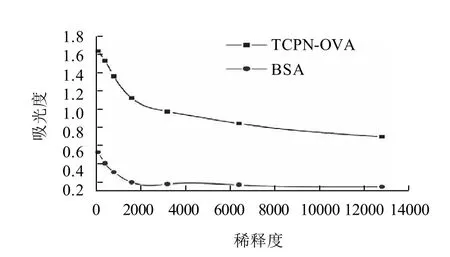
图9 百菌清抗血清效价测定曲线Fig.9 Antiserum titer determination curves
3 结论与讨论
3.1 半抗原结构对免疫结果的影响
半抗原的结构对免疫结果有直接的影响,因此通常在合成半抗原的过程中都会尽量多的设计出不同结构的半抗原,并通过免疫应答反应来最终取舍。对于结构较为复杂的农药分子,在设计半抗原前要对其各个结构区域进行讨论,确定各基团在农药作用过程中所起的作用,尽量在辅助的结构区域上进行修饰,增加抗原抗体之间的识别能力[15]。在本研究中,由于百菌清本身的结构简单,因而不需要讨论其功能分区。同时,在半抗原合成过程中,不同长短的连接臂也会对免疫结果有一定的影响,过短的连接臂会使结构比较简单的半抗原分子包埋在载体蛋白中,影响偶联比的测定,降低免疫反应的灵敏度;过长的连接臂会在偶联过程中发生折叠,同样使半抗原分子被包埋,或者免疫产生的抗体对结构比较复杂的连接臂更具有识别能力[16]。
3.2 人工抗原偶联方式对免疫结果的影响
对于同一种半抗原分子与载体蛋白偶联时,通常存在两种或两种以上的方法,但是不同的连接方法对载体蛋白的修饰程度不同,即偶联比的多少会有所差异,进而对免疫结果产生影响[17]。而且有的偶联过程会引入几个碳原子的连接臂,例如戊二醛法,因此在选择偶联方法时要根据半抗原自身的结构进行选择[18]。在本研究中采用活化酯法将半抗原与BSA相偶联制备了百菌清的人工免疫抗原;混合酸酐法将半抗原与OVA偶联制备了百菌清的包被抗原,采用紫外-可见光谱法测定了人工抗原和包被抗原的偶联比分别为28.76:1和12.32:1。选用这两种方法是由于半抗原本身的偶联臂长度已经足够,且偶联臂末端为羧基基团,因而不用通过其他方式增加偶联臂的长度。
3.3 免疫过程对免疫结果的影响
在对动物进行活体免疫时,免疫的剂量、次数,佐剂的选择均会对免疫的结果产生影响。因此,本研究选择对新西兰大白兔进行免疫,全程的免疫剂量控制在1mg/kg,共免疫5次,采用ELISA法测定其抗血清的效价在1:1.28×104。另外,免疫的剂量和次数过大或过于频繁都会造成动物的免疫耐受现象,使得抗体的效价大幅下降,同时根据免疫对象的不同来选择合适的佐剂,对动物免疫时大多采用弗氏佐剂。
[1] DALY G L, LEI Y D, TEIXEIRA C, et al. Pesticides in western Canadian mountain air and soil[J]. Environ Sci Technol, 2007, 41(17):6020-6025.
[2] LAWRUK T S, GUECO A M, JOURDAN S W, et al. Determination of chlorothalonil in water and agricultural products by a magnetic particlebased enzyme immunoassay[J]. Agric Food Chem, 1995, 43(5): 1413-1419.
[3] 周晓龙, 孙涛. 气相色谱法检测蔬菜中百菌清及拟除虫菊酯类农药残留[J]. 仪器仪表学报, 2005, 26(8): 150-152.
[4] 李晓岚. 高效液相色谱法测定百菌清有效成分的含量[J]. 中国农学通报, 2005, 21(12): 352-353.
[5] 许艇, 邵晓龙, 李季. 除草剂2,4-D特异性多克隆抗体的制备及鉴定[J]. 生物技术, 2003, 13(4): 19-21.
[6] 杨耀军, 渠桂荣, 孟凡涛, 等. 西维因人工抗原的合成新方法[J]. 过程工程学报, 2005, 5(2): 201-204.
[7] 朱国念, 桂文君, 郑尊涛, 等. 吡虫林人工抗原的合成与鉴定[J]. 中国农业科学, 2005, 38(3): 511-515.
[8] 陈均辉, 陶力, 李俊, 等. 生物化学实验[M]. 3版. 北京: 科学出版社,2003: 63-64.
[9] 吕会田, 乐加昌, 陈存社. 克伦特罗小分子半抗原偶联率的测定方法研究[J]. 饲料工业, 2005, 26(3): 57-59.
[10] 陈建新, 陈梅英, 赵会杰. 免疫学技术在植物科学中的应用[M]. 北京: 中国农业大学出版社, 1998: 46-53.
[11] LEE J K, AHN K C, PARK O S, et al. Development of an ELISA for the detection of the residues of the insecticide imidacloprid in agricultural and environmental[J]. Agric Food Chem, 2001, 49(5): 2159-2167.
[12] 雷红涛, 孙远明, 黄晓钰, 等. 除草剂丁草胺人工抗原合成及其抗体制备研究[J]. 农产品加工: 学刊, 2005, 45(9): 52-54; 60.
[13] ROBERT M S, FRANCIS X W, DAVID J K. 有机化合物的波谱解析[M]. 广州: 华东理工大学出版社, 2007: 32-34; 92-130; 152-156; 216-226.
[14] XU Ting, SHAO X L, LI Q X, et al. Development of an enzyme-linked immunosorbent assay for the detection of pentachloronitrobenzene residues in environmental samples[J]. Agric Food Chem, 2007, 55(10):3764-3770.
[15] SUAREZ-PANTALEON C, MERCADER J V, AGULLO C, et al.Production and characterization of monoclonal and polyclonal antibodies to forchlorfenuron[J]. J Agric Food Chem, 2008, 56(23): 11122-11131.
[16] MERCADER J V, SUREZ-PANTALEN C, AGULL C, et al. Hapten synthesis and monoclonal antibody-based immunoassay development for detection of the fungicide trifloxystrobin[J]. Agric Food Chem, 2008,56(8): 7682-7690.
[17] 周思祥, 刘福成. 农药人工抗原的合成研究进展[J]. 农药, 2005, 44(8): 337-341.
[18] LI Jun, LIU Juxiang, WANG Jianping. Multidetermination of four nitrofurans in animal feeds by a sensitive and simple enzyme-linked immunosorbent assay[J]. Agric Food Chem, 2009, 57(6): 2181-2185.
Preparation and Identification of Tetrachloroisophthalonethile Artificial Antigen
GUO Nai-fei1,2,GAO Xing1,2,JI Shu-juan1,YU Ji-cheng2,*
(1. College of Food Science, Shenyang Agricultural University, Shenyang 110161, China;2. College of Life Science, Dalian Nationalities University, Dalian 116600, China)
In this work, tetrachloroisophthalonethile (TCPN) was derivatized into TCPN-COOH through two-step chemical reactions to prepare a hapten. TCPN artificial antigens, TCPN-COOH-BSA and TCPN-COOH-OVA were prepared from the hapten separately conjugated with carrier proteins, i.e., bovine serum albumin (BSA) and ovalbumin (OVA) by activated ester and mixed anhydride methods. An antisera was obtained through the immunization of New Zealand white rabbits using TCPNBSA. Antiserum titer was detected by enzyme-linked immunosorbent assay (ELISA). Meanwhile, TCPN-COOH and its intermediate product TCPN-OH were characterized by IR, MS and NMR methods, and TCPN-COOH-BSA and TCPNCOOH-OVA were qualitatively analyzed by UV/Vis spectrophotometry. TCPN-COOH, TCPN-COOH-BSA and TCPNCOOH-OVA were successfully synthesized, and the coupling ratios between TCPN-COOH and BSA or OVA were 27.86 and 12.32, respectively. The antiserum titer was about 1:1.28×104.
tetrachloroisophthalonethile;hapten;artificial antigen;identification
R392.7
A
1002-6630(2010)13-0214-05
2009-11-10
辽宁省自然科学基金项目(20072916);大连民族学院人才引进项目(20086203)
郭乃菲(1983—),女,博士研究生,研究方向为食品质量控制。E-mail:guonaifei1983@126.com
*通信作者:于基成(1968—),男,教授,博士,研究方向为食品质量安全。E-mail:yujc@dlnu.edu.cn



