阿不都维力·阿不都尔尼 努尔艾里·努尔买买提 张君萍 来海中 陈梦婕 晁泽阳
(1、新疆米兰食品开发有限公司,新疆 和田8480001 2、中国科学院新疆理化技术研究所干旱区植物资源化学实验室,新疆 乌鲁木齐830000;3、新疆特有药用资源利用省部共建实验室,新疆 乌鲁木齐830000 4、新疆昌凯生物科技有限公司,新疆 乌鲁木齐830011 5、四川大学,四川 成都610065)
近年来,抗氧化是医疗卫生领域研究的重点内容,玫菊口服液由玫瑰花、菊苣、大枣和枸杞4 味药材组成。研究发现,玫瑰花中多酚类、多糖类和黄酮类物质是玫瑰花中的抗氧化成分[1、2]。菊苣中丰富的萜类、黄酮类、酚类等物质是菊苣中的抗氧化成分[3]。红事多糖能有效地清除小鼠运动过程中产生的自由基,防止脂质过氧化反应[4]。大枣粗多糖、中性多糖、酸性多糖对淋巴细胞增殖具有促进作用,即红枣多糖可通过直接作用于免疫细胞而增强免疫功能[5]。枸杞多糖是枸杞发挥功效的主要成分,现代医学证明,枸杞多糖具有改善睡眠、增强免疫功能、抗氧化、抗疲劳、降低血糖等多种功效[6-8]。将玫瑰花、菊苣、大枣与枸杞结合应用到保健品的制备中,可共同发挥这两种成分的功效,从而使保健品抗氧化、延缓衰老的效果得以增强。鉴于此,研究以玫瑰花、菊苣、大枣与枸杞为原料制备了复方口服液(以下简称玫菊口服液),并采用1,1- 二苯基-2- 三硝基苯肼(DPPH)法、2,2- 联氮- 二(3- 乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)法对口服液抗氧化能力进行测定,旨在为玫菊口服液的推广应用奠定科学基础。
1 材料与仪器试剂
1.1 试验材料
玫瑰花、菊苣、大枣与枸杞:购于新疆安萨尔维吾尔药业有限公司;
1.2 仪器设备
高速万能粉碎机FW100 型/2000r/min:天津市泰斯特仪器有限公司;
CPA124S 电子天平:德国赛多利斯;
DL-1 单联电子可调电炉:金坛市文华仪器有限公司;
电热恒温鼓风干燥箱:上海齐欣科学仪器公司;
高速冷冻离心机:美国基因有限公司;
UV-2100 分光光度计:尤尼柯仪器有限公司。
1.3 主要试剂
以下所列试剂均为分析纯,水为蒸馏水。
重蒸酚,无水乙醇,浓硫酸,乙醚,乙酸乙酯,正丁醇,三氯甲烷,磷钼酸均为分析纯;葡萄糖对照(中国药品生物制品检定所),没食子酸对照(中国药品生物制品检定所),ABTS(SIGMA公司);DPPH(SIGMA 公司);
2 试验方法
2.1 水提工艺研究
2.1.1 指标及测定方法
多糖含量的测定采用苯酚- 硫酸法[9],测定口服液总多糖含量,以葡萄糖为标准品。多酚含量的测定采用Folin-Ciocalteu比色法[10],测定口服液总多酚含量,以没食子酸为标准品。精密吸取提取液20ml,置已干燥至恒重并称重的蒸发皿中,在水浴上蒸干后,于105℃烘箱干燥5 小时至恒重,取出,迅速置干燥器中冷却30 分钟,精密称定重量,计算出膏率。
2.1.2 单因素实验:对影响提取效率的加水量、提取时间和提取次数进行考察,以总多糖含量、总多酚、出膏率进行综合评价(权重系数为0.4、0.4、0.2)。
综合评分=(总多糖含量/最大总多糖含量)×40+(总多酚含量/最大总多酚含量)×40+(出膏率/最大出膏率)×20
2.1.3 正交实验设计:在单因素的基础上进一步进行正交实验设计,筛选最佳提取条件。

表1 因素水平表
2.2 水提液的除杂
除杂方式采用高速离心法。
2.2.1 不同离心时间除杂考察
取原生药:药液为1:10 提取液50ml 各三份,按5000R/min转速分别离心10、20、30min,取上清液,加水补足体积,测定总多糖、总多酚含量和出膏率。
2.2.2 不同离心转数除杂考察
取原生药:药液为1:10 提取液50ml 各3 份,分别按3000R/min、5000R/min、8000R/min 转速离心20min,取上清液,加水补足体积,测定总多糖、总多酚含量和出膏率。
2.3 水提液的澄清
根据本处方特点(保留多糖等天然亲水胶体),采用ZTC Ⅲ1+1 法达到分离纯化的目的。提取液浓缩至生药:药液为1:5 时,加入ZTCⅢ1+1。
ZTCⅢ1+1 的配制:
A 组分用水配成1%溶液,先用少量水搅成糊状,然后加入需要的水量,溶胀24 小时,搅拌,双层纱布过滤,即得。
B 组分用1%醋酸配成1%溶液,先用少量1%醋酸溶解组分并搅成糊状,再加入需要量的1%醋酸,溶胀24 小时,双层纱布过滤即得。
2.3.1 考察药液浓缩程度对澄清效果的影响
按处方比例称取药材,按最佳工艺条件提取。滤液分别浓缩至生药:水=1:3、1:5、1:8。通过预实验,确定在60℃时,在不断搅拌的情况下,加入澄清剂B 组分至药液出现大量絮状沉淀,保温2 小时,加入1/2B 量的A,保温30 分钟后取出,室温放置12 小时至溶液分层,取上层液以3000R/min 转速离心10 分钟除杂,分别测多糖、总多酚含量和出膏率。
2.3.2 考察澄清剂加入温度对澄清效果的影响
按处方比例称取药材,按最佳工艺条件提取。滤液浓缩至生药:水=1:5 时,分别在50℃、60℃、70℃、80℃时,加入澄清剂B 组分至药液出现大量絮状沉淀,保温2 小时,加入1/2B 量的A,保温30 分钟后取出,室温放置12 小时至溶液分层,取上层液以3000R/min 转速离心10 分钟除杂,分别测多糖、总多酚含量和出膏率。
2.3.3 考察不同澄清剂加入量对澄清效果的影响
按处方比例称取药材,按最佳工艺条件提取。滤液浓缩至生药:水=1:5 时,在70℃时,分别加入澄清剂B 的的量6%、10%、14%时,保温2 小时,加入1/2B 量的A,保温30 分钟后取出,室温放置12 小时至溶液分层,取上层液以3000R/min 转速离心10 分钟除杂,分别测多糖、总多酚含量和出膏率。
2.3.4 考察澄清剂A 组分加入量对澄清效果的影响
按处方比例称取药材,按最佳工艺条件提取。滤液浓缩至生药:水=1:5 时,在70℃时,加入澄清剂B 的的量10%时,保温2 小时,加入澄清剂A 的量分别为5%、8%、10%,保温30 分钟后取出,室温放置12 小时至溶液分层,取上层液以3000R/min转速离心10 分钟除杂,分别测多糖、总多酚含量和出膏率。
2.4 灭菌
分别考察不同灭菌温度、不同灭菌时间下的灭菌效果,并对不同灭菌条件下多糖、多酚含量及微生物数量进行测定,确定最佳灭菌参数。
2.5 抗氧化活性测定
2.5.1 清除ABTS 自由基能力测定[11]
配制7 mmol/L 的ABTS 溶液和2.45 mmol/L 过硫酸钾溶液。取等体积的两种溶液混合。在室温条件下避光反应12~16h,配制成ABTS 的储备液。临用前用95%乙醇稀释,使其在734nm波长处的吸光度值为0.70±0.02,此时得到ABTS 自由基工作液。在试管中加入100μl 同浓度的各样品溶液,再加人3.9ml 的ABTS 自由基工作液,摇匀,室温下反应10min,于734nm 波长处测定吸光度值。用Vit C 作为阳性对照,以上实验平行测定3次,求其平均值。
ABTS 自由基的清除率(%)=[1-(A2-A3)/A1]×100%
式中:A1- 乙醇代替样品溶液测得吸光度值;A2- 加入样品后的吸光度值;A3- 乙醇溶液代替ABTS 溶液测得吸光度值。
2.5.2 清除DPPH 自由基能力测定[12]
取不同浓度的各样品溶液2.0ml 加入DPPH 溶液(0.08mg/ml)2ml,摇匀。于室温避光条件下静置20min,517nm 波长处测定吸光度值。
以Vit C 作为阳性对照,以上实验平行测定3 次,求其平均值。DPPH 自由基的清除率计算公式为:DPPH 自由基的清除率(%)=[1-(A4-A5)/A6]×100%
式中:A4- 样品溶液+DPPH 溶液;A5- 样品溶液+乙醇;A6- 乙醇+DPPH 溶液。
3 结果与分析
3.1 水提工艺研究
3.1.1 单因素试验
(1)加水倍量考察
按处方比例,分别称取玫瑰花3g、菊苣4g、大枣5g 和枸杞6g,共18 克,混匀,分别加入8、10、12、14 倍量水,煎煮提取1次,每次2 小时,滤过,滤液冷却至室温,测定总多糖、总多酚含量和出膏率,并计算综合评分。结果见表2。
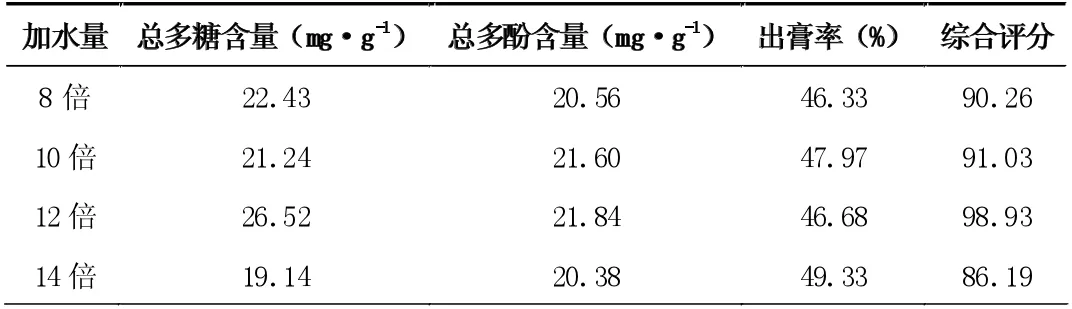
表2 不同加水量对提取效果的影响
(2)煎煮时间考察
按处方比例,分别称取玫瑰花3g、菊苣4g、大枣5g 和枸杞6g,共18 克,混匀,加入10 倍量水,提取时间分别0.5、1、1.5、2小时,各提取2 次,滤过,合并滤液,冷却至室温后,测定总多糖、总多酚含量和出膏率,并计算综合评分,以确定煎煮时间。结果见表3。
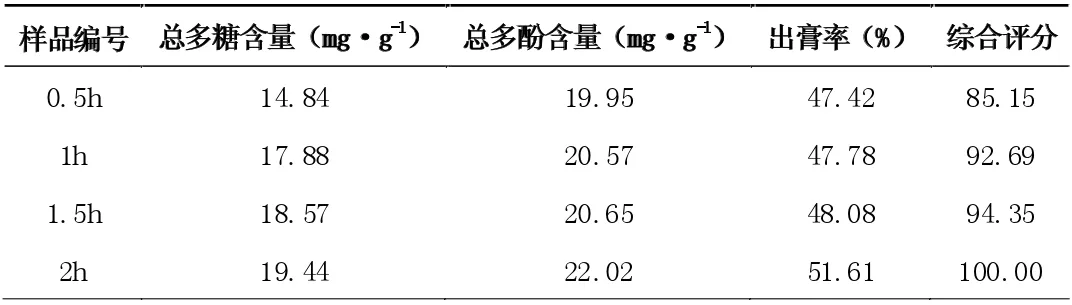
表3 不同煎煮时间对提取效果的影响
(3)提取次数考察
按处方比例,分别称取玫瑰花3g、菊苣4g、大枣5g 和枸杞6g,共18 克,混匀,加入10 倍量水,分别煎煮次数为1 次、2 次、3 次和4 次,每次1 小时,滤过,冷却至室温后,测定总多糖、总多酚含量和出膏率,以确定煎煮次数。结果见表4。
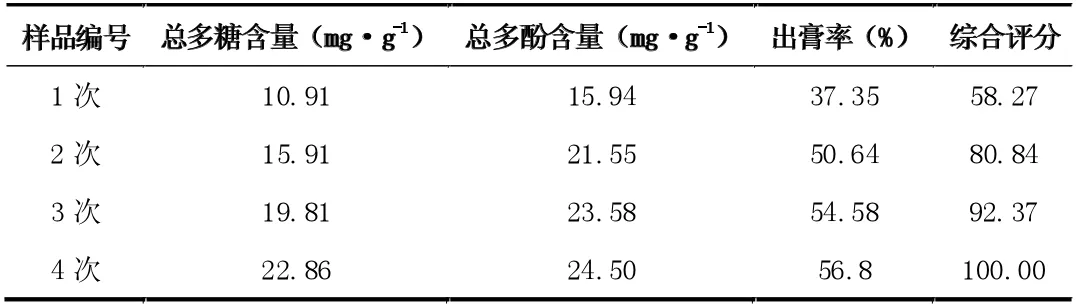
表4 不同提取次数对提取效果的影响
从表2 可见,当加水量在12 倍量时,综合评分已接近100分,故选择加水量10 倍量~14 倍量进一步进行正交试验。从表3 可见,综合评分随提取时间的增大而增大,当提取时间为1.5小时时,综合评分为94.35 分,故选择1.0 小时~2.0 小时进一步进行正交实验。
从表4 可见,综合评分随提取次数的增加而增大,当提取2次时,综合评分已达80.84 分,故选择提取次数1~3 次进一步安排正交试验。
3.1.2 正交试验
单因素实验确定了各因素各水平的用量范围,在此基础上,以加水量、提取时间和提取次数为因素分配各水平。因素水平安排见表1,结果见表5,方差分析见表6。
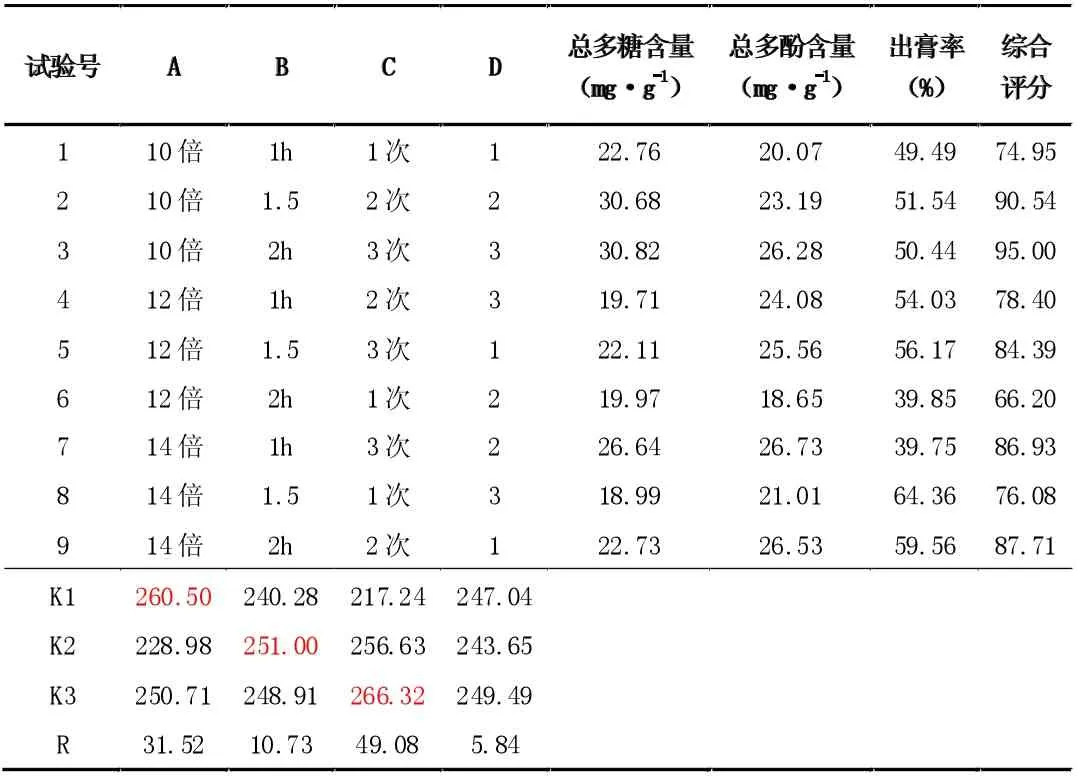
表5 L9(34)正交试验表
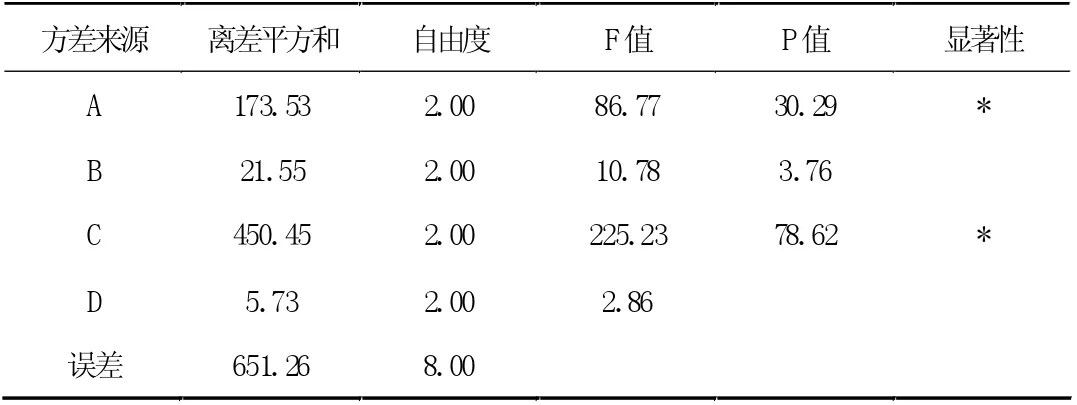
表6 方差分析表
由直观分析结果可知:各因素对试验结果的影响程度分别为C>A>B,各因素的最佳水平为A1B2C3。方差分析结果表明:A因素、C 因素对试验结果在统计学上有显着性影响(P<0.05),而B 因素对试验结果在统计学上无显着性影响(P>0.05)。为降低成本、节省工时,结合单因素实验结果,确定最佳提取工艺为:A1B2C2,即加水量为10 倍,提取时间为1.5h,提取次数为2 次。
3.2 水提液除杂结果
3.2.1 不同离心时间除杂结果
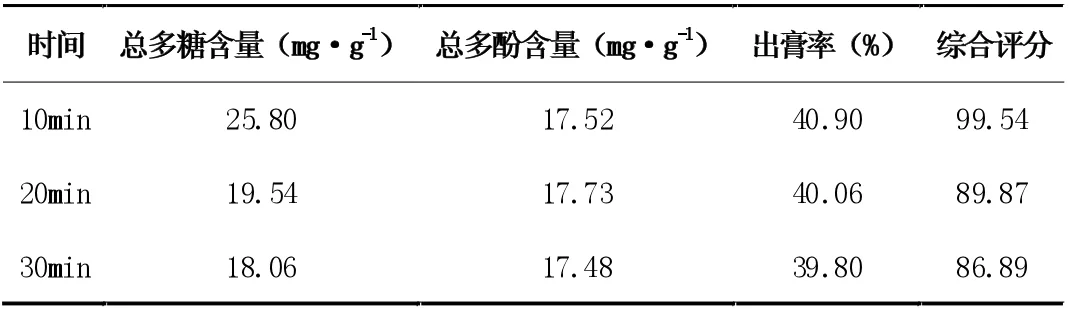
表7 离心时间的考察
3.2.2 不同离心转数除杂结果
由表7、8 结果可知,虽然转速为3000R/min 时,综合评分高,但提取液澄清效果不如转速为5000R/min 时,因此提取液浓缩至生药:药液为1:10 时,选择5000R/min 转速离心10 分钟除杂。
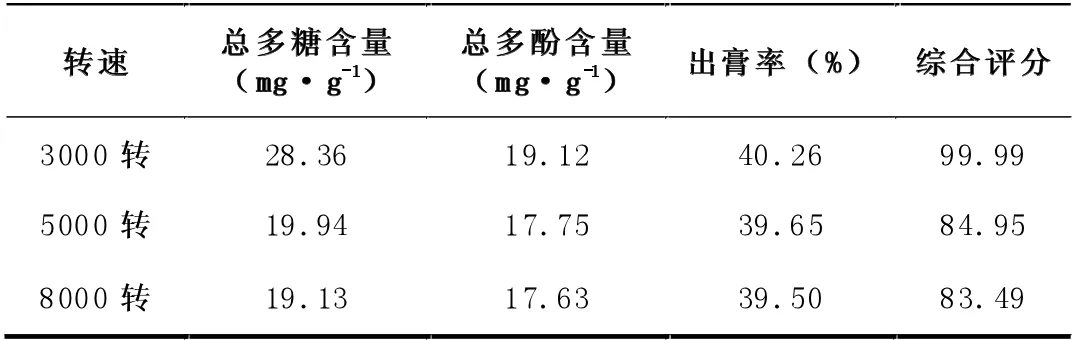
表8 离心转数的考察
3.3 水提液的澄清结果
3.3.1 水提液的浓缩对澄清效果的影响
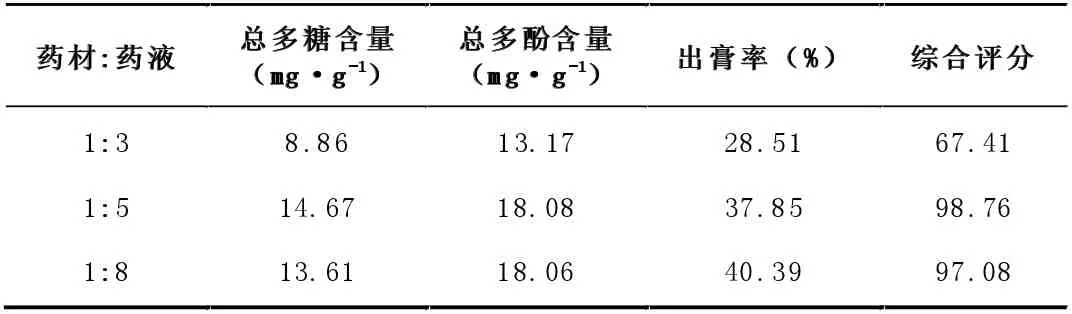
表9 药液浓缩程度考察表
表9 实验结果表明,当药液浓度过大时,对有效成分损失较多,浓度较小时损失较少。因此,选择药材:药液为1:5 较为合适。
3.3.2 澄清剂加入温度对澄清效果的影响

表10 澄清剂加入温度对澄清效果的影响
表10 实验结果可知,当滤液浓缩至生药:水=1:5 时,在70℃时加入澄清剂,澄清效果最好。
3.3.3 不同澄清剂加入量对澄清效果的影响
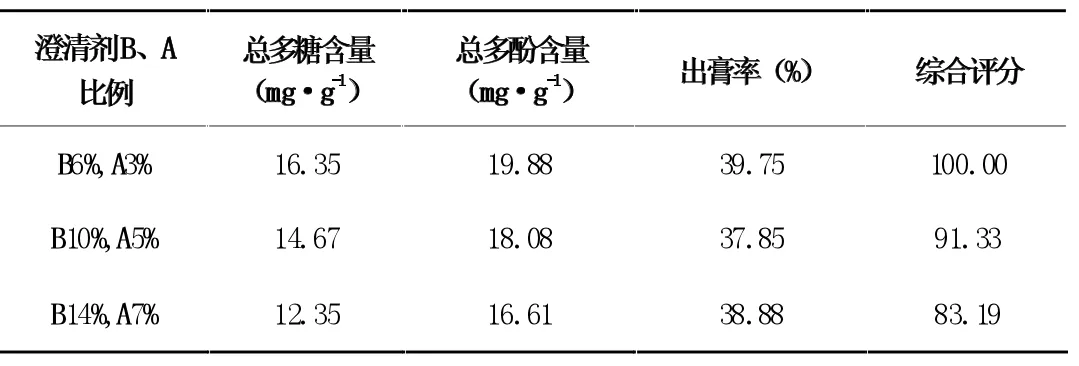
表11 不同澄清剂加入量对澄清效果的影响
由表11 结果可知,当澄清剂B 的加入量为6%,A 的加入量为3%时,提取液综合评分最高,但提取液分层效果不好;当澄清剂B 的加入量为10%,A 的加入量为5%时,提取液综合评分较高,且溶液分层效果好。因此当滤液浓缩至生药:水=1:5时,在70℃时加入澄清剂B 的量为10%,A 的量为5%时,澄清效果最好。
3.3.4 澄清剂A 组分加入量对澄清效果的影响:
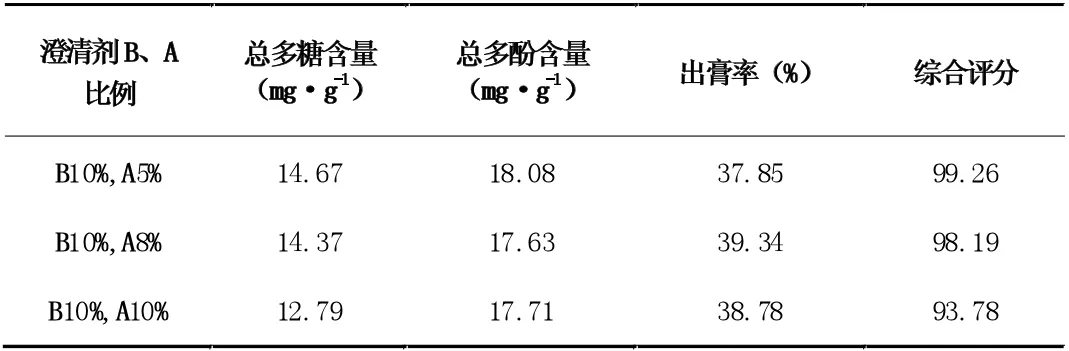
表12 澄清剂A 的量对澄清效果的影响
由表12 结果可知,当滤液浓缩至生药:水=1:5 时,在70℃时加入澄清剂B 的量为10%,A 的量为5%时,澄清效果最好。
3.4 灭菌
按处方比例称取药材,按最佳工艺条件提取。水提液浓缩、澄清、除杂后,移入25mL 具塞试管中,采用巴氏杀菌法,通过改变杀菌温度和时间对样品进行处理,测定杀菌前后的口服微生物数量、PH、多糖含量和感官得分,确定最佳杀菌条件。
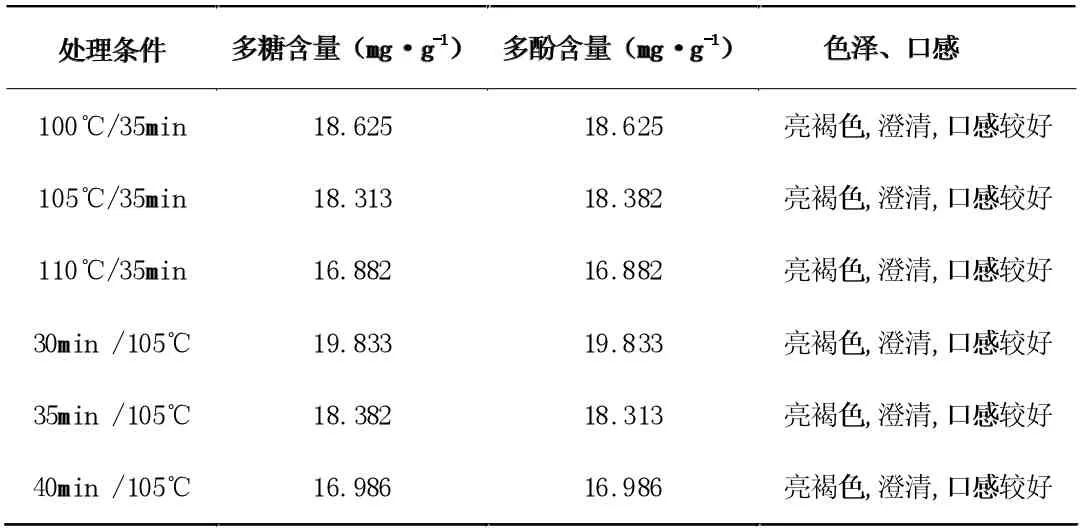
表13 灭菌方法对口服液指标的影响结果
由表13 结果可知,在能完全杀灭微生物的条件下,采用三种条件的巴氏杀菌处理后,口服液的多糖、多酚含量方面,符合随温度升高而降低的趋势,105℃/30min 条件下处理得到的口服液多糖、多酚含量显着高于其他两种杀菌水平。色泽口感方面,三种杀菌条件几乎无差别。所以,巴氏杀菌法的最佳杀菌条件为化105℃/30min。
3.5 抗氧化试验结果

表14 口服液对ABTS、DPPH 的抑制活性
IC 50 值越小,玫菊口服液清除自由基的能力越强。由表14结果可知,玫菊口服液对对ABTS、DPPH 有明显的清除作用,与阳性对照VC 相比,玫菊口服液清除ABTS 自由基的效果明显高于清除DPPH 自由基。
4 结论
采用单因素实验,对影响提取效率的加水量、提取时间和提取次数进行考察,以总多糖含量、总多酚、出膏率进行综合评价。在单因素的基础上进一步进行正交实验设计,确定了玫菊口服液的最佳提取工艺:加水量为10 倍,提取时间为1.5h,提取次数为2 次。在此工艺条件下,将水提液浓缩至生药:水=1:5,在70℃时加入澄清剂B 的量为10%,A 的量为5%时澄清效果最好,经过5000R/min 转速离心10 分钟除杂,灌装后,经105℃/30min 条件下灭菌,既得玫菊口服液。采用DPPH 法、ABTS 法测定玫菊口服液抗氧化活性,结果表明玫菊口服液对DPPH 和ABTS 自由基均有一定的清除作用。从天然产物中探索新的清除人体自由基的抗氧化剂成为医药和保健事业发展的趋势。
通过本试验研究,表面玫菊口服液在保健药品上有潜在开发利用价值。



