冯晓勤 刘元春
近年来,对骨髓间充质干细胞(MSC)的研究初步显示,其能促进造血干细胞移植后的供者细胞植入及抑制移植物抗宿主病(Graft Versus Host Disease, GVHD)的发生。但骨髓间充质干细胞对上述作用的免疫调控机制尚有待于进一步研究。基础研究已经发现GVHD的发生、发展与淋巴细胞趋化因子受体存在着相关性,本实验拟通过研究MSC对小鼠T淋巴细胞亚群增殖后表达趋化因子受体的变化,来更深入地了解MSC的免疫调控机制。
1 材料与方法
1.1 材料
1.1.1 动物 8~12周龄的雄性C57BL/6小鼠,重量180~220 g,清洁级。由南方医科大学实验动物中心引进,南方医科大学动物中心无菌层流仓饲养。
1.1.2 主要试剂及仪器设备 LG-DMEM (美国,Gibco),植物血凝素PHA(美国,Sigma),小鼠CD3-CY-5单抗、小鼠CD4-FITC单抗、小鼠CD8-FITC单抗、小鼠CCR7-PE单抗、小鼠CCR5 -PE单抗、小鼠CXCR3-PE单抗(美国,ebioscience)。流式细胞仪(美国,FACScan,BD)。
1.2 实验方法
1.2.1 小鼠骨髓间充质干细胞的培养和分离 C57BL/6小鼠(8~12周龄)颈椎脱臼处死后置酒精中浸泡10 min,无菌条件下取小鼠双侧股骨及胫骨,无菌层流操作台上用注射器吸取含50μl/ml庆大霉素LG-DMEM培养液冲洗小鼠股、胫骨干骺端,分别采用4、7号针头抽吸含骨髓细胞的培养液,制成单细胞悬液,用含10%胎牛血清的LG-DMEM培养液接种于25 cm2培养瓶中,调整细胞密度为2×105/cm2。5%CO2,37 ℃饱和湿度培养,每24~36小时后去除悬浮细胞,每3~4天全量换液。待细胞融合达70%~80%后,0.25%胰蛋白酶EDTA消化,收集细胞传代培养,取3~8代细胞用于实验研究。
1.2.2 淋巴细胞增殖试验及实验分组 C57BL/6小鼠(8~12周龄)颈椎脱臼处死后置酒精中浸泡10 min,无菌条件下取脾脏置于PBS溶液中,剪切脾脏,200目钢筛过滤制成单细胞悬液,加入红细胞裂解液2 ml孵育2 min,PBS离心洗涤,24孔培养板每孔加入1×106细胞数,每孔含植物血凝素20 μg/ml。试验分组:A组按10%比例混合培养小鼠间充质干细胞及脾细胞;B组按1%比例混合培养MSC及脾细胞;C组为单纯小鼠脾细胞作为对照组,于37℃,5%CO2孵育3 d后检测小鼠淋巴细胞各亚群中趋化因子CXCR3、CCR5及CCR7的表达。
1.2.3 流式细胞术检测趋化因子受体表达 每培养孔各取细胞2×105个,采用三色荧光标记法分别标记CD3、CD4、CD8及小鼠趋化因子受体CXCR3、CCR5、CCR7单克隆抗体。在流式细胞仪上经CellQuest软件获取细胞并分析CD3+CD8+及CD3+CD4+细胞亚群表达趋化因子的百分率。
1.3 统计学处理 采集数据用SPSS 10.0软件包及Exce 17.0分析统计软件处理。多组之间均数比较采用方差分析,多组均数间的多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
在CD3+CD8+亚群中,添加了骨髓间充质干细胞的两个培养组(10%MSC组及1%MSC组)均较对照组增高表达CXCR3及CCR7(P<0.05),而CCR5仅在10%MSC的高浓度组较对照组有增高表达。在CD3+CD4+亚群中,CXCR3的表达在10%MSC组、1%MSC组及对照组表达差异均无统计学意义(P>0.05);CCR5及CCR7在添加了骨髓间充质干细胞的两个培养组均较对照组增高表达,且在该两种骨髓间充质干细胞浓度梯度中呈剂量依赖性,见表1、2。
表1 MSC对小鼠CD3+CD8+淋巴细胞亚群表达趋化因子受体的影响(±s) %
*P<0.05,△P<0.01,与C组比较;#与B组比较,P<0.01
分组 CD3+CD8+CXCR3+ CD3+CD8+CCR5+ CD3+ CD8+CCR7+A组[MSC +脾细胞 (10%MSC)]17.81±2.90*7.40±2.53*7.59±1.08△#B组[MSC +脾细胞 (1%MSC)]13.84±7.31* 12.61±5.00 10.60±2.55△C组[脾细胞 (对照组)]3.71±0.401.23±0.330.93±0.24 F 值 7.68 12.44 28.50 P 值 <0.05 <0.05 <0.05
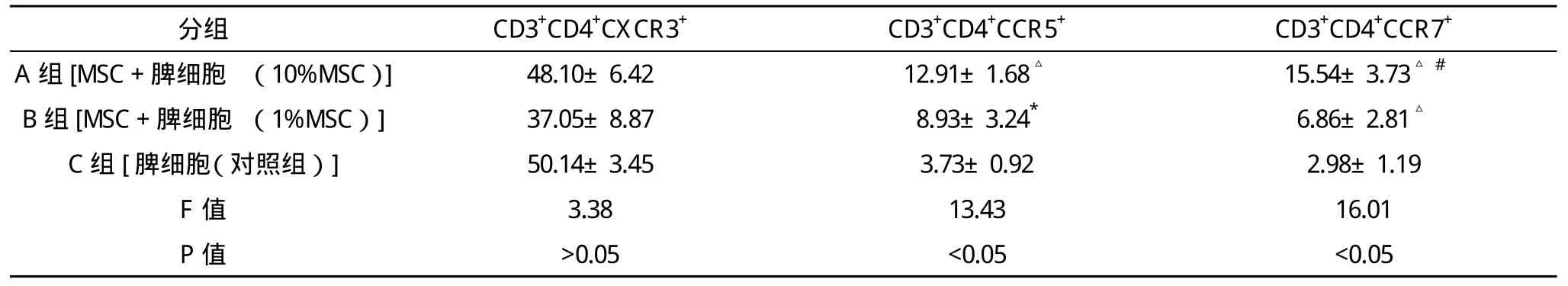
表2 MSC对小鼠CD3+CD4+淋巴细胞亚群表达趋化因子受体的影响(-x±s) %
3 讨论
趋化因子受体属于G蛋白偶联受体超家族,在细胞的增殖、迁移、炎症反应等生理功能及病理机制中发挥重要作用,趋化因子受体在趋化因子的作用下,通过激活选择素/整合素等粘附分子,诱导白细胞的粘附、穿透血管内膜及向特定部位的迁徙。其中T淋巴细胞能对多种趋化因子发生反应[1]。
骨髓间充质干细胞(Mesenchymal stem cell,MSC)是目前倍受关注的一类具有多向分化潜能和高度自我更新能力的组织干细胞[2],此外骨髓间充质干细胞表面还表达多种黏附分子及趋化因子,具有促进造血干细胞归巢的作用,在体外支持造血干细胞扩增,临床多项研究显示MSC能促进造血干细胞植入[3],且可抑制移植物抗宿主病(GVHD),因此MSC已被FDA批准用于临床造血干细胞移植。
2002年第1例MSC用于半相合造血干细胞移植未发生严重GVHD[4];Ning H.及来自欧洲外周血及骨髓移植多中心Ⅱ期临床研究显示MSC对HLA不全相合造血干细胞移植后并发的严重或难治性移植物抗宿主病显示出较好的预防及治疗效果[5-6]。Ikehara S教授把骨髓和股骨在小鼠身上进行移植,移植后发现在胸腺中可以找到供者的骨髓间充质干细胞,表明骨髓间充质干细胞可以移行到胸腺,并且参与胸腺细胞的阳性选择[7]。骨髓间充质干细胞移行至胸腺及T细胞表达趋化因子受体上调,有利于供者T细胞移行至胸腺进行驯化及选择,可能是骨髓间充质干细胞抑制GVHD的原因之一。
由于趋化因子受体本身可能参与GVHD的发生及发展[8-9],MSC抑制GVHD的作用是否与MSC对趋化因子受体的免疫调控有关,是否与不同细胞亚群对趋化因子表达谱不同有关,在本试验中,骨髓间充质干细胞能上调T淋巴细胞CD3+CD+8亚群表达趋化因子受体CCR5、CCR7、CXCR3;同时促进CD3+CD4+亚群表达CCR5、CCR7,而且在CD3+CD4+亚群中的上调表达呈MSC剂量依赖性。提示骨髓间充质干细胞可能提高T细胞的趋化能力,有利于促使淋巴细胞在趋化因子的作用下移行和归巢到趋化因子表达较高的骨髓和外周造血器官如胸腺、淋巴结、脾脏和肝脏,但其对GVHD发生发展的实际影响,有待于进一步研究。
[1]Hideshima T, Podar K, Chauhan D, et al. Cytokines and signal transduction[J]. Best Pract Res Clin Haematol,2005, 18(4): 509-524.
[2]Friedenstein A J. Stromal mechanisms of bone marrow: cloning in vitro and retransplantation in vivo[J]. Haematol Blood Transfus, 1980, 25:19-29.
[3]Noort W A,Kruisselbrink A B,In’t Anker P S, et al. Mesenchymal stem cells promote engraftment of human umbilical cord bloodderived CD34(+) cells in NOD/SCID mice[J]. Exp Hematol,2002 ,30(8):870-878.
[4]Lee S T, Jang J H, Cheong J W, et al. Treatment of high-risk acute myelogenous leukemia by myeloablative chemoradiotherapy followed by co-infusion of T cell-depleted haematopoietic stem cells and cultureexpanded marrow mesenchymal stem cells from a related donor with one fully mismatched human leucocyte antigen haplotype[J]. Br J Haematol, 2002,118(4):1128-1131.
[5]Ning H, Yang F, Jiang M, et al. The correlation between cotransplantation of mesenchymal stem cells and higher recurrence rate in hematologic malignancy patients: outcome of a pilot clinical study[J]. Leukemia, 2008,22(5): 593-599.
[6]Le Blanc K, Frassoni F, Ball L, et al. Mesenchymal stem cells for treatment of steroid-resistant,severe, acute graft-versus-host disease: a phase II study[J]. Lancet, 2008, 371(121): 1579-1586 .
[7]Li Y, Hisha H, Inaba M, et al. Evidence for migration of donor bone marrow stromal cells into recipient thymus after bone marrow transplantation plus bone grafts: A role of stromal cells in positive selection [J]. Experimental Heamatology, 2002, 28(8): 950-960.
[8]Coghill J M,Carlson M J,Panoskaltsis-Mortari A, et al. Separation of graft-versus-host disease from graft-versus-leukemia responses by targeting CC-chemokine receptor7 on donor T cells [J]. Blood,2010,115(23):4914-4922.
[9]Broen K, Van der Waart A B, Greupink-Draaisma A, et al.Polymorphisms in CCR6 are associated with chronic graft-versus-host disease and invasive fungal disease in matched-related hematopoietic stem cell transplantation [J]. Biol Blood Marrow Transplant, 2011,17(10):1443-1449.



