
摘 要:文章研究了使用超声和冷碱结合的办法,从螺旋藻干粉中提取可溶性多糖的工艺条件并进行优化。探究了在不同超声温度,超声时间以及固液比的情况下探索最佳的提取条件。试验中使用分光光度计法来测定水溶性多糖的含量。通过分析得出最优条件,并且在该条件下进行提取,最后螺旋藻多糖得率为25.4%。
关键词:螺旋藻;多糖;超声;提取
1 概述
螺旋藻多糖是从螺旋藻中分离纯化的一种水溶性多糖,为一种白色粉末状物质,具有显着的抗辐射,抗突变功能,可在防癌、抗衰老、增强机体免疫力等方面发挥作用。因此,它在实践应用上具有诱人的前景。
自六十年代始,全世界各国已经在不同程度上开始发展螺旋藻的研究并且进行投入生产,就像着名藻类学家R.D.Fox所言:“螺旋藻越来越普及,世界需求将以百万吨单位计算,甚至更大”[1]。虽然我国对螺旋藻的研究和开发起步比较晚,但研究和发展的速度却很快[2-3]。“九.五”期间,螺旋藻的优良品系的筛选、生物反应器的发展和深加工,都已被列入国家高新技术研究发展计划中。多糖是生物体内的另外一类比较重要的生物大分子,一些生物多糖如海藻酸钠、真菌多糖、和肝素等,具有许多相当重要的生理功能和生物活性,就比如抗凝血、防护放射损伤、抗衰老、抗肿瘤、抗细菌和病毒性感染和刺激免疫,降低血糖含量等活性[4-7]。且细胞表面的多糖更具有细胞间信息传递、通讯识别、物质运输和交换、免疫等相当重要的功能[7-9]。目前对多糖的研究范围和方式越来越广,研究所取得的成果亦越来越多,生物多糖已经成为研究的新热点。
螺旋藻多糖的提取过程比较复杂,原因是因为螺旋藻多糖的化学成分组成很复杂。至今没有一个概念能相对准确的概述螺旋藻多糖的提取率,影响其提取率和产品质量的因素太多,螺旋藻的培养条件的不同、对其提纯的方法的不同,引起的差别也会很大[10-12]。
2 材料与方法
2.1 主要试剂及仪器
螺旋藻、无水乙醇、乙醚、丙酮、石油醚、 正丁醇、氯仿、硫酸、苯酚、葡萄糖、料理机、超声波清洗机、722可见分光光度计等。
2.2 实验流程
干螺旋藻→打粉→超声,碱液冷抽→离心→浓缩→脱蛋白→沉淀→洗涤干燥→称量,定容→测吸光度→计算提取率。
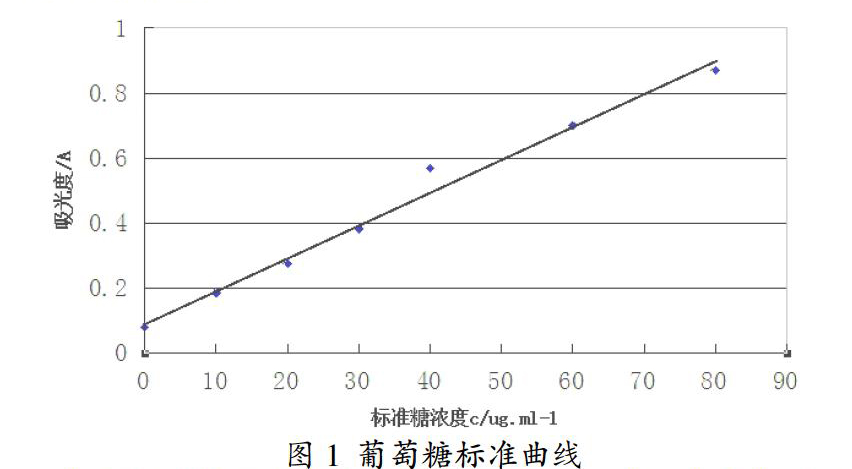
2.3 葡萄糖标准曲线的绘制
准确量取葡萄糖标准用液(100μg·mL-1)0,1,2,3,4,6,8,10 mL,然后分别加入到100 mL容量瓶中,再定容,定容后分别吸取1 mL于试管中,再滴加1-2滴80%重蒸苯酚溶液,并迅速滴加5 mL浓硫酸,摇匀,静置,并且冷至室温,在490 nm波长处用722分光光度计测定其吸光度。
以标准的葡萄糖浓度为横坐标,吸光度为纵坐标作标准曲线,得方程为:A=0.00932+0.00887 C,r=0.9983,则最佳测试浓度为10-60μg·mL-1。
2.4 样品含量的测定
准确称取干燥至恒重的样品10mg,置于100mL容量瓶中,定容,吸取样品液1mL于磨口试管中,然后同标准曲线制作的步骤,测得样品的吸光度,由回归直线方程求得其浓度C,由下公式求螺旋藻多糖的含量。
粗多糖得率=(C×N)/(106×W)×100%
C:稀释后苯酚-硫酸法所测吸光度,由回归直线方程求得的浓度(Ng·mL-1);N:稀释倍数w:藻螺旋藻干粉质量(g)。
3 结论
3.1 单因素实验
螺旋藻多糖提取的主要影响因素有浸取固液比,超声时间,超声温度等,本实验选择这三个因素进行单因素实验。
3.1.1 超声温度对提取率的影响。称取五份10g的螺旋藻干粉,在固液比1:9,pH为10的冷碱液中,分别在25℃,35℃,45℃,55℃,65℃的超声温度下超声1h,提取多糖,得到实验结果如图2所示。
由图2的结果分析,从研究的范围看,超声温度越高,螺旋藻多糖的提取率就越高,但是当温度超过45℃的时候,呈现出先大幅度下降的趋势。分析可能是超声温度太高,影响多糖结构的稳定性,从而影响到多糖的提取率。
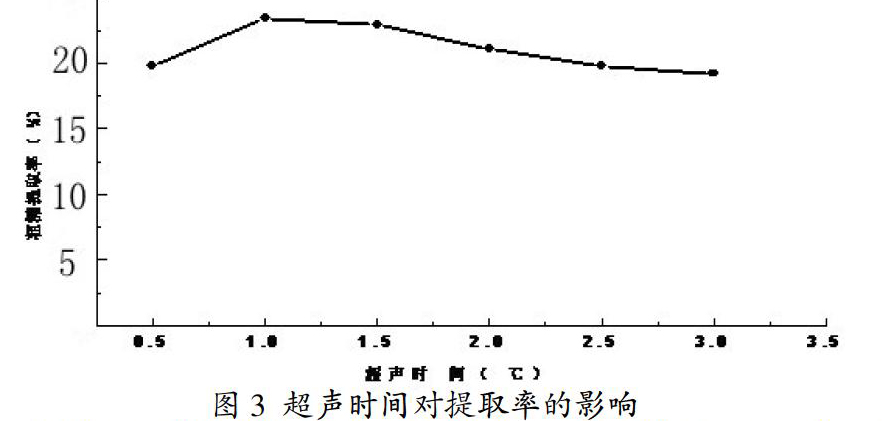
3.1.2 超声时间对提取率的影响。称取四份10g的螺旋藻干粉,在固液比1:9,pH为10的冷碱液中浸取,并在温度为45℃下分别超声0.5h,1.0h,1.5h,2.0h,提取多糖,得到实验结果如图3所示。
由图3的结果分析,从研究的范围看,超声时间在0.5h到1.0h的时候,提取率在上升,但是当温度超过1.0h的时候,提取率处于下降的趋势。分析可能是超声时间太久,使得大量的蛋白质和杂质溶出,影响多糖的提取率。
3.1.3 固液比对提取率的影响。称取六份10g的螺旋藻干粉,分别以固液比为1:1,1:3,1:6,1:9,1:12,1:15,pH为10的碱性溶液中浸取,并在45℃的超声波中超声1.0h,提取多糖,得到实验结果如图4所示。
由图4的结果分析,从研究的范围看,固液比的增大,粗糖的提取率也在增大,但是其增幅却并非越来越大,而是呈现出先大幅度增加后渐渐趋于平缓的趋势。固液比越大,螺旋藻中的多糖充分溶出,再继续增大则不会对提取率产生太大的影响。
3.2 正交试验
螺旋藻多糖的提取率作为评定指标,通过单因素实验得到了固液比在1:9,超声时间在1h左右,超声时温度为45℃时为最佳的实验条件,选择超声提取温度、超声提取时间、固液比三个因素来进行考察,每个因素设计四个水平,选择L16(34)正交表,进一步得到更优的实验条件,实验设计如表1所示。
从表2可以看出,各因素对螺旋藻多糖提取率的影响程度是不一样的,极差越大其影响程度就越大。三个因素的影响次序为固液比(C)>超声温度(B)>超声时间(A)。在A、B、C、三个因素中,因素固液比C的影响具有比较显着的意义,即液固比的比例较大,也就是乙醇的体积越大而使得螺旋藻多糖的提取越充分。试验得出的最佳水平为A2B3C4。
4 结束语
文章提取的螺旋藻多糖为粗多糖,所以提取率偏高。如果要得到食用级别的螺旋藻多糖还要进一步进行纯化、优选。
参考文献
[1]杜林方,付华龙,邹晓东.铜离子对钝顶螺旋藻完整细胞中光系统Ⅱ活性和藻胆体能量传递的影响[J].植物学报,1995,37(2):109-113.
[2]李定梅.国内螺旋藻产业现状及展望[J].螺旋藻产业创刊号,1999,
32(2):9.
[3]陈峰,姜悦.微藻生物技术[M].北京:中国轻工业技术出版社,1999,30(1):19 .
[4]Ratana Chaiklahan, Nattayaporn Chirasuwan, Panya Triratana et al. Polysaccharide extraction from Spirulina sp. and its antioxidant capacity[J] International Journal of Biological Macromolecules,2013 (58):73-78.
[5]Fei X G.Lu S and Bao Y.et al.Seaweed cultivation a new applied field Forbiotechnology[J].Chin J.oceanol.Limno ll6.seppl,1997,30(2):158-161.
[6]Fei X G.Lu S and Bao Y.et al.Seaweed cultivation in Chlna[J].World Aquaculture,1998,29(4):22-24.
[7]王辉.螺旋藻水溶多糖的分离纯化[J].华南师范大学学报,1998,32(4):59-62.
[8]曾和平.螺旋藻多糖的化学研究[J].药学学报,1995,30(11):858-861.
[9]王辉.螺旋藻水溶多糖的分离纯化及其基本征特性[J].精细化工,1999(16):59-62.
[10]钱志刚.螺旋藻多糖提取新工艺研究[J].淮海工学院学报,2000,9(2):50-52.
[11]章银良.螺旋藻多糖提取新工艺的研究[J].食品与发酵工业,1999,
25(2):15-18.
[12]夏冰,郭育涛,李晓晨.螺旋藻多糖粗提的新方法工艺条件研究[J].应用化工,2010,39(6):892-894.
作者简介:宋照风(1984-),女,实验师,硕士研究生,主要从事实验室工作,研究方向为天然产物提取。



