汪晓巍,白伊娜,陈梅,李丽平
中国医学科学院北京协和医院1检验科,2免疫内科实验室,北京1007300
NOD样受体热蛋白结构域相关蛋白3(nucleotide binding oligomerization-like receptor family pyrin domain containing 3,NLRP3)是近年来发现的NLRP家族中的重要成员,能够识别病原体及组织损伤相关的分子[1]。NLRP3主要分布于细胞间质和细胞膜中,可以参与多种宿主的免疫反应和炎症反应。NLRP3激活后可以与凋亡相关斑点样蛋白、半胱天冬氨酸酶-1等蛋白质分子组装形成多聚复合物——炎症小体,从而促进白细胞介素-1等炎性因子的分泌及细胞凋亡的发生,诱发剧烈炎症反应。NLRP3炎症小体异常激活与肿瘤、自身免疫疾病等多种重大疾病密切相关。细胞角蛋白20(cytokeratin 20,CK20)是细胞角蛋白家族中的重要成员,具有很强的组织特异性,表达于尿道上皮细胞的表层和中间层,由于膀胱癌(bladder cancer,BCa)细胞很容易脱落到尿液中,因此,CK20可以作为BCa的肿瘤标志物。本研究旨在明确BCa患者尿沉渣中NLRP3基因的表达情况,并通过与CK20基因进行比较,探讨NLRP3基因在诊断BCa中的应用价值。
1 对象与方法
1.1 研究对象
选取2016年4月至2017年1月中国医学科学院北京协和医院收治的52例初发BCa患者为BCa组。纳入标准:①初发BCa;②行经尿道膀胱肿瘤电切术;③术后病理证实为非肌层浸润性BCa。排除标准:复发性BCa或肌层浸润性BCa。选取同期于中国医学科学院北京协和医院治疗的55例膀胱炎患者为CTR1组。纳入标准:①有尿频、尿急和尿痛病史;②尿液常规检查可见红细胞、脓细胞。排除标准:伴随其他泌尿生殖系统感染。选取同期于中国医学科学院北京协和医院行健康体检的53例健康者为CTR0组。纳入标准:无器质性病变。排除标准:血常规和尿常规有异常值。BCa组患者中,男43例,女9例;平均年龄(60.2±10.7)岁。CTR1组患者中,男32例,女23例;平均年龄(53.5±11.0)岁。CTR0组中,男31例,女22例;平均年龄(52.3±11.7)岁。所有受试者均对本研究知情同意并签署知情同意书。
1.2 仪器与试剂
总RNA提取试剂盒购自加拿大Norgen Biotek公司;Qubit RNA HS Assay Kit购自美国Life Technologies公司;ABI 7900 Real-Time PCR System购自美国Applied Biosystems公司;SuperscriptⅢ和SYRB GreenER qPCR SuperMix Universal购自美国Invitrogen公司
1.3 尿液标本收集和RNA提取
采集BCa患者手术当日晨尿中段尿,采集膀胱炎患者和健康者检查或体检当日晨尿中段尿。将尿液标本于4℃下2000×g离心10 min,收集沉淀并采用磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗2次;随后将沉淀溶于300 μl裂解缓冲液中保存。总RNA提取按照试剂盒说明书进行操作,采用Qubit RNA HS Assay Kit定量后,储存于-80℃冰箱备用。
1.4 实时定量聚合酶链反应法检测NLRP 3、CK20基因的表达水平
总RNA依照总RNA提取试剂盒说明书使用SuperscriptⅢ逆转录成cDNA,反应条件为65℃5 min,50℃ 50 min,85℃ 5 min,37℃ 20 min;将cDNA储存于-20℃冰箱备用。将NLRP3和CK20作为靶基因,以β-actin为内参基因,使用ABI 7900 Real-Time PCR System进行实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)。引物及序列如下所示:β-actin正向引物为 3'-ATCGTGCGTGACATTAAGGAGAAG-5',βactin反向引物为3'-AGGAAGGAAGGCTGGAAGAGTG-5';CK20正向引物为 3'-AAGGAGCATCAGGAGGAAGTC-5',CK20反向引物为 3'-GCCTGGAGCAGCATCAAC-5';NLRP3正向引物为3'-CGGGGCCTCTTTTCAGTTCT-5',NLRP3反向引物为3'-CCCCAACCACAATCTCCGAA-5'。SYRB GreenER qPCR SuperMix Universal反应体系为20 μl,按照95℃ 3 min后95℃ 1 min,55℃ 2 min,循环40次。每个样品重复3次,结果取平均值,ΔCt靶基因=Ct靶基因-Ctβ-actin。
1.5 统计学分析
采用SPSS 13.0软件对数据进行分析。符合正态分布的计量资料以均数±标准差(±s)表示;不符合正态分布的计量资料以中位数(四分位数)[M(P25,P75)]表示,3组间比较采用Kruskal-WallisH检验,3组间两两比较采用Mann-WhitneyU检验;采用受试者工作特征(receiver operating characteristic,ROC)曲线评价NLRP3、CK20基因检测对BCa的诊断效能。所有统计均为双尾,以P<0.05为差异有统计学意义。
2 结果
2.1 尿沉渣中NLRP 3 mRNA和CK20 mRNA表达水平的比较
3组受试者尿沉渣中NLRP3mRNA、CK20mRNA的表达量比较,差异均有统计学意义(H=20.107,P=0.011;H=21.502,P=0.039)。3组间两两比较结果显示:BCa组尿沉渣中NLRP3mRNA的表达量明显高于CTR0组和CTR1组,差异均有统计学意义(U=734.5,P=0.002;U=908.5,P=0.002)。BCa组尿沉渣中CK20mRNA的表达量明显高于CTR0组,差异有统计学意义(U=680.5,P=0.001);BCa组尿沉渣中CK20mRNA的表达量高于CTR1组,但差异无统计学意义(U=1232.0,P=0.166)。(表1)

表1 3组受试者尿沉渣中NLRP 3 mRNA和CK20 mRNA的表达量[M( P25, P75)]
2.2 尿沉渣中NLRP 3、CK20基因对BCa的诊断效能分析
绘制ROC曲线,确定NLRP3和CK20基因的最佳截断值,并计算区别BCa患者与健康者及膀胱炎患者的灵敏度和特异度,结果显示:在综合灵敏度和特异度的情况下,选择10.0为NLRP3基因的截断值,其ROC曲线下面积为0.726(95%CI:0.634~0.799),诊断BCa的灵敏度为47.4%,特异度为86.5%,阳性预测值为62.5%,阴性预测值为77.5%。选择9.0为CK20基因的截断值,其ROC曲线下面积为 0.717(95%CI:0.627~0.788),诊断 BCa的灵敏度为50.0%,特异度为82.0%,阳性预测值为56.5%,阴性预测值为77.2%。将NLRP3值>10.0且CK20值>9.0作为联合诊断标准,其ROC曲线下面积为0.748(95%CI:0.659~0.823),诊断BCa的灵敏度为61.5%,特异度为75.9%,阳性预测值为55.5%,阴性预测值为80.4%。(图1)
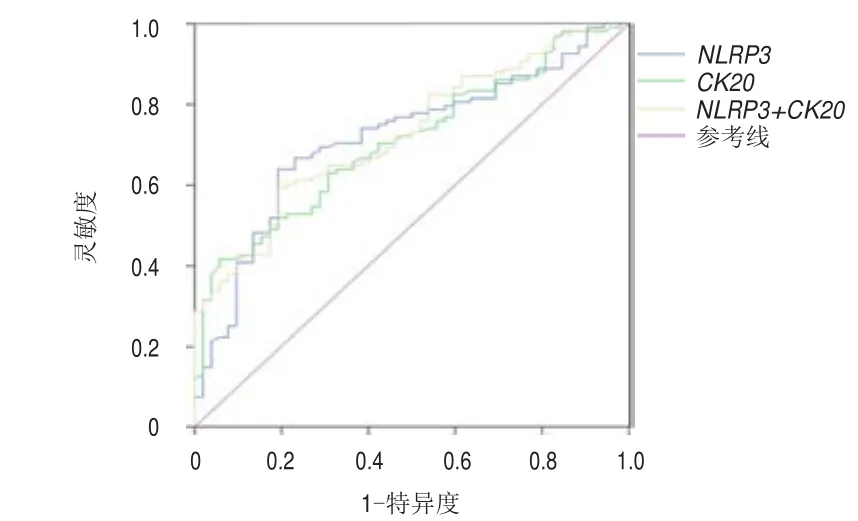
图1 尿沉渣中NLRP 3、CK20基因单独及联合检测诊断BCa的ROC曲线
3 讨论
BCa是世界上第7位最常见的肿瘤,每年有43万新发肿瘤病例和超过16.5万的肿瘤死亡病例[2]。BCa的诊断主要基于膀胱镜和尿脱落细胞学检查(voided urine cytology,UVC)[3]。但UVC的缺点在于其诊断BCa的灵敏度较低(30%~92%),针对低度恶性的肿瘤,UVC的灵敏度仅为30%~40%[4]。虽然UVC是BCa的非侵入性诊断的金标准,但是膀胱镜检查依然是诊断BCa的主要手段。膀胱镜检查具有微创、有痛感的特点,并且是一种潜在的传染过程。因此,寻找BCa早期诊断和判断预后的新方法是泌尿系统肿瘤研究的一大挑战,其可以为改善BCa患者的治疗结果及降低医疗服务成本提供有力的支持。
目前,现有的BCa标志物的灵敏度大都优于UVC,但特异度较低,如核基质蛋白22(nuclear matrix protein 22,NMP22)、TRAK、细胞角质蛋白19片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)等[5]。在所有候选的BCa生物标志物中,CK20是一种低分子量蛋白,表达于尿道上皮细胞的表层和中间层,多项研究证实尿液中CK20蛋白和mRNA均可以作为BCa的肿瘤标志物[6-7]。还有研究表明,在肿瘤的发生、发展过程中,15%以上的肿瘤都有慢性炎症反应参与其中,而以NOD样受体(nucleotide binding oligomerization domain-like receptor,NLR)为代表的模式识别受体在多种生理过程中发挥作用,特别是通过诱导炎症反应等方式影响肿瘤的发生、发展、浸润和转移。肿瘤微环境由炎症细胞和免疫活性细胞组成[8]。其中,NLR和Toll样受体(toll-like receptor,TLR)蛋白是炎症小体的关键成分,是促炎因子白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-18(interleukin-18,IL-18)产生和成熟的分子平台[9]。NLRP3炎症小体是目前研究最广泛的一种蛋白,在多种疾病的发病机制中起着重要作用,包括黑色素瘤、骨髓瘤、结直肠癌等多种肿瘤[10]。在黑色素瘤中,抑制NLRP3炎症小体的活性,可以抑制肿瘤的发展和转移[11]。在骨髓瘤中,NLRP3-caspase 1-IL-1β轴的表达紊乱与肿瘤进展相关[12]。在结直肠癌组织中,NLRP3的表达水平明显降低,并有研究发现在结肠炎小鼠模型中,NLRP3基因敲除小鼠更易患结肠癌,而结肠癌细胞敲除NLRP3基因后,细胞的运动性增强[13-14]。NLRP3影响肿瘤发生发展的机制可能与自噬及自然杀伤细胞活性有关,更深入的分子机制还需进一步的研究。本研究观察了BCa患者尿沉渣中NLRP3、CK20的mRNA表达情况,并评估了两者单独及联合检测在BCa诊断中的价值。
本研究结果显示,BCa组尿沉渣中NLRP3mRNA、CK20mRNA的表达量均明显高于CTR0组(P<0.01),BCa组尿沉渣中NLRP3mRNA的表达量明显高于膀胱炎组(P<0.01),推测NLPR3作为炎症小体在从慢性炎症发展为肿瘤的过程中可能发挥了一定的作用。通过ROC曲线,本研究发现NLRP3、CK20基因诊断BCa的灵敏度分别为47.4%(NLRP3基因截断值为10.0)和50.0%(CK20基因截断值为9.0),而两者联合检测诊断BCa的灵敏度达61.5%,均优于目前常用的细胞学诊断方法。在特异度方面,两者联合的表现也优于新发现的几种标志物[15]。表明NLRP3、CK20基因可以作为新的候选肿瘤标志物用于BCa的临床诊断,且上述两种指标弥补了现有UVC方法和其他分子标志物在灵敏度和特异度方面的不足[5],为发现新的临床诊断方法提供了可能。但是目前对于NLRP3与BCa患者临床特征的关系,及其能否预测BCa预后尚无相关报道,故仍需进一步的研究。
综上所述,炎症小体是肿瘤发生过程中的一个关键因素,NLRP3可能是一个潜在的BCa早期诊断工具,特别是与CK20联合应用。由于本研究纳入的样本量较少,故仍需要样本量更大更深入的研究来明确NLRP3的诊断价值,为BCa的诊断提供新方法。



