方洁,朱建坡,张虎,吕志峰#,张淑香
河南中医药大学第一附属医院1麻醉科,2血液肿瘤科,郑州 450000
膀胱癌是常见的泌尿系统肿瘤之一,发病率逐 年上升[1]。恶性肿瘤的发生发展与抑癌基因失活、原癌基因激活等密切相关,如何激活已经失活的抑癌基因,使其重新获得活性已成为抗肿瘤基因治疗的热点。肌成束蛋白1(fascin 1,FSCN1)最早于海胆的卵母细胞质中被发现,属于肌动蛋白结合蛋白家族成员,在人体正常组织中的表达水平相对较少,而在多种恶性肿瘤组织中表达上调[2-3]。研究显示,抑制FSCN1的表达可降低乳腺癌细胞的增殖能力[4],miRNA-145可靶向抑制FSCN1的表达,从而抑制前列腺癌和胃癌细胞的增殖、侵袭及迁移能力[5-6]。研究发现,抑制FSCN1的表达可抑制膀胱癌细胞的增殖能力[7],但FSCN1对膀胱癌细胞凋亡的影响及具体的作用机制尚未明确。普鲁卡因是一种较为安全的局部麻醉药物,研究表明,普鲁卡因可抑制膀胱癌、鼻咽癌等肿瘤细胞的生长[8-9]。若FSCN1基因可增加普鲁卡因对膀胱癌细胞的生长抑制作用,这将明显有助于膀胱癌的治疗。信号转导及转录激活因子3(signal transduction and activator of transcription 3,STAT3)可参与细胞增殖、分化和凋亡等多种生物学过程,并在多种肿瘤细胞中异常激活,磷酸化STAT3(phospho-STAT3,p-STAT3)也与肿瘤细胞的转移和侵袭密切相关[10]。细胞周期蛋白D1(cyclin D1)是调控细胞周期G1期的关键蛋白,在膀胱癌中过表达,参与膀胱癌细胞的侵袭和转移过程[11]。Bcl-2相关X蛋白(Bcl-2-associated X protein,BAX)是促凋亡因子,其表达情况可间接反映细胞的凋亡情况。本研究通过干扰小RNA(small interfering RNA,siRNA)抑制膀胱癌细胞FSCN1基因的表达,探讨FSCN1siRNA联合普鲁卡因对膀胱癌细胞增殖、细胞周期和细胞凋亡的影响及作用机制,以期为膀胱癌的治疗提供理论基础,现报道如下。
1 材料与方法
1.1 细胞、主要试剂和仪器
人膀胱癌T24细胞购自美国模式菌种收集中心(American Type Culture Collection,ATCC)细胞库。RPMI 1640培养液、胎牛血清均购自美国GIBCO公司,噻唑蓝(methylthiazolyldiphenyl tetrazolium,MTT)溶液购自美国Sigma公司,膜联蛋白V(AnnexinⅤ)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒购自江苏凯基生物技术股份有限公司,FSCN1、STAT3、p-STAT3、cyclin D1、BAX和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体均购自美国CST公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗购自美国Thermo Scientific公司,酶标仪购自美国BIO-RAD公司,流式细胞仪购自美国Beckman公司。
1.2 实验方法
1.2.1 细胞培养及转染采用含10%胎牛血清的RPMI 1640培养基常规培养人膀胱癌T24细胞,置于37℃、5%CO2培养箱培养。取对数生长期的细胞,以5×105/ml的浓度接种于6孔板。当细胞融合度为70%时,将阴性对照的siRNA和FSCN1siRNA分别转染至人膀胱癌T24细胞,分别作为NC组和si-FSCN1组,将仅加入LipofectamineTM2000的T24细胞作为对照组,补加培养液至2 ml,转染体积为100 pmol,转染5~6 h,更换为含血清及青霉素和链霉素的培养基继续培养48 h。
1.2.2 细胞处理及分组取转染后的NC组、si-FSCN1组T24细胞,分别向其中加入4 mmol/L的普鲁卡因处理48 h,分别作为普鲁卡因组和普鲁卡因+si-FSCN1组;未加入普鲁卡因的对照组T24细胞不进行特殊处理。
1.2.3 流式细胞仪检测细胞周期分布情况取对照组、si-FSCN1组、普鲁卡因组和普鲁卡因+si-FSCN1组细胞,预冷后磷酸盐缓冲液(phosphate buffered solution,PBS)冲洗,400 μl的1×结合缓冲液(binding buffer)重悬细胞(约含有 1×106个细胞),缓慢加入1 ml的70%预冷乙醇,于4℃冰箱中固定过夜,PBS冲洗,加入含有100 μg/ml的PI染色液,避光反应30 min,流式细胞仪检测各组细胞的周期分布情况。实验重复3次。
1.2.4 MTT 法检测细胞增殖能力取对照组、si-FSCN1组、普鲁卡因组和普鲁卡因+si-FSCN1组T24细胞,以每孔4×103/ml的浓度接种于96孔板,每孔 100 μl,常规培养 24 h,每孔加入 5 mg/ml的MTT溶液20 μl,培养4 h后加入二甲基亚砜(dimethyl sulfoxide,DMSO)100 μl,振荡混匀 10 min,酶标仪测定570 nm处的吸光度(A)值。实验重复3次。
1.2.5 流式细胞仪检测细胞凋亡情况取对照组、si-FSCN1组、普鲁卡因组和普鲁卡因+si-FSCN1组细胞,预冷后 PBS 洗涤细胞,400 μl的 1×binding buffer重悬细胞(约含有1×106个细胞),分别加入5 μl和 10 μl的 Annexin V-FITC/PI溶液,避光孵育 15~20 min,1 h内采用流式细胞仪检测各组细胞的凋亡情况,检测前加入 1×binding buffer溶液 300 μl。实验重复3次。
1.2.6 蛋白质印迹法(Western blot)检测FSCN1、STAT3、p-STAT3、cyclin D1和BAX 蛋白的相对表达量裂解液提取对照组、NC组、si-FSCN1组、普鲁卡因组和普鲁卡因+si-FSCN1组细胞的总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度。取30 μg的变性蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-poly-acrylamide gel electrophoresis,SDS-PAGE),电转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,洗膜后采用5%的脱脂奶粉室温封闭,4℃摇床孵 育 一 抗(1∶1000稀 释 的 FSCN1、STAT3、p-STAT3、cyclin D1、BAX 及内参 GAPDH 抗体)过夜,洗膜,加入HRP标记的二抗(1∶2000),37℃孵育 1.5 h,电化学发光(electrochemiluminescence,ECL)液显色、定影。Quantity软件分析各蛋白条带灰度值,以目的蛋白与GAPDH蛋白灰度值比值作为各蛋白的相对表达量。实验重复3次。
1.3 统计学方法
采用SPSS 21.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,多组间两两比较采用SNK-q检验;以P<0.05为差异有统计学意义。
2 结果
2.1 FSCN1蛋白相对表达量的比较
转染后,si-FSCN1组T24细胞FSCN1蛋白的相对表达量为(0.09±0.01),明显低于对照组的(0.36±0.04)和NC组的(0.37±0.04),差异均有统计学意义(t=10.671、10.633,P<0.01);且NC组和对照组细胞FSCN1蛋白的相对表达量比较,差异无统计学意义(P>0.05)。
2.2 细胞周期分布情况的比较
普鲁卡因组、si-FSCN1组和普鲁卡因+si-FSCN1组细胞G0/G1期细胞比例均高于对照组细胞,G2/M期、S期细胞比例均低于对照组细胞,差异均有统计学意义(P<0.05);且普鲁卡因+si-FSCN1组细胞G0/G1期细胞比例高于普鲁卡因组和si-FSCN1组细胞,G2/M期及S期细胞比例均低于普鲁卡因组和si-FSCN1组细胞,差异均有统计学意义(P<0.05)。(表1)
表1 4组细胞周期分布情况的比较(±s)
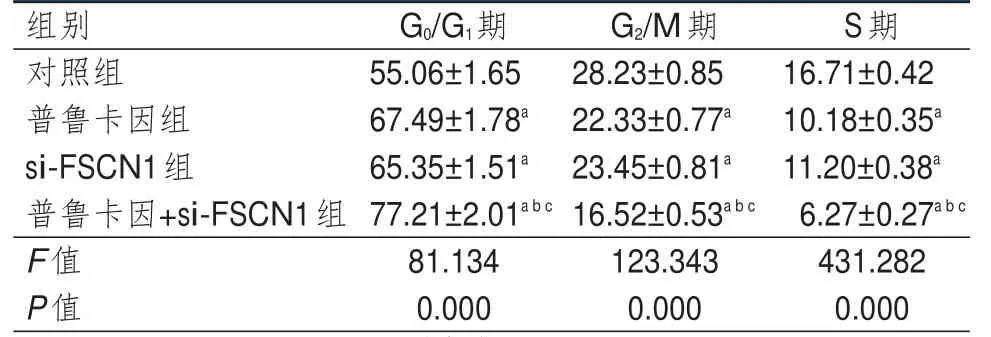
表1 4组细胞周期分布情况的比较(±s)
注:a与对照组比较,P<0.05;b与普鲁卡因组比较,P<0.05;c与si-FSCN1组比较,P<0.05
组别G0/G1期G2/M期S期对照组55.06±1.6528.23±0.8516.71±0.42普鲁卡因组67.49±1.78a22.33±0.77a10.18±0.35a si-FSCN1组65.35±1.51a23.45±0.81a11.20±0.38a普鲁卡因+si-FSCN1组77.21±2.01a b c16.52±0.53a b c6.27±0.27a b c F值81.134123.343431.282 P值0.0000.0000.000
2.3 细胞增殖能力和细胞凋亡率的比较
普鲁卡因组、si-FSCN1组和普鲁卡因+si-FSCN1组细胞A值均低于对照组细胞,细胞凋亡率均高于对照组细胞,差异均有统计学意义(P<0.05);且普鲁卡因+si-FSCN1组细胞A值低于普鲁卡因组和si-FSCN1组细胞,细胞凋亡率高于普鲁卡因组和si-FSCN1组细胞,差异均有统计学意义(P<0.05)。(表2)
表2 4组细胞增殖能力和细胞凋亡率的比较(±s)
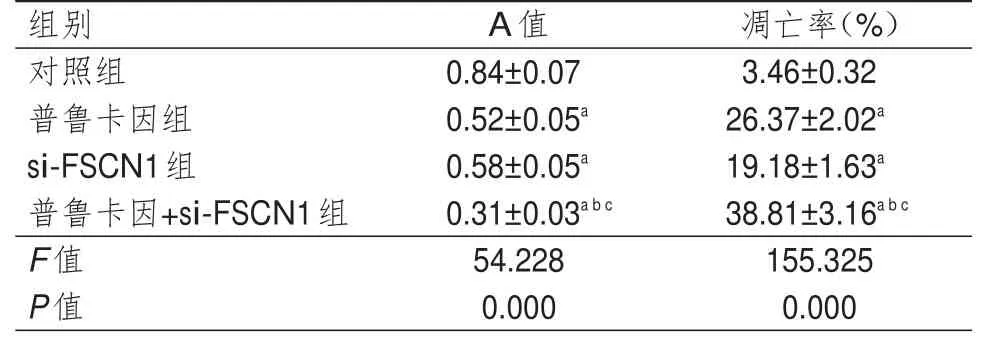
表2 4组细胞增殖能力和细胞凋亡率的比较(±s)
注:a与对照组比较,P<0.05;b与普鲁卡因组比较,P<0.05;c与si-FSCN1组比较,P<0.05
组别A值 凋亡率(%)对照组0.84±0.073.46±0.32普鲁卡因组0.52±0.05a26.37±2.02a si-FSCN1组0.58±0.05a19.18±1.63a普鲁卡因+si-FSCN1组0.31±0.03a b c38.81±3.16a b c F值54.228155.325 P值0.0000.000
2.4 STAT3、p-STAT3、cyclin D1和BAX蛋白的相对表达量的比较
Western blot检测结果显示,普鲁卡因组、si-FSCN1组和普鲁卡因+si-FSCN1组细胞p-STAT3、cyclin D1蛋白的相对表达量均低于对照组细胞,BAX蛋白的相对表达量均高于对照组细胞,差异均有统计学意义(P<0.05);普鲁卡因+si-FSCN1组细胞p-STAT3、cyclin D1蛋白的相对表达量均低于普鲁卡因组和si-FSCN1组细胞,BAX蛋白的相对表达量均高于普鲁卡因组和si-FSCN1组细胞,差异均有统计学意义(P<0.05)。4组细胞STAT3蛋白的相对表达量比较,差异无统计学意义(P>0.05)。(表3)
表3 4组细胞STAT3、p-STAT3、cyclin D1和BAX蛋白相对表达量的比较(±s)
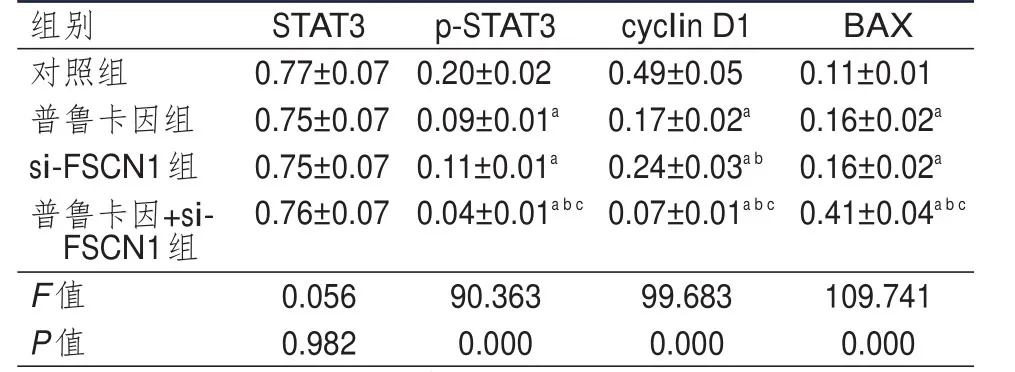
表3 4组细胞STAT3、p-STAT3、cyclin D1和BAX蛋白相对表达量的比较(±s)
注:a与对照组比较,P<0.05;b与普鲁卡因组比较,P<0.05;c与si-FSCN1组比较,P<0.05
组别STAT3p-STAT3cyclin D1BAX对照组0.77±0.070.20±0.020.49±0.050.11±0.01普鲁卡因组0.75±0.070.09±0.01a0.17±0.02a0.16±0.02a si-FSCN1组0.75±0.070.11±0.01a0.24±0.03a b0.16±0.02a普鲁卡因+si-0.76±0.070.04±0.01a b c0.07±0.01a b c0.41±0.04a b c FSCN1组F值0.05690.36399.683109.741 P值0.9820.0000.0000.000
3 讨论
FSCN1是一种细胞骨架蛋白,可与F肌动蛋白交联从而调节细胞膜片状伪足、丝状伪足及微棘的形成,影响肿瘤细胞的侵袭和迁移[12]。研究显示,除肺癌和肝癌外,FSCN1蛋白在大部分上皮肿瘤组织中表达水平较高,且明显高于正常组织[13],表明FSCN1在肿瘤的发生发展中发挥重要作用。但也有研究表明,抑制FSCN1的表达可抑制卵巢癌细胞的增殖能力[14]。研究显示,FSCN1在膀胱癌患者膀胱组织中表达水平较高,且与肿瘤细胞侵袭和转移密切相关[15],抑制FSCN1的表达可抑制膀胱癌细胞的增殖能力[7]。因此,本研究旨在探讨抑制FSCN1的表达对膀胱癌细胞的影响。
RNA干扰是一种新的基因阻断技术,可在转录后抑制相关基因的表达水平,因其对相关基因的抑制作用与基因敲除类似,且具有高特异性和高效性的优势,目前已广泛地应用于基因功能研究和肿瘤的治疗中[16-17]。本研究结果显示,si-FSCN1组细胞A值降低,凋亡率升高,且细胞被阻滞在G0/G1期。普鲁卡因是一种常用的局部麻醉药物,临床主要用于支气管哮喘和老年慢性病等的治疗,研究发现,普鲁卡因可用于抗肿瘤治疗,可抑制包括膀胱癌在内的多种恶性肿瘤细胞的生长[8]。抑制FSCN1基因的表达联合普鲁卡因治疗膀胱癌成为临床研究的热点。本研究结果发现,普鲁卡因联合FSCN1siRNA抑制膀胱癌细胞增殖、诱导细胞凋亡和阻滞细胞周期的作用比FSCN1siRNA或普鲁卡因单独使用的效果更加明显,表明FSCN1siRNA联合普鲁卡因治疗膀胱癌可产生协同作用。
STAT3是是一类重要的转录因子,在多种恶性肿瘤细胞和肿瘤组织中表达异常,与肿瘤细胞的增殖、凋亡、侵袭、转移、免疫逃逸等行为密切相关,STAT3的持续激活可引起细胞的增殖异常和恶性转化[18-20]。但STAT3并不直接作用于肿瘤细胞,而是通过对一些与肿瘤增殖、凋亡等相关因子表达的调控影响肿瘤的发生发展。cyclin D1是STAT3信号下游的靶基因,作为细胞周期核心因子,可使肿瘤细胞由G1期向S期转变,在包括膀胱癌在内的多种恶性肿瘤中异常表达,具有促进肿瘤细胞增殖的作用[21-22]。BAX是B细胞淋巴瘤/白血病-2家族成员,具有促进细胞凋亡的作用,可调控多种恶性肿瘤细胞的凋亡过程[23-24]。本研究结果显示,FSCN1siRNA或普鲁卡因均可抑制p-STAT3、cyclin D1蛋白的表达,上调BAX蛋白的表达,且二者联合的调控作用更明显,表明FSCN1siRNA和普鲁卡因均可通过下调STAT3信号通路的表达抑制膀胱癌细胞的生长。
综上所述,普鲁卡因或FSCN1均可抑制膀胱癌细胞增殖,诱导细胞凋亡,将肿瘤细胞阻滞于G0/G1期,且可能通过STAT3信号通路发挥协同作用。



