刘紫娟,陈冰译,张 锐,周 舟,叶思颖,吴嘉聪,夏慧玲,马婧媛,唐美秀
(1.长沙医学院,湖南 长沙 410219;2.杭州口腔医院,浙江 杭州 310000;3.浙江大学医学院附属第二医院,浙江 杭州 310000)
牙周病是以菌斑生物膜为始动要素的慢性感染疾病,病情延续将破坏牙周软组织及牙槽骨结构,若局部颌骨骨量不足,则会出现颌骨缺损而影响患者面容美观度及生理功能[1]。虽然骨组织修复理论及技术不断完善,但仍有大量术后患者因严重的免疫炎症反应而不能达到预期疗效。近年来,有学者尝试将环戊烯酮类前列腺素(15-deoxy-A12,14-prostaglandinJ2,15d-PGJz)应用于牙周病合并颌骨缺损患者,利用其与细胞内蛋白亲核基团的Mcichael反应而发挥长期效应,取得了良好的骨代谢调节效果[2]。考虑到牙周疾病的病理机制繁杂而交互,凭借现有医疗技术仅能缓解局部症状,并不能彻底阻断疾病进程[3]。因此,笔者检索了大量研究文献,从分子生物学角度出发,尝试以患者特征性生化或细胞指标表达为基础,采用降维思维分析疾病的可能机制,探索可能涉及的病理生理通路。
1 资料与方法
1.1 一般资料
2016年2月~2019年7月,对长沙医学院73例健康体检居民(健康组)和73例牙周病合并颌骨缺损患者(病例组)进行了对照研究。入组对象对项目内容均知情同意,研究中途无失访,本项目获得长沙医学院医学伦理委员会批准(医伦416)。牙周病诊断标准:参照中华口腔医学会第五届牙周病学专业委员会专家组制定的《重度牙周炎诊断标准及特殊人群牙周病治疗原则的中国专家共识》[4]。颌骨缺损诊断标准:参照影像学检查结果进行判定,牙龈至牙槽嵴顶>2 mm、存在垂直型骨缺损。两组对象共同纳入标准:年龄60岁以下;无吸烟或酗酒行为;初次入院,近60 d未对牙周系统进行规范治疗;无口腔手术史或使用过矫治器者;共同排除标准:伴有糖尿病、骨质疏松症、艾滋病、全身感染、恶性肿瘤或其他自身免疫性疾病的患者;伴有急性上颌窦感染;重要脏器功能不全;依从性差,不能配合规范治疗者。
1.2 基本情况
健康组男性41例,女性32例;文化程度,高中及以下13例、高中以上60例;年龄35~57岁,平均(42.25±10.41)岁;BMI(21.33±1.04)kg/m2。病例组男性44例,女性29例;文化程度,高中及以下17例、高中以上56例;年龄34~59岁,平均(43.01±9.39)岁;BMI(21.52±1.30)kg/m2;病程8~10个月。
1.3 治疗方法
根据《重度牙周炎治疗临床指南(人民军医出版社)》对病例组患者进行保守治疗,给予牙斑清除、抗菌、消炎等常规治疗,同时每天给予15d-PGJ2(北京盛科博源生物科技有限公司,中国,规格型号48T/96T)腹腔注射治疗,剂量200 μg/kg,连续使用14 d。若患者出现严重不良反应则当即停止用药。
1.4 观察指标
两组对象入院时采集一般资料、基本病情,同时取龈沟液进行生长因子含量检测,取空腹状态下静脉全血(10 mL)进行沉淀、分离等处理,进行外周血细胞、牙骨质特异性蛋白、外周血清酶、骨代谢产物含量的检测。根据Bin等[4]报道方法取样龈沟液,快速祛除取样点周边的菌斑或牙石,而后用气枪将牙面吹干,使用Whatman 3号滤纸(Whatman公司,英国)插入牙周袋底部,获取龈沟液标本,若不小心蘸取污染物(唾液或血液)则当即放弃,标本快速低温(-80℃)保存、待检。
1.4.1龈沟液生长因子 采用特异性生长因子检测试剂盒(南京卡米洛生物工程有限公司,中国)进行定量检测,具体包括白细胞介素-1β(interleukin1β,IL-1β)、核因子κB受体活化因子配体(receptor activator of nuclear factor-κ B ligand,RANKL)、白细胞介素-17(interleukin 17,IL-17)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、转化生长因子-β(transforming growth factor-β,TGF-β1)。相关黏附分子1(associated adhesion molecule 1,ICAM-1)表达阳性细胞的评定采用IMAGE-PROPLUS软件进行测定[5]。
1.4.2外周血细胞 采用流式细胞术检测,包括辅助性T细胞17(T helper cell 17,Th17)、调节性T细胞(regulatory cells,Treg)。牙周韧带干细胞(periodontal periodontal ligament stem cells,PDLSCs)取自牙周膜组织,经交替冲洗、培养、分选,最终采用ALP固定和染色,同样采用IMAGE-PROPLUS软件测定[6]。
1.4.3牙骨质特异性蛋白 应用ELISA法定量测定人骨成型蛋白2(human Bone morphogenetic protein 2,BMP-2)、骨质附着蛋白(cementum attachment protein,CAP)、高迁移率蛋白1(high mobility group protein,HMGB1)、几丁质酶3样蛋白(chitinase-3-like-1 protein,YKL-40)。采用Image-pro plus6.0分析系统对免疫组织化学染色后的细胞进行图像分析,获取爬片灰度值,取3个视野(×100)平均值。硬化蛋白(hardening of the protein,SOST)SOST采用染色细胞计数定量表示蛋白含量,染色方法为ABC法,40倍镜下取3个视野进行检测[7]。
1.4.4外周血清酶 使用RNA印迹杂交和蛋白质印迹杂交技术进行检测,包括组织蛋白酶(cathepsin,CTSK)、5-脂氧合酶(5- lipoxygenase,5-LOX)、环氧化酶-2(cyclooxygenase,COX-2)。
1.4.5骨代谢产物 同样应用 ELISA 法定量测定,包括Ⅰ型胶原交联羧基末端肽(car-boxyterminal crosslinked telopeptide of type I colla-gen,ICTP)、Ⅰ型原胶原羧基末端前肽(procollagen type I carboxy-terminal propeptide,PICP)、Ⅰ型胶原交联C端肽(Type I collagen -crosslinked C te-lopeptide,CTX)、Ⅰ型胶原交联N端肽(type icol-lagen-crosslinked N telopeptide,NTX)[8]。
1.5 统计学处理
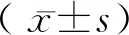
2 结果
2.1 两组特征性生化标记物含量的比较
病例组IL-1β、IL-17、bFGF、YKL-40、BMP-2、ICTP、PICP、CTX高于健康组;病例组RANKL、ICAM-1、TGF-β1、Th17、Treg、PDLSCs、SOST、CAP、HMGB1、CTSK、5-LOX、COX-2、NTX低于健康组;组间差异均有统计学意义(P<0.05)。见表1。
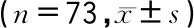
表1 两组特征性生化标记物含量的比较
2.2 病例组15d-PGJ2治疗前后特征性生化标记物含量的比较
治疗后相比治疗前,IL-1β、IL-17、bFGF、YKL-40、BMP-2、ICTP、PICP、CTX明显降低;而RANKL、ICAM-1、TGF-β1、Th17、Treg、PDLSCs、SOST、CAP、HMGB1、CTSK、5-LOX、COX-2、NTX明显升高;差异均有统计学意义(P<0.05)。见表2。
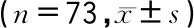
表2 病例组15d-PGJ2治疗前后特征性生化标记物含量的比较
2.3 病例组特征性生化标记物的因子分析
对5组21项特征性生化标记物进行减维处理,因子分析发现,可提取4个公因子(特征值λ大于1),见表3。荷矩阵可知:因子1与4个指标(bFGF、TGF-β1、PDLSCs、5-LOX)相关性有统计学意义(P<0.05);因子2与7个指标(IL-1β、IL-17、Treg、YKL-40、COX-2、ICTP、PICP)相关性有统计学意义(P<0.05);因子3与5个指标(RANKL、SOST、CAP、HMGB1、BMP-2)相关性有统计学意义(P<0.05);因子4与5个指标(ICAM-1、Th17、CTSK、CTX、NTX)相关性有统计学意义(P<0.05)。累积贡献率96.993%。检索已有研究项目,本研究将当前可靠性较高、且流行的主要机制归纳入各公因子,便于后续基础研究的深入。

表3 牙周病导致颌骨缺损主要流行机制与4个公因子的对应关系
3 讨论
牙周病导致颌骨缺损患者兼有两种疾病的病理损伤,临床治疗难度相对较大,考虑到PGs类衍生物在抗炎消肿、免疫平衡、代谢调控等方面的综合优势,充分探究15d-PGJ2药理机制及牵涉的主要信号通路,可为牙周病系统治疗或药物研发提供可靠依据[9]。
本研究发现,健康人群与牙周病导致颌骨缺损患者多种生化指标的表达均有明显差异,由于本研究纳入的21项指标均为研究较为关注的生化标记物或外周血细胞,其组间差异的结果与绝大多数研究[10,11]基本一致。IL-1β和IL-17兼有牙周膜细胞MMPs的强效调节作用,即便微量改变也可以产生放大效应,参与细胞外基质对牙周组织的生理改建过程。15d-PGJ2治疗后的患者,该两项指标明显降低,可能与其作用于病变牙根面而致轻度脱矿,开放的牙本质小管促进了根面上细胞迁移及结缔组织附着有关[12]。但是本研究尚未对局部总蛋白或胶原蛋白的表达进行长期监测,15d-PGJ2提升牙周组织再生功能的效力仍需通过前瞻性研究加以验证。bFGF凭借强大的干细胞分化促进功能可以直接影响牙釉质或牙本质的成熟,理论上而言,bFGF高水平表达会诱导微血管新生,使残存牙乳头不断生长,加快根尖孔闭合[13]。但病例组治疗后血清中bFGF检出水平不增反降,可能与其他机制交叉作用、相互影响有关。也可能与患者治疗过程中局部刺激增加了根管内切力有关,具体原因尚不明确。糖蛋白YKL-40主要由免疫细胞或平滑肌细胞分泌,对组织重塑或纤维化意义重大,高含量的YKL-40会抑制Sema3A/Nrpl信号轴,进行性加重局部炎症反应,该指标还可作为疾病慢性化的评定标准[14]。病例组患者BMP-2含量明显高于健康组,该指标对间充质干细胞的定向分化有决定作用,直观表现为可加速牙槽骨的修复或改建。根据已有骨再生研究[15,16],RANKL/OPG信号途径为介导BMP-2参与牙周缺损区域骨性吸收的主要途径,但对牙骨质附近破骨细胞的影响极小。被激活的BMP-2可通过负反馈调节机制促使成骨细胞发挥旁分泌或自分泌功能,提升张力区成骨细胞的活力。ICTP是判定牙本质黏接界面退化程度的灵敏指标,是由激活状态的MMPs降解而产生的特异物质,因此其表达含量与MMPs呈负性关联。PICP和CTX在病例组、健康组之间的差异可能与人体自酸蚀系统激活,亲水性单体不断渗透而加速胶原降解有关,因此,ICTP、PICP、CTX含量的线性升高可表征患者的病情处于发展期,若患者治疗过程中有使用黏结剂,极易受此影响而导致黏连强度下降[17]。
本研究还发现,病例组多项指标含量高于对照组,而病例组经治疗后,其RANKL、ICAM-1、TGF-β1、Th17、Treg、PDLSCs、SOST、CAP、HMGB1、CTSK、5-LOX、COX-2、NTX明显升高。牙槽骨破坏通常与破骨细胞活性异常有关,RANKL和TGF-β1均是促进相关细胞活化的重要因子,不仅可以触发下游信号转导而使前体细胞转变为破骨细胞,还可以经S-LOX途径来循环加重患者口腔的炎症水平[18]。RANKL还可在两个协同要素(Ca2+和ATP)作用下生成5-LOX或不稳定的环氧化白三烯,患者诊治前后强化RANKL的定量监测有助于保障整体控制患者病情。跨膜糖蛋白ICAMI在人体内主要发挥细胞间黏附作用,在炎性或应激反应中则会招募大量炎性细胞引入靶组织,恶化局部炎症的反应过程[19,20]。COX-2是合成PGE的重要限速酶,其含量与牙周病病情呈正相关,患者无论采取何种治疗方案,控制COX-2对改善临床症状至关重要。同时,15d-PGJ2还是COX-2的终极代谢产物之一,多种组织均能产生,但细胞外液中检出水平往往不高。该内源性配体生理功能较为广泛,本研究虽然证实其疗效的确切性,但不规范使用可能会产生适得其反的效果[21]。众所周知,5-LOX途径也是众多疾病病理过程或炎症反应的主要过程,控制原发炎症的同时,该趋化因子骨代谢方面的影响也不容忽视。有流调数据[22]发现,骨关节炎或类风湿性关节炎患者体内5-LOX的表达尤为异常,当5-LOX酶缺陷时,对应下游产物减少,亦会促使破骨细胞聚集。还有体外实验[23]发现,5-LOX抑制剂能抑制LPS诱导的破骨细胞生成,是调控RANK/RANKL的关键介质,这为5-LOX造成牙周组织破坏的机制奠定了相应的理论基础。分泌型蛋白SOST主要存在于各种成骨微环境中,有正向调控骨形成的功效,利用甲基化抑制剂AzadC可以上调BMP2的同时阻断成骨细胞中的Smadtn号通路、p38MAPK通路、MEKI/2信号通路、JNK信号通路,因此临床使用甲基化抑制剂AzadC需要注意患者是否存在禁忌证,否则极易引发各类不良事件。生理性牙根吸收的过程是骨细胞通过H+和Cl-通道而降低骨吸收陷窝内pH值,最终释放CTSK、MMPs等物质[24]。因此,CTSK活性可以作为牙周炎是否活动的监测指标。牙骨质细胞标记物CAP则是一组在牙骨质中提取,而能显着促进牙周膜细胞实现根面附着的蛋白质。CAP对牙囊细胞的增殖无显着影响,但高浓度的CAP可增强牙囊细胞碱性磷酸酶活性。同时,CAP可能也参与成牙骨质细胞形成的矿化基质的沉积、合成和磷酸盐晶体的形成,对增加牙骨质细胞意义重大。一般情况下,存在于胞核的HMGBI呈基础水平表达,轻度牙周病患者也不一定能检出该物质。但若在龈沟液中高水平表达HMGBI,则提示患者局部致病菌脂多糖含量较高或外界刺激强烈[25]。另外一种情况就是正畸牙移动过程中,典型的张力侧骨沉积或导致压力测骨吸收的加剧,成纤维细胞也会分泌大量的促炎细胞因子促使单核细胞进入受损的牙周膜内,参与牙周膜的坏死成分的清除过程[24,25]。
因子分析发现,牙周病导致颌骨缺损患者在疾病发展或转归过程中,21项研究指标均指示,该病与4项机制(细胞分化或迁移失调、局部炎症或免疫失衡、牙槽骨微结构被破坏、负荷或刺激影响重塑)高度相关,其中细胞分化或迁移失调、局部炎症或免疫失衡为最主要的两项机制,累积贡献率超过60%。本研究还检索了大量类似文献,发现牙周病导致颌骨缺损相关的主要通路共有16项,这些信号通路具体如何作用于疾病进程,不同信号通路是独立作用还是存在叠加、交叉等影响,仍需后续大量研究不断验证。但是因子分析获得的累积贡献率高达96.993%,充分说明本研究所总结的4项机制能总体归纳牙周病导致颌骨缺损的主要病理生理过程。



