胡蓉蓉,马 杰,陶建瓴,文煜冰,赵 翠,张 薇,李 航,李明喜,李雪梅,李学旺中国医学科学院 北京协和医学院 北京协和医院肾内科,北京00730
2沧州市人民医院肾内科,河北沧州061000
糖尿病肾病 (diabetic nephropathy,DN)是我国终末期肾病 (end stage renal disease,ESRD)的第2大原因。DN发病机制复杂,至今尚不完全明确。钙调神经素 (calcineurin,CaN)是一种钙离子敏感的蛋白磷酸激酶,环孢素A能通过抑制CaN,调节足细胞骨架蛋白synatopodin的稳定性[1]。内质网应激 (endoplasmic reticulum stress,ERS)是指细胞内质网未折叠或错误折叠蛋白堆积时引起的细胞应激反应。近来研究显示,内质网应激时CaN活性增加[2]。糖尿病患者体内游离脂肪酸升高,体外细胞实验证明游离脂肪酸,尤其是长链饱和游离脂肪酸——棕榈酸盐能引起ERS[3]。熊去氧胆酸 (ursodeoxycholic acid,UDCA)是内质网应激的化学分子伴侣,体外大鼠肝细胞及糖尿病模型小鼠实验都证明UDCA能降低ERS感应蛋白双链RNA依赖的蛋白质激酶 (double-stranded RNA-dependent protei,PKR)类似的内质网激酶 (PKR-like ER kinase,PERK)和肌醇依赖酶1α(inositol-requiring enzyme 1α,IRE-1α)的磷酸化,抑制ERS依赖的JNK凋亡途径,缓解ERS引起的损伤,故常被用作ERS的阻断剂。本课题组前期工作发现早期DN中足细胞存在ERS,本研究观察了早期DN时足细胞ERS对CaN表达的调控情况,以期明确ERS状态下足细胞CaN的变化,为寻找以调节ERS来阻断早期DN进展的临床治疗决策提供进一步理论依据。
材料和方法
实验动物雄性C57BLKS/JLeprdb/db和C57BLKS/JLeprdb/m小鼠,购于南京大学模式动物研究所。
足细胞培养足细胞在33℃,含10%胚牛血清(BSA)、青霉素/链霉素 (Gibco,英国)和干扰素Υ(R&D,美国)的RPMI-1640培养液中生长,37℃无干扰素Υ培养液中分化。所有实验细胞均分化14 d。
棕榈酸盐溶液配制BSA溶解于双蒸水配成5%(质量/体积)的溶液并过滤,100mmol/L棕榈酸盐(Sigma,美国)在60℃ 0.1mmol/L氢氧化钠溶液中溶解并过滤,用5%BSA稀释至5mmol/L。溶液冷却至室温,4℃冰箱保存。将5mmol/L棕榈酸盐/5%BSA溶液与无血清培养液按不同比例混合,其中1mmol/L棕榈酸盐为最大浓度组。棕榈酸盐组的对照是1%BSA。
共聚焦显微镜显像4%多聚甲醛固定后,用含1%BSA的磷酸溶液缓冲液 (PBS)封闭足细胞,1∶25(体积比)稀释度的兔抗鼠钙调神经素多克隆抗体(抗CaN)(Cell signaling,美国)孵育,再用FITC结合羊抗兔多克隆抗体 (北京中杉金桥生物技术有限公司)孵育后PBS清洗,DAPI标记细胞核后,共聚焦显微镜下观察。
蛋白印迹法冰PBS清洗分化足细胞后,用RIPA裂解液裂解,100℃变性5min。用12%SDS聚乙烯酰胺凝胶电泳后,将蛋白电转至聚偏二氟乙烯膜(polyvinylidencefluoride,PVDF),将膜在抗 CaN和抗GAPDH(Abcam,英国)单抗中孵育,再用二抗杂交,ECL显影。
实时荧光定量逆转录多聚酶链反应定量分析转录子用TRIzol(Invitrogen,美国)提取足细胞RNAs,并反转录成cDNA作为PCR模板,采用iQ5循环变温加热器 (BioRad,美国)进行实时荧光PCR。试验中所用的引物设计如下:(1)Calcineurin:Forward:5’-GATGCTGG TCAATGTTCTC-3’;Reverse:5’-CAGGACACTCTCACTCTC-3’。(2)β-actin:Forward:5’-CTCTC CCTCACGCCATCC-3’;Reverse:5’-CTCTCCCTCACGC CATCC-3’。
统计学处理采用SPSS 16.0统计软件,所有数据以均数±标准差表示,采用方差齐性分析,正态分布数据差异显着性检验采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
早期DN小鼠模型中足细胞CaN的表达6、9、12周db/m小鼠的24h尿白蛋白水平分别为 (1.5977±1.8720)、(5.4114±5.2605)、 (1.1231±0.4286)μg,db/db小鼠分别为 (30.7268±7.7615)、(196.0933±79.8682)、(185.4407±111.6092)μg,其中,db/db小鼠的24h尿白蛋白水平均明显高于同周龄的db/m小鼠(P均<0.001),9、12周龄db/db小鼠的24h尿白蛋白水平均明显高于6周龄db/db小鼠 (P均<0.01)。
选取6、9、12周龄24h尿白蛋白量分别为31.98、143.91、315.49μg的db/db小鼠和6、9、12周龄24h尿白蛋白量分别为1.52、2.35、0.24μg的db/m小鼠进一步观察CaN及synaptopodin表达情况,激光共聚焦显微镜下可见小鼠肾组织中CaN蛋白分布与synaptopodin相似,且同周龄db/db小鼠的CaN表达高于db/m小鼠。CaN在db/db小鼠足细胞中的表达随尿白蛋白量的增加而增强 (图1)。
体外培养小鼠足细胞在不同浓度棕榈酸盐作用下CaN的表达将足细胞在0.25和0.50 mmol/L棕榈酸盐培养液中孵育3h后,CaN mRNA相对表达量分别为1.17±0.20和1.52±0.45,明显高于BSA培养液的0.96±0.09(P均<0.05)。
激光共聚焦显微镜观察棕榈酸盐和UDCA共同作用下体外足细胞CaN的表达以1%BSA为对照组,将分化的足细胞分别在0.25 mmol/L棕榈酸盐、0.25 mmol/L棕榈酸盐 +0.01 mmol/L UDCA、0.01 mmol/L UDCA继续培养3 h,激光共聚焦显微镜下观察发现,棕榈酸盐作用下足细胞CaN蛋白的表达增强,棕榈酸盐联用UDCA作用下的足细胞CaN表达减弱 (图2)。对每个标记CaN的免疫荧光标本观察20个完整细胞,比较足细胞CaN免疫荧光强度,结果显示1%BSA对照组、0.25 mmol/L棕榈酸盐组、0.25 mmol/L棕榈酸盐+0.01 mmol/L UDCA组和0.01 mmol/L UDCA组的免疫荧光强度分别为(243.44±26.87)、(326.74±41.18)、(249.05±40.96)和 (215.19±25.28)I/μm2,其中,0.25 mmol/L棕榈酸盐组明显高于1%BSA对照组 (P<0.05),0.25 mmol/L棕榈酸盐+0.01 mmol/L UDCA组明显低于0.25 mmol/L棕榈酸盐组 (P<0.05),0.01 mmol/L UDCA组明显低于1%BSA对照组 (P<0.05)。

图1 小鼠肾小球激光共聚焦图像 (40×10×2.5)Fig 1 Confocal microscopy of mice glomeruli(40×10×2.5)
蛋白印迹法检测棕榈酸盐及UDCA作用下体外足细胞CaN的表达蛋白印迹法对不同刺激下足细胞CaN mRNA表达的检测结果显示,棕榈酸盐作用组CaN的表达较BSA组升高,而棕榈酸盐加UDCA组CaN的表达较棕榈酸盐作用组降低 (图3)。
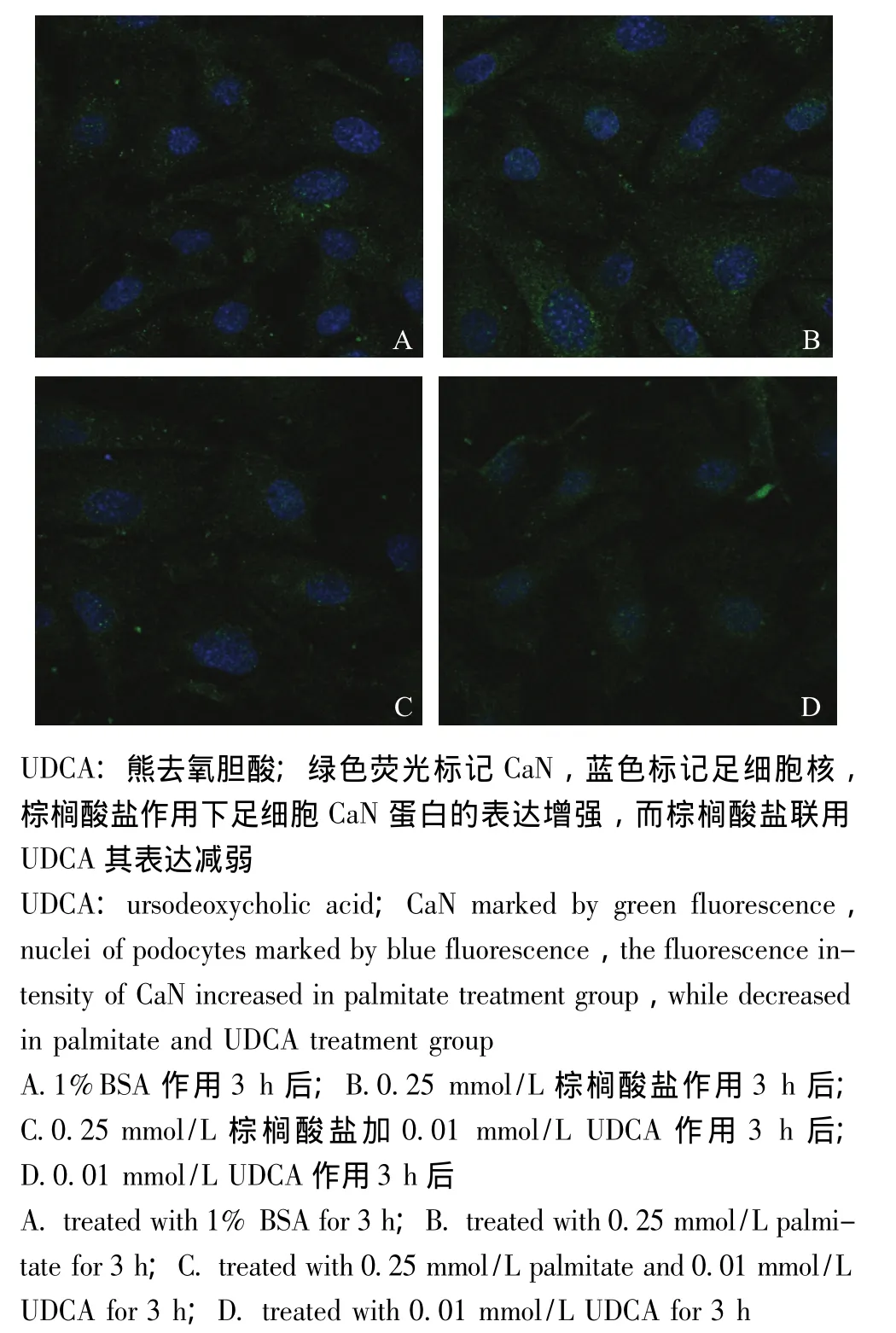
图2 小鼠足细胞CaN标记的激光共聚焦图像 (40×10×2.5)Fig 2 Confocal microscopy of CaN in immortalized mouse podocytes(40×10×2.5)
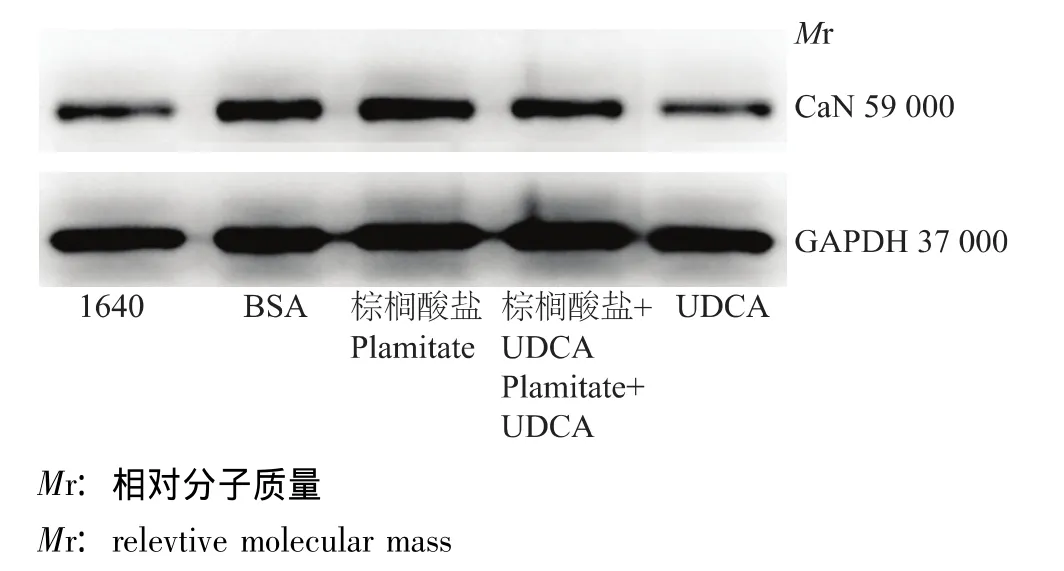
图3 不同刺激物作用下足细胞CaN表达的蛋白免疫印迹结果Fig 3 Western blotting of CaN in podocytes treated with different stimulants
讨 论
CaN是一种丝氨酸/苏氨酸特异的蛋白磷酸酶,由相对分子质量为59 000的催化亚单位A(CNA)和19 000的调节亚单位B(CNB)组成,CNA具有磷酸酶单位,CNB能结合钙离子和CNA,CaN通过CaM感受细胞内Ca2+的浓度调节自身活性,发挥作用。在阿尔茨海默病等神经系统疾病中,蛋白错误折叠及堆积引起的ERS是其常见且典型的病理生理特点,而且很可能是致病的启动因子[4-5],这些疾病中存在CaN活性的增加[6-7]。2010年,国内有报道ERS诱导剂毒胡萝卜素 (thapsigargin,TG)作用大鼠新生心肌细胞时,存在心肌细胞肥大,细胞内Ca2+上升,CaN表达上调,加用环孢素A能抑制心肌肥大[2]。目前尚没有研究观察DN时足细胞中CaN表达的变化情况。本研究通过对早期DN小鼠模型足细胞的观察,发现早期DN小鼠中存在足细胞CaN表达的升高。
Chen等[8]研究发现,大鼠心肌缺血/再灌注损伤中,网钙蛋白、CHOP及半胱天冬酶-12等ER分子伴侣表达升高,且CaN的表达也升高,缺血/再灌注损伤上调CaN表达并强化了ERS引起的损伤。本课题组前期研究发现,随着尿蛋白量的增加,ERS的标志蛋白GRP78在db/db小鼠足细胞的表达增强。本研究对同一小鼠模型肾小球CaN表达进行激光共聚焦显像观察发现,CaN表达的变化与GRP78一致,并由此推测足细胞ESR时伴有CaN表达上调。
本课题组前期研究及文献报道发现足细胞在棕榈酸盐刺激下产生ERS[9]。本研究进一步探究ERS时CaN表达的变化情况,以棕榈酸盐刺激3h的足细胞为观察对象,在激光共聚焦显微镜下观察到足细胞CaN表达升高;而Real-Time PCR CaN mRNA水平的半定量分析发现,随着棕榈酸盐刺激浓度的增加,CaN mRNA水平也增加。
2002年Xie等[10]在人体肝脏细胞系 (Huh 7)中研究发现,牛磺熊去氧胆酸 (taurousodeoxycholic acid,TUDCA)具有抑制ER内Ca2+外流,激活ERS标志蛋白GRP78及凋亡前因子caspase-12的作用,故被作为ER化学分子伴侣的抑制剂,并用于抑制ERS的比较研究,UDCA和TUDCA降低GRP78的作用程度相似。2006年,Ozcan等[11]在体内研究发现,db/db小鼠口服摄入TUDCA能明显使血糖正常化,并改善组织对胰岛素的反应。进一步研究显示,TUDCA处理小鼠的PERK和IRE-1α磷酸化及JNK的活化被抑制,而同时对胰岛素受体信号具有反向调节作用的胰岛素受体信号-1也被抑制,胰岛素受体信号能力有明显恢复。此外,在db/db小鼠心肌细胞的研究发现,TUDCA能缓解FFA/ERS引小的心肌收缩功能障碍[12]。故本研究设计了棕榈酸盐联合UDCA作用的细胞组,激光共聚焦和蛋白免疫印迹检测均发现在棕榈酸盐联用UDCA与单用棕榈酸盐相比,CaN的表达减低。结合UDCA在胰岛素抵抗及ERS中的作用,推测在足细胞中,通过抑制ERS可以减弱CaN的表达。
Faul等[1]研究发现,环孢素A的抗尿蛋白作用主要是通过直接抑制足细胞钙神经蛋白介导synaptopodin的去磷酸化,稳定细胞骨架结构、促进足细胞修复实现的。在小鼠肾脏冰冻切片激光共聚焦试验中,应用synaptopodin绿色荧光标记足细胞,红色荧光显示CaN,激光共聚焦三通道同时摄像观察,能较客观地分析功能蛋白的形态学分布,比较其表达变化。本研究观察发现,在db/db小鼠肾组织,随尿蛋白量的增加,CaN的表达也增强,6周龄db/db小鼠肾小球内分布的CaN与同周龄db/m小鼠无明显差别,但9周龄db/db小鼠的CaN较同周龄db/m小鼠有明显增加,并且这个信号的增强在12周龄时呈递增趋势;而synaptopodin的表达强度在6周龄db/db小鼠中与正常小鼠相似,9周龄和12周龄db/db小鼠均较正常小鼠减弱,两者差别不明显。
与在肝细胞、心肌细胞等得到的结果类似,本研究在足细胞中发现,通过UDCA阻断ERS时,CaN表达上调被抑制,这点提示或许在早期DN的治疗中可以使用UDCA,通过缓解ERS而得到阻断早期DN进展的临床期望。该点尚需要更多基础和临床深入研究以得到明确和证实。
[1]Faul C,Donnelly FC,Merscher-Gomez S,et al.The actin cytoskeleton of kidney podocytes is a direct target of the antiproteinuric effect of cyclosporin A [J].Nat Med,2008,14(9):931-938.
[2]Zhang ZY,Liu XH,Hu WC,et al.The calcineurin-myocyte enhancer factor 2c pathway mediates cardiac hypertrophy induced by endoplasmic reticulum stress in neonatal rat cardiomyocytes [J].Am J Physiol Heart Circ Physiol,2010,298(5):H1499-H1509.
[3]Kyle T,Christopher L,Angela M,et al.Linking endoplasmic reticulum stress to cell death in hepatocytes:roles of C/EB Phomologous protein and chemical chaperones in palmitatemediated cell death [J].Am J Physiol Endocrinol Metab,2010,298(5):E1027-E1035.
[4]Soto C.Unfolding the role of protein misfolding in neurodegenerative diseases[J].Nat Rev Neurosci,2003,4(1):49-60.
[5]Chiti F,Dobson CM.Protein misfolding,functional amyloid,and human disease[J].Annu Rev Biochem,2006,75:333-366.
[6]Lindholm D,Wootz H,Korhonen L.ER stress and neurodegenerative diseases[J].Cell Death Differ,2006,13(3):385-392.
[7]Hetz CA,Soto C.Stressing out the ER:a role of the unfolded protein response in prion-related disorders [J].Curr Mol Med,2006,6(1):37-43.
[8]Chen YH,Wu XD,Yao ST,et al.Calcineurin is involved in cardioprotection induced by ischemic postconditioning through attenuating endoplasmic reticulum stress [J].Chin Med J,2011,124(20):3334-3340.
[9]Tao JL,Wen YB,Shi BY,et al.Endoplasmic reticulum stress is involved in podocyte apoptosis induced by saturated fatty acid palmitate [J].Chin Med J,2012,125(17):3137-3142.
[10]Xie Q,Khaoustov VI,Chung CC,et al.Effect of tauroursodeoxycholic acid on endoplasmic reticulum stress-induced caspase-12 activation [J].Hepatology,2002,36(3):592-601.
[11]Ozcan U,Yilmaz E,Ozcan L,et al.Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes[J].Science,2006,313(5790):1137-1140.
[12]Ceylan-Isik AF,Sreejayan N,Ren J.Endoplasmic reticulum chaperon tauroursodeoxycholic acid alleviates obesity-induced myocardial contractile dysfunction [J].J Mole Cell Cardiol,2011,50(1):107-116.



