秦 菊 江 滨 周春根
复杂性肛瘘是指术后易导致肛门失禁的肛瘘,包括瘘管穿越肛门外括约肌30%以上的肛瘘(高位括约肌间肛瘘、括约肌上肛瘘和括约肌外肛瘘)、女性前侧肛瘘以及复发性肛瘘或先前存在大便失禁的肛瘘,炎症性肠病或放射引起的肛瘘等[1]。手术干预是临床主要治疗方式,治疗关键在于消除内口及与内口相通的瘘管,最大可能减少对肛门括约肌损伤。但由于内口位置及瘘管走行与括约肌关系复杂,切开挂线等传统手术创面大、恢复慢,术后患者生活质量下降,肛门功能常易受影响,肛门失禁率发生较高。因此在尽可能减少创伤、保护肛门功能的前提下,提高复杂性肛瘘治愈率既是临床治疗复杂性肛瘘的难点。
脂肪间充质干细胞(adipose-derived stem cells,ADSCs)是从脂肪组织中分离提取而得到的一种具有自我更新及多向分化潜能的间充质干细胞,具有组织再生与修复、抑制炎性反应及免疫调节等功能。与骨髓、脐带等其他来源的间充质干细胞比较,ADSCs来源广泛、取材简便、可塑性强,免疫原性更低[2]。目前已广泛应用于退行性疾病、组织修复与重建、免疫系统等相关疾病的预防和治疗[3,4]。江滨等[5]将ADSCs用于复杂性肛瘘的治疗,其安全性和有效性均得到了证实。然而其作用机制仍不明确,因此,本文对ADSCs治疗复杂性肛瘘的机制进行探讨,详见图1。
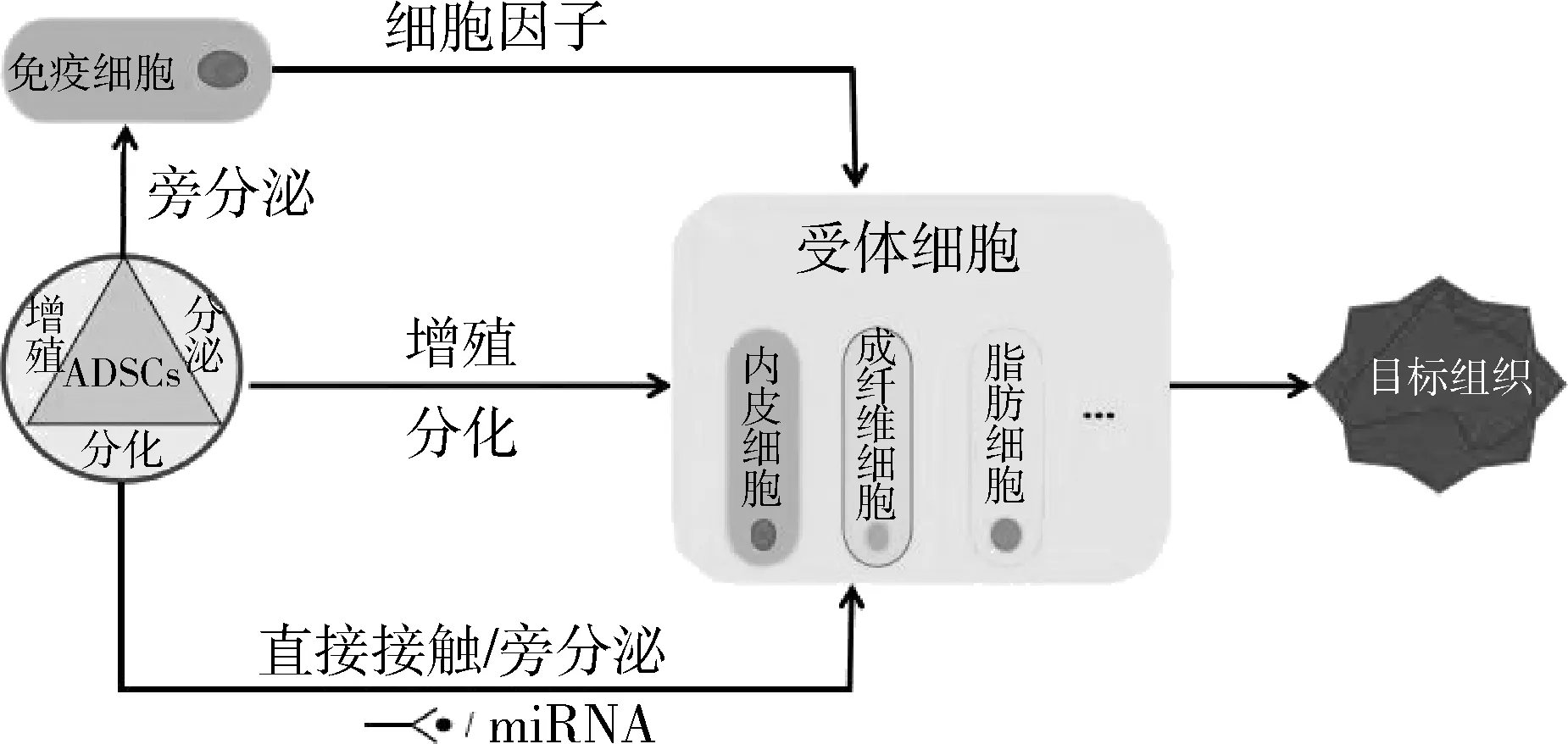
图1 ADSCs治疗复杂性肛瘘的可能机制
一、ADSCs生物学特性
1.增殖:ADSCs是一种多能干细胞,具有很强的增殖能力。研究发现,ADSCs在体外培养的2~5天增殖迅速,呈对数式增殖,且增殖速度较其他间充质干细胞更快,经100代增殖扩增后仍能保持正常的二倍体核型,性质仍能保持相对稳定[6]。与骨髓、脐带等其他来源间充质干细胞比较,ADSCs能更长时间在体外维持其生物学特性。因此,增殖迅速、体外活性持久可能是ADSCs发挥治疗作用的前提和基础。
2.分化:ADSCs具有干细胞所共有的“干性”,能在不同的诱导条件下分化成多种细胞,如脂肪细胞、骨细胞、神经细胞、心肌细胞及成纤维细胞等。目前国内已广泛将其应用于免疫系统疾病及损伤、烧伤等创伤修复性疾病的治疗[7]。目前有研究认为,ADSCs到达肛瘘创面后,在创面组织特定微环境诱导下,通过增殖分化发育为相应组织类型的功能细胞,而促进创面愈合,恢复肛门功能。但ADSCs能否直接分化替代受损细胞却存在争议,还需进一步研究探索。相关试验研究发现,ADSCs移植治疗兔肛瘘模型,愈合后的肛门组织充满了脂肪细胞及新生毛囊腺[8]。
3.分泌:ADSCs具有自分泌、旁分泌和远程分泌等分泌功能,能在不同的诱导条件下分泌不同的细胞因子[9]。其中,与促进创面愈合相关的因子主要包括:免疫调节因子(如PEG、HGF、IDO),抗凋亡相关因子(如VEGF、CSF、TGF),血管生成因子(如VEGF、IGF、bFGF),细胞生长因子(如IL-6、SCF、LIF、angiopoietin1)及趋化因子(如CCL famliy chemokines、CXCL famliy chemokines)等[10]。
除分泌上述细胞因子外,ADSCs亦能分泌脂肪干细胞外泌体(adipose-derived stem cells exosome,ADSCs-exos)。目前研究发现ADSCs-exos与其来源干细胞有类似的生理功能,更有研究认为干细胞移植的治疗作用更多是通过外泌体而发挥作用[11]。相关研究证明,体内和体外培养的ADSCs都能通过主动或被动的方式分泌外泌体,大小为30~150nm,富含与修复再生功能相关的脂类、蛋白质、mRNA、miRNA 及多种生长因子[12, 13]。现有研究认为ADSCs的分泌功能是其发挥治疗作用的主要机制之一,而ADSCs-exos可能是其发挥作用的主要介质。
二、ADSCs治疗复杂性肛瘘的机制
1.降低炎性反应:过度的创面炎性反应可延缓肛瘘创面的愈合,因此减轻炎性反应是促进复杂性肛瘘创面愈合的重要一环。目前相关研究已证实,ADSCs能显着降低创面组织中IL-1、IL-6、IL-8、IL -17、IFN-γ和TNF-α等促炎性细胞因子的水平,并能同时增加抗炎性细胞因子IL-3、IL-4、IL-5、IL-10等的表达,通过改变免疫细胞的细胞因子谱,调控免疫细胞的增殖活化从而减轻创面炎性反应,其机制可能与抑制COX-2、PGE2、NF-κB等多种信号通路的活化相关[14,15]。同时,ADSCs通过分泌免疫相关因子,直接作用于免疫细胞而进一步调控免疫炎性反应。如:ADSCs通过分泌PGE2、IDO和s HLA-G5等固有性免疫抑制因子可直接抑制NK细胞的活化;分泌肿瘤坏死因子α刺激基因-6(TSG-6) 可诱导巨噬细胞表型由M1型(促炎型)转变为M2型(抗炎型)。相关研究发现,M2 型巨噬细胞不仅可分泌IL-10下调炎性反应,同时亦可诱导STAT3 或其他转录因子募集而调节血管生成及组织重塑[16]。
此外,ADSCs-exos对降低炎性反应亦具有重要作用。研究发现,ADSCs-exos可诱导巨噬细胞由M1型向M2型的转化,其具体作用机制可能是通过自身携带的miRNA影响巨噬细胞表面的Toll样受体4的合成而实现的[17]。另有研究发现,ADSCs-exos可通过保护血管屏障的完整性,阻止炎性细胞与内皮细胞结合,从而调节受损内皮细胞的炎性反应[18]。另外,ADSCs-exos亦可通过高表达Nrf2而降低 IL-1β、IL-6 和 TNF-α等炎性细胞因子水平,而降低创面的炎性反应[19]。
2.免疫调节:ADSCs及ADSCs-exos均具有免疫调节作用。ADSCs通过受体-配体相互作用的方式,与T淋巴细胞、B淋巴细胞等特异性免疫细胞及巨噬细胞(Mφs)、NK细胞、和树突状细胞(DC)等髓系细胞直接接触,如阻断T淋巴细胞周期、抑制B淋巴细胞的增殖和分化、影响DC细胞功能,而进一步影响免疫功能[20]。其主要机制可能与Notch、ERK、MAPK等相关信号转导通路的活化有关[21,22]。此外,ADSCs通过分泌与免疫调节相关的细胞因子,如IL-10、TGF-β、PGE2和NO等,通过影响免疫细胞活化性受体的表达对免疫细胞进行调控[23]。如:ADSCs分泌TGF-β3和TSP1可促进M2Mφs极化。同时,ADSCs-exos miR-223又能够靶向pknox1调节Mφs极化,从而共同实现免疫调节[24]。故目前有研究认为,间充质干细胞的免疫调节功能主要是通过产生的可溶性因子及其对免疫细胞的旁分泌作用来实现。
3.促进血管新生:创面局部充足的循环灌注是复杂性肛瘘愈合的必要条件,可促进细胞生长和肉芽组织形成,而充足的循环灌注受微血管数量及微血管功能影响。相关研究认为,ADSCs可直接分化为血管内皮细胞(EC)或通过分泌血管源性生成因子(VEGF、HGF、bFGF、FGF2、TGF-β3)直接诱导EC增殖,促进创面肉芽组织生长和毛细血管网形成,而改善创面血供,促进肛瘘修复[25];此外,ADSCs通过分泌产生的各类信号因子,如IL、IFN、TNF、CSF、细胞生长因子、趋化因子等调节和改善创面局部微环境,为创面组织和血管的增殖和生长创造适宜微环境[26]。
另外,ADSCs-exos在血管形成过程中具有重要作用。相关研究发现,ADSCs-exos所包含的相关蛋白或RNA可直接调控创面组织细胞基因的表达来诱导EC的增殖,如:ADSCs-exos所携带的miR-126、miR-130a和miR-132等miRNA与血管的形成密切相关[13,27]。研究证实,ADSCs-exos携带的miR-125a可靶向血管生成抑制因子DLL4的3′非翻译区,或促进内皮间细胞形成,抑制DLL4表达,促进创面修复过程中的血管生成[28]。Li等[29]研究发现,ADSCs-exos可通过lncRNA H19/miR-152-3p/PTEN轴作用,使成纤维细胞中高表达miR-152-3p,低表达lncRNA H19和PTEN,并同时激活磷脂酰肌醇-4,5-二磷酸三激酶(PI3K)/蛋白激酶 B(Akt1)信号通路,减少细胞凋亡,促进创面修复。Wang等[30]研究发现ADSCs-exos可增加成纤维细胞基质金属蛋白酶-3(MMP3)的表达,调控Ⅰ/Ⅲ型胶原和弹性蛋白的形成比例,促进创面愈合,同时并可抑制创面瘢痕形成,其作用机制可能与 ERK/MAPK 通路的活化相关。促进复杂性肛瘘创面愈合的同时减少瘢痕组织的形成,是ADSCs治疗复杂性肛瘘的一大亮点和优势,而其具体作用机制仍待进一步研究明确。
三、展 望
近年来,ADSCs的安全性和有效性在临床上均已被肯定,其具有干细胞强大的自我增殖更新、多向分化潜能及分泌功能,且来源广泛、储量丰富、易获得,具有广阔的临床应用前景。目前研究认为ADSCs治疗复杂性肛瘘可能是基于ADSCs的增殖、分化及分泌功能,从而进一步发挥抗炎、免疫调节和促进血管新生等相关作用,最终实现肛瘘创面的愈合。目前,ADSCs的免疫调节作用是研究的热点,被认为是其发挥治疗作用的主要机制之一,同时ADSCs的分泌功能被认为是发挥治疗作用的主要功能基础,而干细胞治疗复杂性肛瘘尚处于研究发展阶段,ADSCs治疗复杂性肛瘘的具体作用机制及成分尚不明确,有待于进一步研究和探索。



