周士源
·论着·
肝功能异常的血液病患者行微移植的临床观察
周士源
目的 探索肝功能异常的恶性血液病患者进行微移植的安全性,以及肝功能异常对微移植疗效可能的影响。方法 入组患者共28例,微移植前肝功能异常者12例,对照组16例。所有病例均依据其原发病进行相应方案的预处理,接受亲缘HLA 5/10相合微移植。治疗中监测肝功能异常发生情况、造血恢复情况及原发病缓解情况。结果 微移植前肝功能异常者在后续治疗中更倾向于发生肝功能异常,且总体肝功能异常持续时间较对照组长。微移植前肝功能异常者中性粒细胞和血小板的恢复的时间较对照无显着差异。微移植前原发病未完全缓解是治疗后未获完全缓解的危险因素(OR=22.500, 95%CI.[2.031~249.239], P=0.011)。结论 微移植前肝功能异常在后续治疗中更易发生肝功能异常,但不影响微移植过程中造血的恢复,也不是原发病未缓解的危险因素。
肝功能异常;恶性血液病;微移植;临床观察
造血干细胞微移植是近年来报道的对恶性血液病具有一定疗效的治疗方法[1]。该疗法主要是采用非清髓性的预处理方案对受者进行预处理以尽可能的杀灭白血病和肿瘤细胞,随后输注HLA相合、半相合甚至是不相合的供者动员后的外周造血细胞,以形成供者微量嵌合、诱导移植物抗白血病/肿瘤效应(GVL/T)和/或受者抗白血病/肿瘤效应(RVL/T)[2]。
肝功能异常是恶性血液病患者常见的合并症,严重的肝功能异常可导致凝血功能异常、消化道出血、肝性脑病等危及生命的并发症。本研究对合并肝功能异常的恶性血液病患者行微移植治疗进行临床观察。
1 资料和方法
1.1 病例及治疗策略
入组病例共28例。所有病例均依据其原发病进行相应方案的预处理,接受亲缘HLA 5/10相合微移植。在预处理结束后的24~72小时内回输动员的供者外周血造血干细胞。预处理过程中予以还原型谷胱甘肽、复方甘草酸苷预防药物性肝损害,治疗过程中出现转氨酶异常者按药物性肝损害予以保肝处理,出现胆红素升高者加用熊去氧胆酸、多烯磷脂酰胆碱治疗。
1.2 临床定义
肝功能异常定义为:ALT>40 U/L、AST>35 U/L、TBIL>22.00 µmol/L、DBIL>10.20 µmol/L,以上各临界值均为我院实验室参考范围高限,其中任意一项超过临界值即判定为发生肝功能异常。急性白血病完全缓解(CR)定义为结束随访时骨髓检查原粒/原淋细胞≤5%,骨髓增生异常综合征的患者同时要求所有细胞系成熟正常[3],否则为未获完全缓解。
1.3 数据分析
使用SPSS 20.0进行数据统计。分类变量采用χ2检验,服从正态分布的连续变量采用t检验,不服从正态分布的连续变量采用非参数检验。因素分析采用logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 病例特征
28例患者中12例为微移植前肝功能异常组(观察组),16例在微移植前未发生肝功能异常(对照组)。微移植治疗前未获完全缓解共9例,治疗结束后共6例未获完全缓解,死亡0例。基线分析提示,纳入统计的观察组与对照组在年龄、年龄、原发病、微移植前化疗疗程、原发病缓解状态、供受者性别、血型相合情况、微移植均次回输单个细胞(MNC)剂量、CD34+细胞剂量等特征上无显着差异。
2.2 微移植前后肝功能异常的情况
观察组在后续治疗中更倾向于发生肝功能异常,观察组与对照组发生肝功能异常的情况见表1。
2.3 微移植期间中性粒细胞和血小板的恢复情况
微移植前肝功能异常不影响微移植期间中性粒细胞和血小板的恢复。观察组与对照组在各疗程中粒细胞和血小板恢复的时间无显着差异。第1、2、3疗程中,观察组粒细胞恢复的中位时间分别为14、14.5、13天,对照组为11.5、13、12天;血小板恢复的中位时间为14、14.5、15天,对照组为13.5、13、14天。以上差异均无统计学意义。

表1 微移植前肝功能异常组在第二、三疗程微移植中肝功能异常及其持续时间
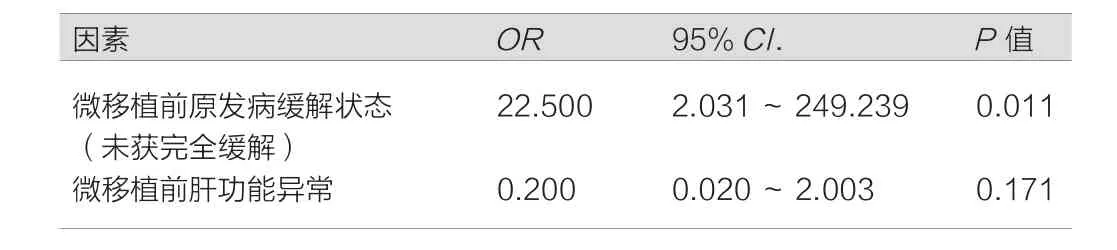
表2 原发病未获完全缓解的危险因素
2.4 微移植后疾病缓解情况
第一疗程微移植前肝功能异常不是微移植后原发病未获完全缓解的危险因素。将年龄、性别、微移植前化疗疗程、微移植前原发病缓解状态、供受者性别、供受者血型、HBcAb情况、微移植均疗程阿糖胞苷剂量、均次回输MNC剂量、CD34+细胞剂量及第一疗程微移植前肝功能异常分别纳入,分析原发病未获完全缓解的危险因素(表2)。结果提示只有微移植前原发病未完全缓解是其危险因素,而第一疗程微移植前肝功能异常不是微移植后疾病未缓解的危险因素。
3 讨论
本研究结果提示,观察组在微移植治疗过程中更倾向于发生肝功能异常,且持续时间更长。第一疗程前肝功能异常是后续治疗中发生肝功能异常的危险因素。但肝功能异常并不影响微移植期间粒细胞和血小板的恢复。
观察组在微移植治疗期间更易发生肝功能异常,且观察组肝功能异常的持续时间较对照组长。有研究指出,合并HBV感染者在化疗后发生肝功能异常的几率高于对照[4]。故慢性乙型肝炎的患者进行微移植治疗应密切监测。
在微移植后造血恢复方面,观察组并未显示出明显的血象恢复延迟。既往报道也曾指出合并HBV感染的恶性血液病患者化疗后虽肝功能异常几率明显升高,但白细胞恢复时间与对照组无明显差异[4]。因素分析表明,微移植前肝功能异常不是微移植治疗后原发病未获缓解的危险因素,而治疗前原发病未缓解则是其危险因素。这提示移植前肝功能异常并不影响微移植治疗的疗效。
综上所述,恶性血液病患者合并肝功能异常不是进行微移植治疗的禁忌证。虽然该组患者在后续治疗期间发生肝功能异常的几率升高,但经积极治疗肝功能多可恢复。同时,肝功能异常不影响微移植过程中造血的恢复,也不影响微移植的疗效。
[1]Guo M,Hu KX,Yu CL,et al.Infusion of HLA-mismatched peripheral blood stem cells improves the outcome of chemotherapy for acute myeloid leukemia in elderly patients[J].Blood,2011(117):936-941.
[2]艾辉胜,孙琪云.《微移植治疗完全缓解期中青年急性髓细胞白血病的长期随访》解读[J].临床血液学杂志,2015(3):367-369.
[3]中华医学会血液学分会.骨髓增生异常综合征诊断与治疗中国专家共识(2014年版)[J].中华血液学杂志,2014(35):1042-1048.
[4]朱卫国.乙型肝炎病毒对白血病化疗的影响[J].浙江实用医学,2004(3):179.
Clinical Observation of Microtransplantation Treatment for Hematologic Malignancies With Abnormal Liver Function
ZHOU Shiyuan, Department of Hematology, the First Hospital Affliated to Soochow University, Suzhou 215006, China
Objective To explore the security of microtransplantation treatment for hematologic malignancies with abnormalities of liver function and the impact of hepatic dysfunction to effcacy of microtransplantation.Methods A group of 28 patients were enrolled in this study, 12 patients were with abnormal liver function and 16 patients were as control group. They received pretreatment according to their malignancies respectively. The mobilized stem cells of HLA 5/10 matched donors were transfused to the patients within 24 to 72 hours after the pretreatment. The liver function, hematopoietic reconstitution and the remission of the malignancies were monitored during the treatment. Results More events of abnormalities of liver function were observed during the microtransplant treatment in patients with abnormal liver function before microtransplantation compared with the controls. And these patients were found to suffer from longer period of liver dysfunction than the controls. However, the neutrophils and platelets reconstitution were found no signifcant difference in the two groups. Risk analysis indicated that the only risk factor for no complete remission after microtransplantation was not achieving complete remission before microtransplantation (OR=22.500, 95%CI. [2.031~249.239], P=0.011). Conclusion Abnormalities of liver function during microtransplantation tend to occur more in patients with abnormal liver function pre-microtransplantation, but the hematopoiesis is not impacted. Abnormality of liver function is not the risk factor of no complete remission of the primary malignancies.
Liver dysfunction, Hematologic malignancy, Microtransplantation, Clinical observation
R552
A
1674-9308(2015)30-0064-02
10.3969/j.issn.1674-9308.2015.30.046
215006苏州,苏州大学附属第一医院血液内科



