瑞雪 刘志
乳腺癌已成为当前社会的重大公共卫生问题之一,外科手术在乳腺癌的诊断、分期和综合治疗中发挥着重要的作用[1]。随着全社会乳腺癌筛查工作的不断普及,使其早期发现率得以提高,为及早治疗提供了条件,使患者的生活质量和中位生存期得以极大的提高和延长[2]。但是,术后肿瘤的复发转移常常导致治疗的失败,严重威胁患者的生命安全。近年来,随着基因芯片技术和分子生物技术的成熟,分子分型逐渐进入学者的视线。在2011年国际乳腺癌会议上,乳腺癌的分子分型与患者的预后相关性得到了专家组的广泛认可[3]。为了了解不同分子分型乳腺癌患者术后复发转移风险差异以及其时间分布情况,笔者对275例乳腺癌患者的临床资料进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取我院2005年1月—2013年1月收治的275例乳腺癌患者作为研究对象。纳入标准:所有患者首诊年龄为32~67岁。均经过病理活检确诊为乳腺癌,均在我院行乳腺癌根治或改良根治术、保乳术等,且临床资料均完整。排除首诊时已发生远处转移的患者。
1.2 方法
收集资料:由2名资料收集员分别对患者的临床资料进行完整收集,相互核实补充。资料内容包括:(1)基本信息。首诊年龄、是否绝经、有无家族史。(2)疾病情况。肿瘤直径(cm)、原发灶(T)分期、淋巴结(N)分期以及雌激素受体(estrogen receptor,ER)、孕激素受体(progestrone receptor,PR)、人类表皮生长因子受体-2(human epidermal growth factor receptor 2,HER-2)的表达情况。(3)手术相关情况。手术治疗方式、术后是否进行放射治疗及化学治疗。(4)术后复发转移情况。术后是否发生复发转移以及发生的时间。定期通过电话对患者进行随访。随访时间从患者手术当日到发生复发转移为止。末次随访时间为2015年12月30日。以患者死亡或随访结束时未发生术后复发转移作为随访截止点。
1.3 统计学方法
采用SPSS20.0软件对数据进行统计分析处理,用寿命表法评估患者未复发转移生存率以及发生复发转移的风险,组间比较采用log-rank检验。计数资料以(n,%)表示,采用χ2检验。选定相关混杂因素后,采用Cox回归模型分析不同分子分型对复发转移的影响。P<0.05表示差异具有统计学意义。
2 结果
2.1 所有患者临床资料统计分析
共收集275例乳腺癌患者的临床资料,平均首诊年龄(45.61±3.42)岁。其中Luminal B型125例,Luminal A型65例,Her-2/neu型56例,BCL型29例。86.54%的患者肿瘤直径<5 cm;T分期主要集中在T1和T2期;79.64%患者选择改良根治术,不同分子分型乳腺癌患者在肿瘤直径、T分期、手术方式等比较,差异均具有统计学意义(P<0.05),见表1。
2.2 乳腺癌患者的预后情况
275例患者中,100例患者发生复发转移,其中Luminal A型21例,Luminal B型44例,Her-2/neu型27例,BCL型8例。以Her-2/neu型复发转移率最高(48.21%,27/56),Luminal B型为35.20%(44/125),Luminal A型为32.31%(21/65),BCL型为27.59%(8/29)。log-rank检验及 Cox回归分析结果提示,分子分型对乳腺癌患者术后复发转移有显着影响,其中Her-2/neu的复发转移风险最高,见表2。

表1 所有患者临床资料统计分析(n,%)
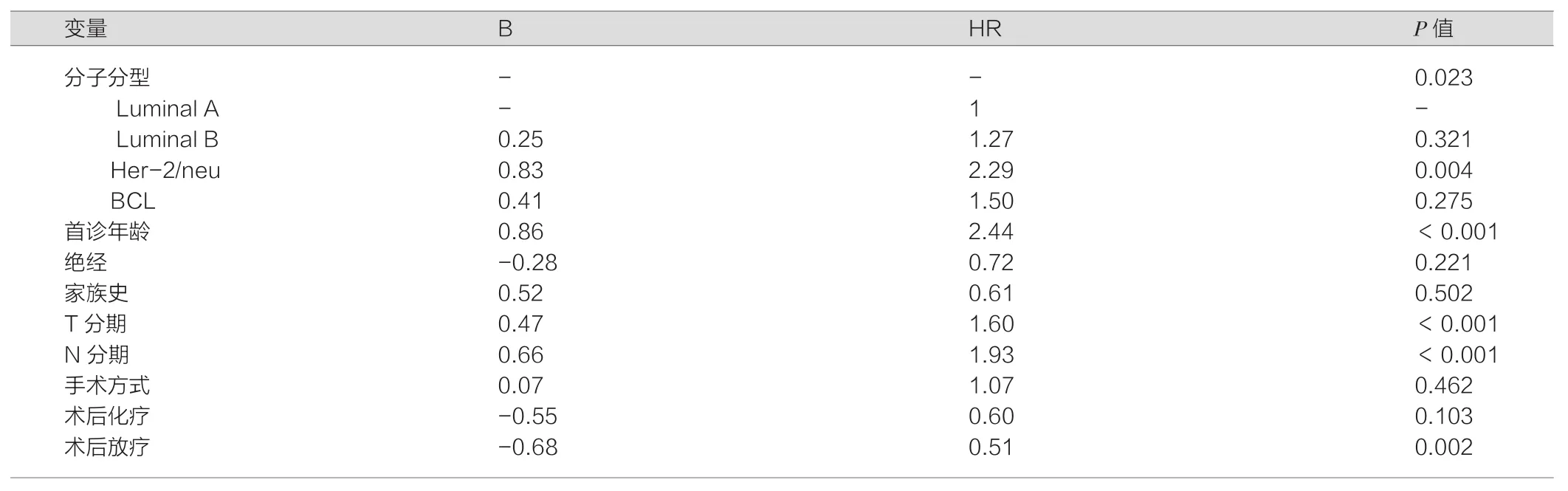
表2 乳腺癌患者术后复发转移的Cox回归分析结果
2.3 不同分子分型患者术后复发转移分布情况
总复发转移风险呈双峰分布,峰值分别出现在术后第2、5年,峰值分别为0.88%、0.79%。其中Luminal A型、Luminal B型以及Her-2/neu复发转移风险呈双峰分布,BCL呈三峰分布,Luminal A型、Luminal B型的首次风险高峰出现在术后第2年,峰值分别为0.56%、1.19%。Her-2/neu型和BCL型首次高峰为术后第1年,峰值分别为1.31%、0.91%。Luminal A型、Luminal B型、Her-2/neu型、BCL型的另一复发转移风险高峰出现在术后第5年,峰值分别为 0.65%、0.96%、1.16%、0.69%。BCL型的另一高峰出现在术后第3年,峰值为0.70%。
3 讨论
乳腺癌术后的复发转移是威胁患者生命安全的重要原因。医学上认为,肿瘤组织学类型与病理分期的不同是影响患者预后的主要因素,但有研究指出,相同组织学类型与病理分期的患者其术后复发转移率也有显着差异[4]。随着分子生物学技术的快速发展,分子分型为认识乳腺癌提供了崭新的视角,为乳腺癌患者的个体化治疗提供了更多的信息。分子分型是由多种标记物组合产生的,能准确反映肿瘤的生物学特征,有助于评估患者预后及制定个性化的诊疗方案[5]。
2000年Perou等[6]对65例乳腺癌的8 102个基因进行分析,最先报道了乳腺癌的分子分型,包括:管腔型、基底细胞样型、HER2过表达型和正常乳腺样型。2003年,Sorlie等将管腔型分为管腔A型和管腔B型[7]。不同分子分型的乳腺癌的流行病学危险因素、疾病自然发展过程及对局部和全身治疗的反应不尽相同[7-9]。在四种不同分子分型的乳腺癌患者中,其预后有较大差别[10-12]。Luminal A预后最好,基底细胞样型及HER-2过表达型预后最差,Lmninal B型仅次于Lunfinal A型[13]。Bauer等[14]的研究显示,所有乳腺癌分子亚型中,基底细胞样型和HER-2过表达型预后最差。
本研究发现,四种分子类型的术后复发转移率以Her-2/neu型最高,为48.21%。患者未发生复发转移生存时间最长类型为Luminal A型。控制相关混杂因素后,Her-2/neu型的风险最高,是Luminal A型的2.29倍。乳腺癌术后总复发转移风险发生在术后第2、5年,但Her-2/neu型和BCL型首次高峰提前1年出现,考虑与雌激素受体的表达状态差异相关。另外BCL型患者在术后第3年亦出现一个小高峰,考虑与其复发转移发生机制不同相关。总结而言,不同分子分型对乳腺癌患者术后复发转移风险有显着影响,但有一定规律性。通过对分型后的患者采取不同的方法进行治疗,不但可以提高患者的治疗质量,从而提高患者的生活和生存质量,也显着降低患者治疗时因药物造成的不良反应等负性影响,在目前医疗条件下最大限度发挥治疗的积极作用[15]。
综上所述,不同分子分型对预测乳腺癌预后有重要意义,不同分子分型患者出现术后复发转移时间有一定规律性,临床中应根据肿瘤分子分型制定个性化的诊疗方案,及时进行术后随访,降低术后复发转移率。
参考文献
[1]查丽华.PICC在乳腺癌术后化疗中的临床观察与护理体会[J].世界最新医学信息文摘(连续型电子期刊),2016,16(33):230-231.
[2]虞林玉,李慕鹏,旷达彬,等.乳腺癌免疫治疗新策略[J].中国药理学通报,2016,32(8):1037-1040.
[3]董良,李海金,尚官敏,等.分子分型在乳腺癌术后复发转移中的应用研究 [J].肿瘤学杂志,2014,20(9):715-719.
[4]张英军,吴君心,侯如蓉.乳腺癌的分子分型[J].实用癌症杂志,2012,27(1):98-100.
[5]段馨,张连平.乳腺癌的分子分型与个体化治疗[J].中国实用医刊,2014,41(6):91-93.
[6]Perou CM,S0rlie T,Eisen MB,et al.Moleenlar portraits of human breast tumours[J].Nature,2000,406(6797):747-752.
[7]董熠,李祥攀,宋启斌.分子分型在乳腺癌放疗中的价值及应用[J].肿瘤学杂志, 2017,23(3):170-174.
[8]赵晶,付丽.乳腺癌的分子分型[J].中华乳腺病杂志(电子版),2009,3(2):195-203.
[9]何伟丽,王宁霞.乳腺癌的分子分型及其临床意义[J].临床与实验病理学杂志,2012,28(5):550-552.
[10]倪韵碧,曾婉珊,谢文杰.乳腺癌分子分型的研究进展[J].中华病理学杂志,2014,43(7):433-436.
[11]王学丽,郝青,陈青.管腔型乳腺癌的分型及其与临床病理特征的关系 [J].国际肿瘤学杂志,2015,42(7):557-558.
[12]南昊成,吴立刚,刘奇伦.乳腺癌分子标志及分子分型研究进展[J].现代肿瘤医学, 2013,21(9):2143-2146.
[13]刘现栋.乳腺癌的分子分型的临床病理特点[J].医学综述,2014,20(12):2148-2150.
[14]Bauer KR,Brown M,Cress RD,et a1.Descriptive analysis of estrogen receptor(ER)-negative,progesterone receptor(PR)-negative,and HER2-negative invasive breast cancer,the so-called triple-negative phenotype:a population-based study from the California cancer Registry[J].Cancer,2007,109(9):172l-1728.
[15]邸立君.乳腺癌分子分型下的治疗策略[J].临床合理用药杂志,2017,10(11):167-168.



