胃癌是临床常见、多发的一种恶性肿瘤,主要起源于胃黏膜上皮,多发于50岁以后[1-2]。患者发病后会出现贫血、营养不良、消瘦等临床症状。目前临床对胃癌患者多采用手术、化疗、靶向治疗等。实施手术治疗后患者胃功能会减弱,营养摄入不够,容易增加疾病复发的几率,并且引发一系列并发症[3-4]。对胃癌患者术后实施营养支持可有效增强其免疫能力,降低并发症率。本研究将早期肠内营养支持用于胃癌根治术后患者中,旨在观察其效果,为临床选择营养支持方式提供参考。现将研究结果报告如下。
1 资料与方法
1.1 一般资料
选取2012年8月—2017年5月我院收治的80例胃癌患者作为研究对象。按营养支持方式,将其分为研究组与参照组,每组各40例。研究组中,男24例,女16例,年龄43~72岁,平均年龄(59.46±3.47)岁,其中,低分化腺癌19例,乳头状癌11例,粘液腺癌10例。参照组中,男22例,女18例,年龄44~75岁,平均年龄(59.53±3.49)岁,其中低分化腺癌17例,乳头状癌14例,粘液腺癌9例。两组患者的一般资料对比,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入、排除标准
纳入:均符合胃癌诊断标准;均实施胃癌根治术;对研究之情且签署同意书。排除:合并严重并发症者;精神疾病者;术前出现重要脏器转移者;对手术不耐受者。
1.3 方法
研究组实施早期肠内营养支持,方法:将肠营养管置入患者空肠上段,术后12小时将病床床头抬高30°,经肠营养管注入等渗盐水500 ml,注入时注意控制速度,不宜过快。术后24小时通过喂养泵输入5% GNS和能全力,输入比例为1∶1,在输入过程中使用加热器进行辅助输入,将液体温度控制在38.2~41.5℃,初次输入速度控制在每小时30 ml,之后逐渐加速,每小时增加20 ml,但每小时输入剂量应低于120 ml。若患者输入液体后能量仍然不足,可根据患者实际情况给予肠外营养辅助支持。
参照组实施肠外营养支持,术后1~5 d给予葡萄糖、氨基酸、脂肪乳剂、微量元素等输入,每日热量控制在125 kJ/kg,氮量控制在0.29 g/kg。两组在进行营养支持期间,均实施相关护理干预。
1.4 观察指标
观察两组术后恢复情况、血清指标、并发症。术后对患者PALB、ALB两项血清指标进行检测,将结果记录并分析。
1.5 统计学方法
采用SPSS 12.0软件对数据进行分析处理,计量资料以(均数±标准差)表示,采用t检验;计数资料以(n,%)表示,采用χ2检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 两组术后恢复情况
研究组患者的术后排气时间、排便时间、住院时间均优于参照组,差异均具有 统计学意义(P<0.05),见表1。
表1 比较两组术后恢复情况(±s)

表1 比较两组术后恢复情况(±s)
分组 排气时间(h) 排便时间(h) 住院时间(d)研究组(n=40) 39.75±4.13 53.16±6.94 9.45±2.37参照组(n=40) 55.28±5.67 74.36±7.61 13.28±2.94 t值 -14.002 -11.018 -6.414 P值 <0.001 <0.001 <0.001
2.2 两组血清指标变化
研究组实施肠内营养支持后PALB、ALB两项血清指标相比参照组更高,差异均具有统计学意义(P<0.05),见表2。
表2 比较两组血清指标差异(±s)
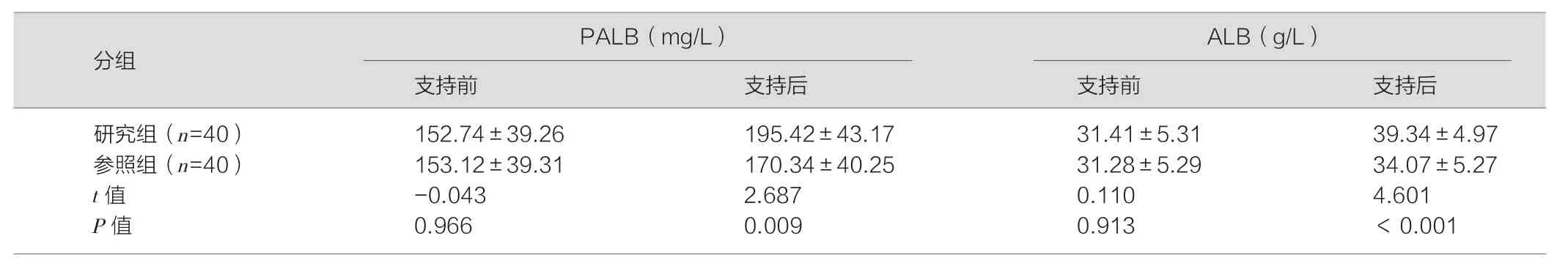
表2 比较两组血清指标差异(±s)
PALB(mg/L) ALB(g/L)支持前 支持后 支持前 支持后研究组(n=40) 152.74±39.26 195.42±43.17 31.41±5.31 39.34±4.97参照组(n=40) 153.12±39.31 170.34±40.25 31.28±5.29 34.07±5.27 t值 -0.043 2.687 0.110 4.601 P值 0.966 0.009 0.913 <0.001分组
2.3 两组并发症发生率比较
参照组出现切口感染、肺部感染、胸腔积液等并发症共6例,并发症发生率为15.0%,研究组并发症发生率为2.5%(1/40),两组患者的并发症发生率相比,研究组更低,差异具有统计学意义(χ2=3.914,P=0.048)。
3 讨论
胃癌发病病因与饮食、环境、遗传、基因等因素相关[5-6]。胃主要功能为对食物进行接收、消化、运输等,维持人体营养平衡,患者发病后会出现营养不良、消瘦、贫血等症状。目前临床主要通过手术治疗胃癌,对病变组织进行切除后可使患者痊愈[7-8]。胃癌患者大部分为老年人,其主要器官代谢、恢复等功能均会相应减弱,实施手术治疗后会处于高消耗状态,加上术后禁食,会导致患者营养不良症状加重,且容易引发一系列并发症。
目前临床主要对胃癌手术患者实施营养支持,改善患者营养状况,增强其免疫力,避免术后出现并发症[9-10]。常见的营养主持包括肠外、肠内营养支持,产外营养具有调制简便、可控性好等优点,为患者提供功能所需物质,起到维持、改善功能的作用。但其治疗费用昂贵,部分患者无力承担,且容易引发肝脏损害、胆汁淤积等疾病,存在一定使用局限性。肠内营养通过对患者提供营养所需物质,可对肠黏膜结构起到保护作用,使细胞结构更加完整[11-12]。同时肠内营养支持可加强机体肠道免疫与机械功能,促进胆汁、胰腺分泌,加速胆汁排泄,对机体肝功能起到保护作用。肠内营养成分包含了人体正常生理功能所需的各种膳食纤维与谷氨酰胺,可有效改善患者营养不良、消瘦等症状,增强其免疫能力,促进术后快速康复。对患者实施肠外营养支持可能导致营养底物丢失,出现能量、蛋白质供给不足的现象,不利于改善患者营养状况。对患者实施肠内营养支持时应注意输入剂量与浓度,初始输入应为低浓度,并根据患者实际情况适当调节剂量、浓度、输入速度等,避免出现并发症,影响效果。
本次研究中,研究组患者术后通气时间、排便时间、住院时间等指标相比参照组均更短,提示肠内营养可快速改善患者营养状况,促进快速康复。研究组患者术后血清指标均优于参照组,并发症率也更低,提示早期肠内营养支持在胃癌手术患者中应用价值更高,可有效改善患者营养不良、消瘦等临床症状,增强免疫力,降低并发症率,促进患者快速康复。



