张浩宇,吕广霖,袁和兴,魏雪栋,胡林昆,张学锋,侯建全
体质指数、血脂水平与前列腺穿刺活检阳性间的关系
张浩宇,吕广霖,袁和兴,魏雪栋,胡林昆,张学锋,侯建全△
目的探讨体质指数(BMI)、血脂水平与前列腺穿刺活检阳性之间的关系。方法回顾性分析2013年2月—2014年8月间在我院行前列腺穿刺活检患者214例,根据穿刺病理结果分为前列腺癌组和非癌组,比较2组间年龄、前列腺特异性抗原(PSA)、前列腺体积(PV)、血脂水平、体质指数(BMI)等指标,并分析前列腺穿刺阳性的危险因素。结果前列腺癌组年龄、PSA、BMI高于非癌组,而PV、高密度脂蛋白胆固醇(HDL-C)则低于非癌组(均P<0.05)。Logistic回归分析提示年龄大,PSA、BMI升高是前列腺穿刺活检阳性的危险因素,而PV、HDL-C升高则为保护因素(均P<0.05)。结论综合评估患者BMI及血脂水平可为前列腺癌的早期筛查及前列腺穿刺方案的制定提供重要信息,对高危人群的早预防、早诊断、早治疗提供重要依据。
前列腺肿瘤;穿刺术;人体质量指数;胆固醇,HDL;前列腺特异抗原;前列腺体积
1 对象与方法
1.1研究对象选择2013年2月—2014年8月在我院行前列腺穿刺活检患者214例,年龄39~85岁,平均(68.8± 8.1)岁。纳入标准:第1次前列腺穿刺,直肠指诊触及前列腺结节,或血清前列腺特异性抗原(PSA)>4 μg/L,或影像学检查(经直肠B超或前列腺MRI)探及前列腺内异常信号。排除标准:合并其他恶性肿瘤,急慢性肝肾功能障碍,降血脂药物使用史。根据穿刺病理结果,将患者分为前列腺癌组和非癌组。
1.2方法
1.2.1临床资料的收集收集入组患者的年龄、PSA值、体质指数(BMI)等临床资料。空腹抽血检测血胆固醇(CHOL)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、三酰甘油(TG)。
1.2.2前列腺穿刺及体积测定方法经直肠超声引导12针穿刺,对前列腺结节或影像学异常信号部位加1~2针,经直肠超声测定前列腺的上下、左右及前后径,根据公式前列腺体积(PV)=0.52×上下径×左右径×前后径,计算PV。
1.3统计学方法采用SPSS 19.0软件处理,数据用M(P25,P75)表示,组间比较采用非参数的秩和检验。采用多因素Lo⁃gistic回归分析前列腺穿刺阳性的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1前列腺癌组与非癌组一般临床资料比较前列腺癌组患者较非癌组年龄较大、PSA值较高、前列腺体积较小、HDL-C较低、BMI较高(均P<0.05),其余指标差异无统计学意义,见表1。
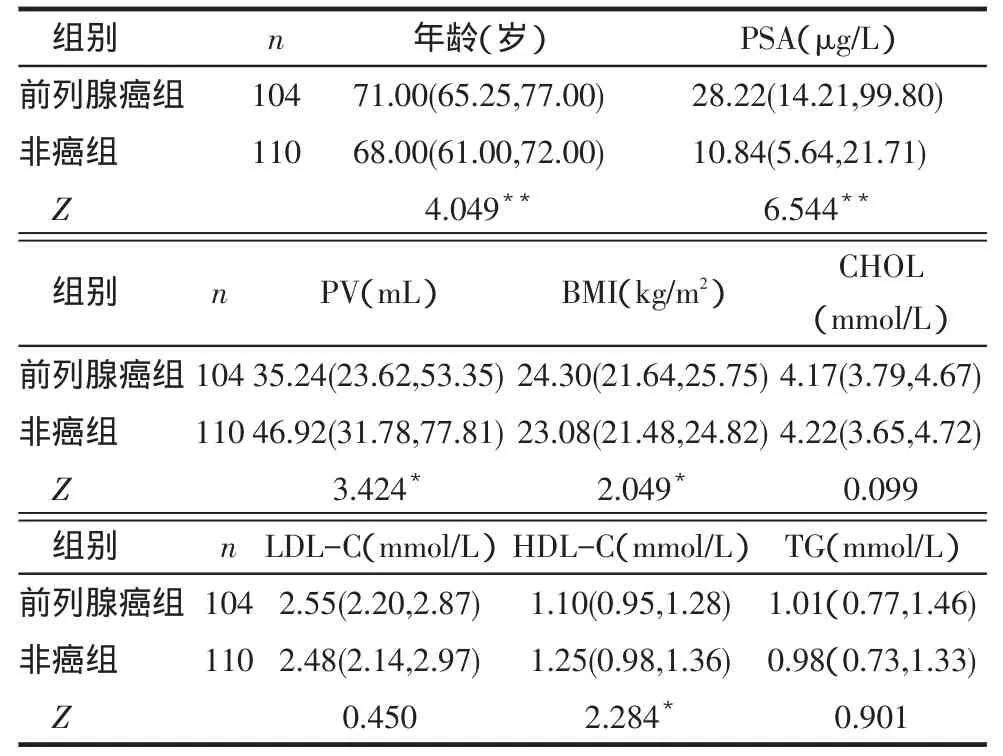
Tab.1Comparison of baseline clinical data between prostate cancer and non-cancer groups表1前列腺癌组与非癌组一般临床资料比较M(P25,P75)
2.2前列腺穿刺阳性影响因素分析以前列腺穿刺病理结果为因变量(阴性赋值0,阳性赋值1),将年龄、PSA、PV、CHOL、HDL-C、LDL-C、TG、BMI作为自变量,引入多因素Logistic回归分析,结果显示年龄大,PSA、BMI升高是前列腺穿刺阳性的危险因素,而PV、HDL-C升高则为保护因素,见表2。
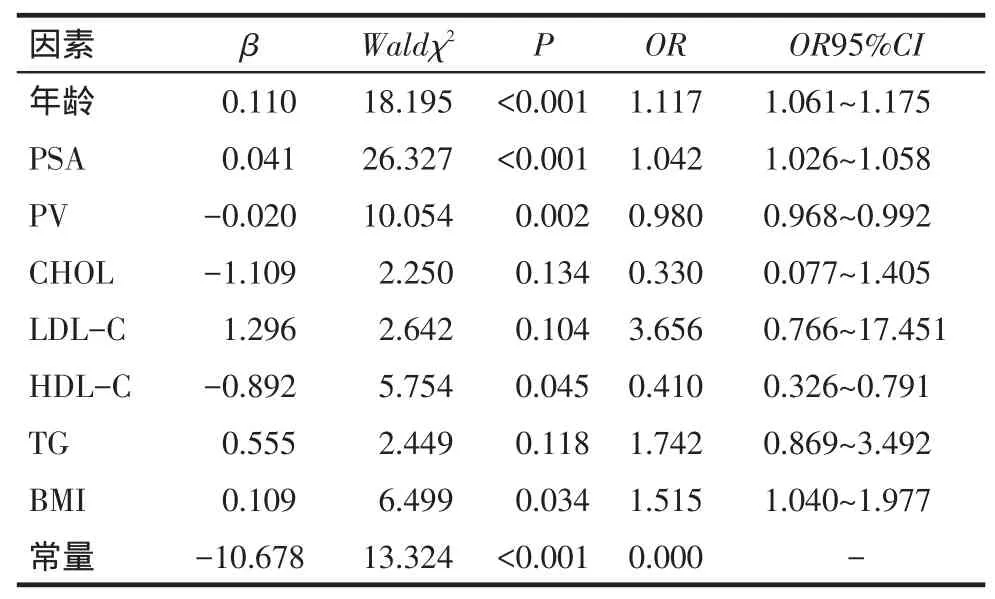
Tab.2The Logistic regression analysis of risk factors for cancer dectection of prostate biopsy表2前列腺穿刺阳性的相关危险因素Logistic回归分析
3 讨论
前列腺癌的危险因素除年龄、种族、家族史外,可能还包括与环境和生活方式有关的诸多因素,如肥胖、体能活动不足及高胆固醇饮食等,但尚未明确[6]。因此,近年来肥胖、胆固醇水平成为前列腺癌研究领域的热点。Schuurman等[7]通过一项纳入5万余例荷兰老年男性的队列研究发现,前列腺癌发病率与BMI有关。Liang等[8]对3 258例前列腺穿刺患者研究发现,BMI升高是预测前列腺癌及高级别前列腺癌的独立因素。我国尚缺乏这方面的大样本研究。
本研究结果提示前列腺癌患者BMI较高,BMI升高是穿刺阳性的危险因素。Gade-Andavolu等[9]发现在前列腺癌患者血清中,肥胖相关基因leptin的表达高于普通人群,并认为肥胖可能是前列腺癌发病率增加的一个危险因素。Patel等[10]发现肥胖和脂肪细胞分泌因子,尤其是高水平内脂素可明显促进前列腺癌的发展。此外,肥胖常可导致身体出现轻度慢性炎症,主要表现为高浓度巨噬细胞和炎性细胞对脂肪组织浸润,并促使前列腺癌发生[11]。尽管如此,针对肥胖与前列腺癌之间相互关系的分子及细胞学研究仍相对缺乏。值得注意的是,本研究还发现HDL-C是前列腺穿刺阳性的保护因素,与国外的报道相符[4-5]。Su等[12]使用HDL-C相关载脂蛋白(如载脂蛋白A-I)及模拟肽来研究HDL-C与肿瘤细胞间的相互作用,结果显示HDL-C模拟肽可显着降低BALB/c小鼠结肠癌细胞的存活率及增殖能力,其细胞介导的癌症负担也有所下降,并在对卵巢癌的研究中得出了类似的结论。尽管如此,HDLC模拟肽与前列腺癌之间的关系仍待进一步确认。
HDL-C在前列腺癌的发生发展中或许具有两面性,且与雄激素水平存在复杂的关系。已有研究表明,在接受雄激素阻断治疗的前列腺癌患者中,其HDL-C水平却有所上升[13]。Sekine等[14]研究发现,HDL-C可通过ERK1/2及Akt机制诱发非雄激素依赖型前列腺癌细胞的增殖和迁移,而对雄激素依赖型前列腺癌细胞无此影响。Fukuchi等[15]发现,雄激素可抑制一种胆固醇跨膜逆转运蛋白ABCA1在前列腺癌细胞中的表达。然而,在非雄激素依赖型前列腺癌细胞中,ABCA1表达量高于雄激素依赖型前列腺癌细胞[16],HDL-C可由ABCA1介导,从而促进非雄激素依赖型前列腺细胞的增殖与迁移。此外,HDL-C可转运鞘氨醇磷酸酯(S1P),S1P和重组HDL-C可激活正常细胞及非雄激素依赖型前列腺癌细胞Stat3信号通路,进而促进其增殖、迁移和侵袭[17]。可以设想,综合评估前列腺癌患者HDL-C及雄激素水平,可为判断是否为雄激素依赖型前列腺癌提供参考,而且对于接受雄激素阻断治疗的前列腺癌患者,可以判断是否由雄激素依赖型向非依赖型转变。由于本研究对象较局限,仍需大样本的队列研究进一步证实HDL-C、雄激素水平与前列腺癌的关系,并且与经直肠前列腺穿刺比较,经会阴饱和穿刺可提高PSA灰区患者穿刺阳性率[18],穿刺方案不同可能导致BMI、血脂水平与穿刺阳性间关系变化,因此本研究结论仍需多种穿刺方案进一步证实。
[1]Arem H,Park Y,Pelser C,et al.Prediagnosis body mass index,physical activity,and mortality in endometrial cancer patients[J].J Natl Cancer Inst,2013,105(5):342-349.doi:10.1093/jnci/djs530.
[2]Suzuki S,Kojima M,Tokudome S,et al.Obesity/weight gain and breast cancer risk:findings from the Japan collaborative cohort study for the evaluation of cancer risk[J].J Epidemiol,2013,23(2): 139-145.
[3]Anderson JC.Editorial:Body mass index and colorectal adenomas[J].Am J Gastroenterol,2012,107(8):1187-1188.doi:10.1038/ ajg.2012.182.
[4]Grosman H,Fabre B,Mesch V,et al.Lipoproteins,sex hormones and inflammatory markers in association with prostate cancer[J].Ag⁃ing Male,2010,13(2):87-92.doi:10.3109/13685530903410617.
[5]Van Hemelrijck M,Walldius G,Jungner I,et al.Low levels of apoli⁃poprotein A-I and HDL are associated with risk of prostate cancer in the Swedish AMORIS study[J].Cancer Causes Control,2011,22(7):1011-1019.doi:10.1007/s10552-011-9774-z.
[6]Meyerhardt JA,Ma J,Courneya KS.Energetics in colorectal and prostate cancer[J].J Clin Oncol,2010,28(26):4066-4073.doi: 10.1200/JCO.2009.26.8797.
[7]Schuurman AG,Goldbohm RA,Dorant E,et al.Anthropometry in relation to prostate cancer risk in the Netherlands cohort study[J]. Am J Epidemiol,2000,151(6):541-549.
[8]Liang Y,Ketchum NS,Goodman PJ,et al.Is there a role for body mass index in the assessment of prostate cancer risk on biopsy[J]?J Urol,2014,192(4):1094-1099.doi:10.1016/j.juro.2014.04.015.
[9]Gade-Andavolu R,Cone LA,Shu S,et al.Molecular interactions of leptin and prostate cancer[J].Cancer J,2006,12(3):201-206.
[10]Patel ST,Mistry T,Brown JE,et al.A novel role for the adipokine visfati-n/pre-B cell colony-enhancing factor 1 in prostate carcino⁃genesis[J].Peptides,2010,31(1):51-57.doi:10.1016/j.peptides. 2009.10.001.
[11]Sfanos KS,De Marzo AM.Prostate cancer and inflammation:the evi⁃dence[J].Histopathology,2012,60(1):199-215.doi:10.1111/j.136 5-2559.2011.04033.x.
[12]Su F,Kozak KR,Imaizumi S,et al.Apolipoprotein A-I(apoA-I)and apoA-I mimetic peptides inhibit tumor development in a mouse model of ovarian cancer[J].Proc Nat Acad Sci USA,2010,107(46): 19997-20002.doi:10.1073/pnas.1009010107.
[13]Saylor PJ,Smith MR.Metabolic complications of androgen depriva⁃tion therapy for prostate cancer[J].J Urol,2013,189(1 Suppl):S34-S42;discussion S43-S44.doi:10.1016/j.juro.2012.11.017.
[14]Sekine Y,Demosky SJ,Stonik JA,et al.High-density lipoprotein in⁃duces poliferation and migration of human prostate androgen-inde⁃pendent cancer cells by an ABCA1-dependent mechanism[J].Mol Cancer Res,2010,8(9):1284-1294.doi:10.1158/1541-7786.MCR-10-0008.
[15]Fukuchi J,Hiipakka RA,Kokontis JM,et al.Androgenic suppres⁃sion of ATP-binding cassette transporter A1 expression in LNCaP human prostate cancer cells[J].Cancer Res,2004,64(21):7682-7685.
[16]Ni J,Pang ST,Yeh S.Differential retention of alpha-vitamin E is correlated with its transporter gene expression and growth inhibition efficacy in prostate cancer cells[J].Prostate,2007,67(5):463-471.
[17]Sekine Y,Suzuki K,Remaley AT.HDL and sphingosine-1-phos⁃phate activate stat3 in prostate cancer DU145 cells via ERK1/2 and S1P receptors,and promote cell migration and invasion[J].Prostate,2011,71(7):690-699.doi:10.1002/pros.21285.
[18]Xue J,Liang L,Jiang WD,et al.Comparative Analysis of transperi⁃neal saturated prostate biopsy with traditional prostate biopsy modes[J].Tianjin Med J,2013,41(9):920-922.[薛健,梁磊,姜文弟,等.经会阴饱和穿刺与传统前列腺穿刺活检法诊断前列腺癌对比分析[J].天津医药,2013,41(9):920-922].doi:10.3969/j.issn.0253-9896.2013.09.025.
(2014-11-06收稿 2015-02-06修回)
(本文编辑 李国琪)
Relationship of body mass index and blood lipid level with cancer detection on prostate biopsy
ZHANG Haoyu,LYU Guanglin,YUAN Hexing,WEI Xuedong,HU Linkun,ZHANG Xuefeng,HOU Jianquan△
Department of Urology,First Affiliated Hospital of Soochow University,Suzhou 215000,China△
ObjectiveTo investigate the relationship between body mass index(BMI),blood lipid level and cancer de⁃tection in prostate biopsy.MethodsA total of 214 patients undergoing a prostate biopsy during 2013.2—2014.8 were re⁃viewed retrospectively.They were divided into prostate cancer and non-cancer groups by biopsy results.The differences of age,prostate-specific antigen(PSA)level,prostate volume(PV),blood lipid level and BMI were analyzed between two groups.Risk factors for cancer detection of biopsy were also analyzed.ResultsCompared with non-cancer patients,pros⁃tate cancer patients were older,had higher level of PSA and BMI,but smaller PV and lower level of HDL-C(P<0.05).Lo⁃gistic regression analysis showed that older,higher level of PSA and BMI were risk factors for prostate biopsy positive,but larger PV and higher level of HDL-C were protective factors(P<0.05).ConclusionComprehensive assessment of BMI and blood lipid levels can provide important reference for prostate cancer screening at early time and establishment of pros⁃tate biopsy scheme,which also provide significant evidence for the prevention,diagnosis and treatment of prostate cancer at early stage for high risk population.
prostatic neoplasms;punctures;body mass index;cholesterol,HDL;prostate-specific antigen;prostate volume随着生活水平的提高,肥胖问题日益严重,且许多研究也表明肥胖与癌症的发生、发展关系极为密切,如子宫内膜癌[1]、乳腺癌[2]、结肠癌[3]等。近年来国外一些研究表明,高密度脂蛋白降低是前列腺癌的危险因素[4-5]。本研究通过分析前列腺穿刺患者的临床资料,探索肥胖、血脂水平与前列腺癌之间的关系。
R737.25
A
10.11958/j.issn.0253-9896.2015.07.018
苏州大学附属第一医院泌尿外科(邮编215000)
张浩宇(1988),男,硕士在读,主要从事泌尿系肿瘤研究
△通讯作者E-mail:xf192@163.com



