张军波, 吕颖, 刘仲伟, 潘军强, 殷艳蓉
(1.西安交通大学第一附属医院 周围血管科, 陕西 西安 710061; 2.西安交通大学第三附属医院&陕西省人民医院 心内科, 陕西 西安 710068; 3.西安交通大学第一附属医院 心血管内科, 陕西 西安 710061)
心房颤动(atrial fibrillation,AF)是临床最常见的心律失常之一,约20%的中国成年人罹患AF,并随年龄增长而增加[1]。血栓栓塞是AF患者最常见的并发症,也是AF患者致死、致残的重要原因[2]。心脏纤维化是AF最重要也最显着的病理改变,主要表现为心脏胶原蛋白沉积、心肌排列紊乱及心脏胶原比例的改变[3]。纤维化能破坏细胞间缝隙连接,心房肌被分割包绕,使得生理电信号不能顺利传导,形成多个折返环路,从而引发和维持AF[3]。有研究发现,干预纤维化可有助于预防AF的复发[4]。过氧化物酶体增殖物激活受体α(peroxisome proliferators-activated receptors,PPARα)是核受体超家族的成员,是脂肪酸平衡的主要调节因子,主要在肝脏、肾脏及心脏等高代谢器官中表达[5],具有保护心脏的作用[6],参与了心脏纤维化过程[7]。既往的研究多基于动物心脏标本,对人群的研究较少,本文采用HE及Masson染色观察AF患者心房组织纤维化情况,采用实时荧光定量PCR(Realtime-PCR)法测定心房组织中PPARαmRNA表达,分析AF患者心肌中PPARα的表达与心肌纤维化的关系,报告如下。
1 资料与方法
1.1 一般资料及试剂
1.1.1一般资料 选取2012年5-8月在心脏外科行人工心脏瓣膜置换术的风湿性心脏瓣膜病患者81例,排除合并肝功能衰竭、肾功能衰竭、甲状腺功能亢进症、高血压及各种类型的心肌病患者,排除合并结缔组织病、风湿热活动期及肿瘤患者。81例患者按心电图表现分为AF组(n=38)及窦性心律组(n=43,持续窦性心律无AF病史患者)。
1.1.2主要试剂 正反向引物及测序引物由上海尼桑生物公司合成,反转录试剂盒及实时荧光定量PCR试剂盒购自Takara公司,其余均为国产分析纯。PTC-200DNA扩增仪为美国MJ公司产品,XSP-2CA生物显微镜和IMP-2型倒置相差生物显微镜均来自日本Olympus公司。
1.2 方法
1.2.1右心房组织学观察 采用HE及Masson染色法,选取手术中废弃的右心房右心耳组织,清洗后液氮保存;分为3份,一份用于检测PPARα mRNA表达,2份用于组织学观察。(1)HE染色,取右心耳组织,经固定、脱水、OCT包埋速冻后进行冰冻切片及HE染色封片,镜下观察染色情况;(2)Masson染色,取右心耳组织,切片晾置甲醇固定后,分别经苏木素染色、盐酸酒精分化、品红复染、冲洗后苯胺蓝复染、冰醋酸固定、酒精脱水、二甲苯透明后封片,镜下观察染色情况。
1.2.2PPARαmRNA表达 采用Realtime-PCR,所有用品经预防RNA酶污染处理后,取右心耳组织提取总RNA,逆转录为cDNA。应用Primer primier 5.0软件,设计引物序列,内参hGAPDH上游引物序列为5′-TCATGGGTGTGA ACCATG AGA A-3′、下游引物序列为5′-GGC ATG GAC TGT GGT CAT GAG T-3′,PPARα上游引物序列为5′-CGAATGTAGAATCTGCGGGG-3′、下游引物序列为5′-CATCCCGACAGAAAGGCACT-3′。PCR反应条件为95 ℃预变性3 min,95 ℃变性10 s,56 ℃延伸30 s,扩增 40个循环后收集数据,绘制动力学曲线读取 Ct值。将各组目的基因的Ct值与管家基因hGAPDH的Ct 值相减得△Ct,扩增重复 3 次,计算出各组PPARαmRNA 的表达,进行数据分析。
1.3 统计学方法
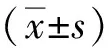
2 结果
2.1 右心房组织学观察
染色结果显示,AF组患者心房组织纤维化较窦性心律组加重,HE染色可见(图1A-B),窦性心律组心房组织排列有序,心肌细胞间有少量纤维组织,而AF组的心房组织结构明显紊乱,心肌细胞肥大,排列不匀,可见组织间空隙较多,细胞核浓染,大小不一,细胞间隙可见明显纤维组织增生。Masson染色可见(图1C-D)胶原纤维呈蓝色,心肌细胞胞质、肌纤维和红细胞呈红色,而心肌细胞核呈蓝褐色;窦性心律组患者心房肌细胞排列均匀,肌细胞间隙可见少量蓝色胶原纤维组织,而AF组患者心房肌细胞肥大,排列较稀疏,可见蓝色胶原纤维组织分割包绕褐色的心房肌细胞,细胞间间隙增大,其中蓝色胶原纤维组织较窦性心律患者明显增多。
注:A、B为HE染色,C、D为Masson染色;A、C为窦性心律组,B、D为AF组。图1 两组患者右心房组织(HE、Masson染色,×200)Fig.1 Right atrial tissue of both group patients
2.2 PPARα mRNA相对表达水平
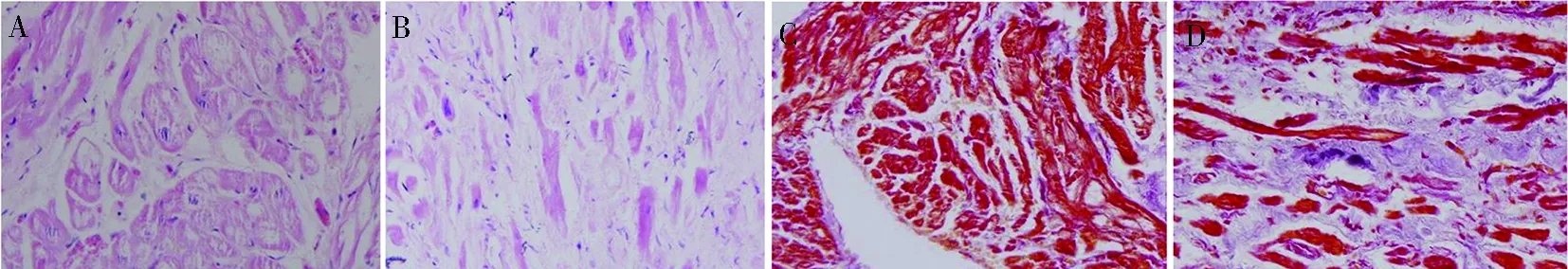
2.2.1扩增曲线和溶解曲线PPARαmRNA扩增曲线拐点明确,整体扩增曲线平行性较好,基线较水平,无明显上扬,各管的扩增曲线平行性好,表明各反应管的扩增效率相近;溶解曲线仅出现一个有效峰值,提示产物特异性良好。见图2。
图2 PPARα mRNA扩增曲线及溶解曲线Fig.2PPARα mRNA amplification curve and melt curve
2.2.2PPARαmRNA相对表达水平 如图3所示,AF组2-ΔΔCT=0.36±0.07,窦性心律组2-ΔΔCT=1.00±0.16, AF组PPARαmRNA相对表达水平明显低于窦性心律组,差别具有统计学意义(t=-3.61,P=0.003)。提示AF患者右心房组织PPARαmRNA的相对表达水平较窦性心律患者低。

注: (1)与AF组比较,P<0.01。图3 两组患者PPARα mRNA相对表达水平Fig.3 Relative expression level of PPARα mRNA of both groups
3 讨论
引起AF的原因众多,老年退行性改变、长期高血压、甲状腺功能亢进等都可以引起AF[8]。目前将外科换瓣术后或风湿性心脏瓣膜病,尤其是二尖瓣狭窄相关的AF称作瓣膜性AF[9]。AF患者的卒中的风险是无AF患者的6倍,当二尖瓣狭窄合并AF时,这个风险增加到15倍[10]。
本研究结果证实瓣膜性AF患者右心房纤维化程度较正常对照组明显加重,无论HE染色还是针对纤维组织的Masson染色均发现,窦性心律组患者的右心房组织内心房肌细胞排列均匀,细胞间隙少量蓝色胶原纤维组织,而瓣膜性AF患者心房肌细胞肥大,排列紊乱,被大量胶原纤维组织分割包绕。已有研究证实,AF与心肌纤维化常常伴随发生,在孤立性AF患者心房活检标本中也证实,75%的患者存在明显的心肌纤维化[11]。另一项长期快速起搏导致AF的模型研究证实,心肌纤维化程度和AF密切相关[12]。对于人群孤立性AF的研究,也证实初始心房正常大小的患者在随访20个月里心房发生了明显的扩大[13]。在犬AF模型的研究发现AF可以诱发并促进心房扩大进程,同时导致心肌纤维化进行性加重[14]。以上研究结果提示,心肌纤维化的病理过程启动后,随着纤维化的加重,可以继续促进AF,这形成了一个恶性循环[15]。
PPARα能改善血脂对心肌的作用,主要机制为PPARα刺激脂蛋白脂酶表达,促进脂蛋白释放脂肪酸颗粒和随后的吸收[16]。氧化应激诱导一些促炎性细胞因子的产生,这可能促进与许多疾病状态相关的病理老化,给老年小鼠服用能够激活PPARα的药物后,可以恢复细胞的氧化还原平衡,降低组织脂质过氧化作用,持续消除激活的核转录因子kappa B(nuclear transcription factor kappa B,NF-κB)并抑制炎性因子如血管内皮细胞黏附分子-1、血小板内皮细胞黏附分子和细胞间黏附分子-1的产生[17]。研究发现,棕榈酸甲酯可以激活小鼠PPARα的表达,促进β-氧化蛋白和基因表达,进而改善非酒精性脂肪肝[18]。对大鼠肝纤维化的研究发现,PPARα和PPARγ双激动剂可以通过抑制瘦素、转化生长因子β1和血小板衍生生长因子BB,从而降低金属蛋白酶组织抑制剂-1的表达,从而发挥抗纤维化的作用[19]。对心脏研究发现,PPARα激动剂非诺贝特可以预防血管紧张素灌流大鼠的心肌炎症,在减少炎症因子的表达同时,可以减少转化生长因子-β1的表达、减少胶原沉积并改善纤维化[20];还可以抑制腹主动脉结扎导致压力超负荷大鼠心肌胶原和内皮素-1的表达,改善心肌纤维化[21]。PPARα激活后可以通过抑制内皮素-1改善单肾切除高血压大鼠左心室的心肌纤维化,但对于左心室心肌肥厚作用不大[22]。对于缺血性心肌病导致的心力衰竭患者行心脏移植术中取得的人体标本研究发现,心衰的心室中纤维化加重,而相对与正常的心脏,衰竭心脏的PPARα和PPARγ选择性的激活,在维持心房形态方面起了重要的作用[23]。
综上所述,在瓣膜性AF患者的心房组织中,纤维化明显加重,而PPARα的表达较窦性心律人群下降,提示瓣膜性AF患者的心房组织纤维化明显加重,可能与心房组织的PPARα下降有关。但还需要进一步的研究证实。



