刘淑娟,刘梦莹,苏乌云,窦佳,王薇△
三阴性乳腺癌(triple-negative breast cancer,TNBC)是一种生长迅速的侵袭性乳腺癌,化疗是TNBC的最主要的治疗手段[1]。白蛋白紫杉醇(Nabpaclitaxel,Nab-PTX)是一种无溶剂的紫杉醇新剂型[2],已成为TNBC 治疗的一线用药,其疗效及安全性均优于普通紫杉醇制剂[3]。但随着治疗的进行,对Nab-PTX 耐药的问题也逐步凸显。寻找逆转TNBC 耐药的新靶点和治疗方法是目前研究的热点与难点。肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)是肿瘤微环境中一类重要的免疫细胞,多呈现M2表型特征[4]。研究证实TAM在乳腺癌中占基质细胞的50%~80%[5],与TNBC 耐药有关[6],但TAM 介导的TNBC 耐药的分子机制尚未完全明确。胰岛素样生长因子1 受体(insulin-like growth factor 1,IGF-1R)是一种酪氨酸蛋白激酶受体[7],IGF-1R 抑制剂可逆转肿瘤细胞耐药性,提高疗效[8-9]。TAM 可否通过激活IGF-1R 促进TNBC 细胞对Nab-PTX 耐药性尚不清楚。本研究建立M2型巨噬细胞模拟TAM,将TNBC细胞与M2型巨噬细胞共培养,探讨TAM 是否通过激活IGF-1R 信号通路促进TNBC 细胞对Nab-PTX 耐药,为耐药患者寻找新的治疗靶点。
1 材料与方法
1.1 主要试剂及仪器 TNBC细胞系MDA-MB-231、单核细胞系THP-1均购自广州莱德联康生物科技有限公司;胎牛血清(FBS)、RPMI-1640 培养基、青链霉素均购自美国Hyclone公司;RNA 提取试剂盒购自美国Qiagen 公司;反转录试剂盒及RT-PCR试剂盒购自美国Invitrogen公司;Transwell小室购自美国Corning 公司;CCK-8 细胞增殖检测试剂盒及细胞凋亡检测试剂盒购自美国Keygen 公司;APC 标记鼠抗人CD14及其同型抗体、PE标记的鼠抗人CD206及其同型抗体、IGF-1R、p-IGF-1R、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、p-ERK、蛋白激酶B(AKT)、p-AKT 和GAPDH一抗及山羊抗鼠IgG二抗均购自英国Abcam公司;佛波酯(PMA)购自美国MCE公司;白细胞介素(IL)-4、IL-13购自美国RD公司;IGF-1R抑制剂Linsitinib购自维百奥(北京)生物科技有限公司;白蛋白结合型紫杉醇购自中国石药集团欧意药业有限公司。酶标仪购自赛默飞世尔(上海)仪器有限公司;电泳仪购自北京百晶生物技术有限公司;流式细胞仪购自美国BD Biosciences 公司;实时荧光定量PCR(qPCR)仪购自美国ABI 公司;倒置光学显微镜购自日本Olympus公司。
1.2 方法
1.2.1 细胞培养 MDA-MB-231、THP-1 细胞均接种于含100 U/mL青霉素、100 mg/L链霉素和10%FBS的RPMI-1640基础培养基,置于含5% CO2、37 ℃的湿化培养箱中常规培养。
1.2.2 M2型巨噬细胞的诱导建立 取对数生长期的THP-1细胞,离心收集细胞,先用PMA(185µg/L)刺激THP-1 细胞48 h,诱导THP-1 细胞分化成M0 型巨噬细胞,再加入IL-4(20 µg/L)和IL-13(20 µg/L)处理48 h,诱导细胞向M2 型巨噬细胞极化[10]。
1.2.3 流式细胞术鉴定细胞表面标记分子CD14、CD206 的表达 将诱导后的细胞消化、重悬于PBS 中,调整细胞密度约为1×106个/mL。室温孵育15 min,加入CD14抗体(20µL)和CD206抗体(20µL),对照组加入等体积的同型对照抗体,室温避光孵育30 min,离心、洗涤细胞,再用PBS 重悬细胞,迅速移至流式细胞仪上机检测。
1.2.4 qPCR 检测巨噬细胞IL-10、趋化因子配体2(CCL2)mRNA的表达 采用Trizol法提取不同诱导条件下巨噬细胞的总RNA,使用逆转录试剂盒合成cDNA,按说明书进行扩增,引物序列由广州莱德联康生物科技有限公司合成。IL-10:上游5'-CTTCAGCAGAGTGAAGACTT-3',下游5'-GGAT CATCTCAGACAAGGCT-3',产物大小122 bp;CCL2:上游5'-CCAGATGCAATCAATGCCCC-3',下游5'-GGGACACTTGCT GCTGGTGA-3',产物大小108 bp;内参GAPDH:上游5'-GCTCATTTGCAGGGGGGAG-3',下游5'-GTTGGTGGTGCAG GAGGCA-3',产物大小138 bp。反应条件:95 ℃预变性120 s;95 ℃变性15 s,60 ℃退火32 s,共40个循环。各组实验重复3次,采用2-ΔΔCt方法分析mRNA相对表达量。
1.2.5 M2型巨噬细胞与MDA-MB-231细胞共培养体系的建立及分组 将5×105个MDA-MB-231细胞接种至24孔板,细胞贴壁后,将0.4 µm 的Transwell 小室移入24 孔板中,并将THP-1诱导生成的1×105个M2型巨噬细胞接种于小室上层,共培养48 h,收集下层MDA-MB-231 细胞,用于后续实验[11]。对照组:MDA-MB-231 细胞及空白小室;Nab-PTX组:MDA-MB-231 细胞、空白小室及0.5 nmol/L Nab-PTX;TAM 组:MDA-MB-231 细胞、含M2 型巨噬细胞的小室;TAM+Nab-PTX 组:MDA-MB-231 细胞、含M2 型巨噬细胞的小室及0.5 nmol/L Nab-PTX;IGF-1R 抑制剂组:MDA-MB-231 细胞、含M2 型巨噬细胞的小室、0.5 nmol/L Nab-PTX 及4 nmol/L IGF-1R抑制剂Linsitinib。
1.2.6 CCK-8 法检测MDA-MB-231 细胞的增殖 稀释各组细胞,以1×104个/孔的密度接种到96 孔板,待细胞贴壁生长后加入Nab-PTX或IGF-1R抑制剂,继续培养48 h,每组接种5 个复孔。加10µL CCK-8(1∶10)至待测孔中,孵育4 h,酶标仪读板,测定490 nm 处的光密度(OD)值,代表细胞增殖水平。
1.2.7 流式细胞术检测MDA-MB-231 细胞凋亡 收集待测细胞,消化、重悬,加入1.25 µL Annexin V-FITC 和10 µL PI溶液,室温避光反应15 min。离心,弃上清,缓冲液重悬细胞。流式细胞仪检测分析细胞凋亡率。
1.2.8 qPCR 检测MDA-MB-231 细胞多药耐药蛋白(MDR)1和胱天蛋白酶(Caspase)-3 mRNA 表达 采用Trizol 法提取各组细胞中总RNA,使用逆转录试剂盒合成cDNA,按说明书进行扩增,引物序列由广州莱德联康生物科技有限公司合成。MDR1:上游5'-GCTTAACACCCGACTTACAG-3',下游5'-CAACCACGTGTAAATCCTACT-3',产物大小126 bp;Caspase-3:上游5'-ATGATCTTACACGTGAAGAA-3',下游5'-CTTCACCATGGCTCAGAAGC-3',产物大小105 bp;内参GAPDH:上游5'-GCTCATTTGCAGGGGGGAG-3',下游5'-GTTGGTGGTGCAGGAGGCA-3',产物大小138 bp。反应条件:95 ℃预变性120 s;95 ℃变性15 s,60 ℃退火32 s,共40个循环。各组实验重复3次,采用2-ΔΔCt方法对mRNA相对表达量进行分析。
1.2.9 Western blot 检测MDA-MB-231 细胞IGF-1R 信号通路关键蛋白表达 各组分别取2×106个细胞,用SDS 裂解液提取细胞总蛋白,BCA法检测蛋白浓度。配置10%分离胶和5%浓缩胶,取30 µg 蛋白进行10%SDS-PAGE 电泳后转至PVDF 膜,封闭后,加p-IGF-1R、IGF-1R、p-ERK、ERK、p-AKT、AKT(1∶1 000)和GAPDH(1∶5 000)一抗,4 ℃过夜。洗涤后加入辣根过氧化物酶标记二抗37 ℃孵育1 h,洗膜后用增强化学发光(ECL)荧光试剂显影。GAPDH设为内参,使用Image J 软件对Western 印迹进行灰度值分析,计算每组蛋白相对表达量,测量重复3次。
1.3 统计学方法 采用SPSS 25.0 软件进行数据分析,计量资料以表示。2 组间比较采用独立样本t检验,多组间比较用单因素方差分析,使用Tukey-q法进行组间多重比较。P<0.05为差异有统计学意义。
2 结果
2.1 TAM的鉴定
2.1.1 巨噬细胞表面标志物表达特征 流式细胞仪分析显示,THP-1 细胞经过PMA 刺激后分化成为M0 巨噬细胞,其表面分子CD14 阳性表达率为(6.97±0.31)% ,CD206 的阳性表达率为(5.64±0.50)%;继续给予IL-4和IL-13刺激后,诱导分化生成的M2 型巨噬细胞CD14 阳性表达率为(59.89±1.01)%,CD206 阳性表达率为(62.7±1.97)%,符合M2型巨噬细胞的特征,见图1。

Fig.1 The characteristics of cell surface markers CD14 and CD206 in TAM图1 TAM表面标志物CD14、CD206的表达特征
2.1.2 不同诱导条件下巨噬细胞IL-10 mRNA 及CCL2 mRNA 表达水平 qPCR 结果显示,M2型巨噬细胞内IL-10 mRNA 水平与M0 型巨噬细胞相比明显升高(3.47±0.15vs. 1.00±0.02,n=6,t=28.270,P<0.01);M2 型巨噬细胞内CCL2 mRNA 水平与M0 型巨噬细胞相比明显升高(6.38±0.19vs.0.91±0.18,n=6,t=35.960,P<0.01)。
2.2 TAM对Nab-PTX干预MDA-MB-231细胞增殖的影响 CCK-8 结果显示,与对照组和TAM 组相比,Nab-PTX 组24、48 和72 h 细胞增殖水平下降(P<0.01);与Nab-PTX 组相比,TAM+Nab-PTX 组24、48和72 h细胞增殖水平升高(P<0.01),见表1。
Tab.1 Comparison of proliferation of MDA-MB-231 cells at different time points between four groups表1 4组MDA-MB-231细胞不同时间点增殖情况比较(n=3,OD490,)
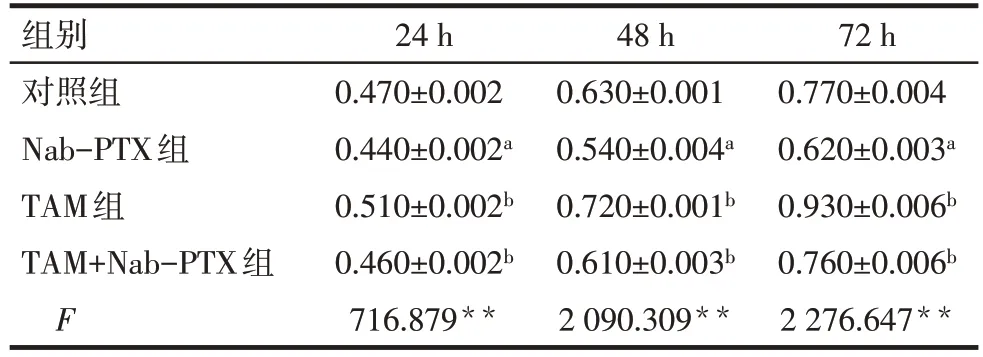
Tab.1 Comparison of proliferation of MDA-MB-231 cells at different time points between four groups表1 4组MDA-MB-231细胞不同时间点增殖情况比较(n=3,OD490,)
**P<0.01;a 与对照组比较,b 与Nab-PTX 组比较,P<0.05。表3、4同。
组别对照组Nab-PTX组TAM组TAM+Nab-PTX组F 24 h 0.470±0.002 0.440±0.002a 0.510±0.002b 0.460±0.002b 716.879**48 h 0.630±0.001 0.540±0.004a 0.720±0.001b 0.610±0.003b 2 090.309**72 h 0.770±0.004 0.620±0.003a 0.930±0.006b 0.760±0.006b 2 276.647**
2.3 TAM对Nab-PTX干预MDA-MB-231细胞凋亡的影响 流式细胞术检测显示,对照组、Nab-PTX组、TAM 组和TAM+Nab-PTX 组细胞凋亡率(%)分别为5.81±0.10、20.21±2.54、2.06±0.91和12.68±0.51,组间比较差异有统计学意义(n=3,F=79.338,P<0.01)。与对照组相比,Nab-PTX组细胞凋亡率升高(P<0.01);与Nab-PTX 组相比,TAM+Nab-PTX 组细胞凋亡率降低(P<0.01),见图2。
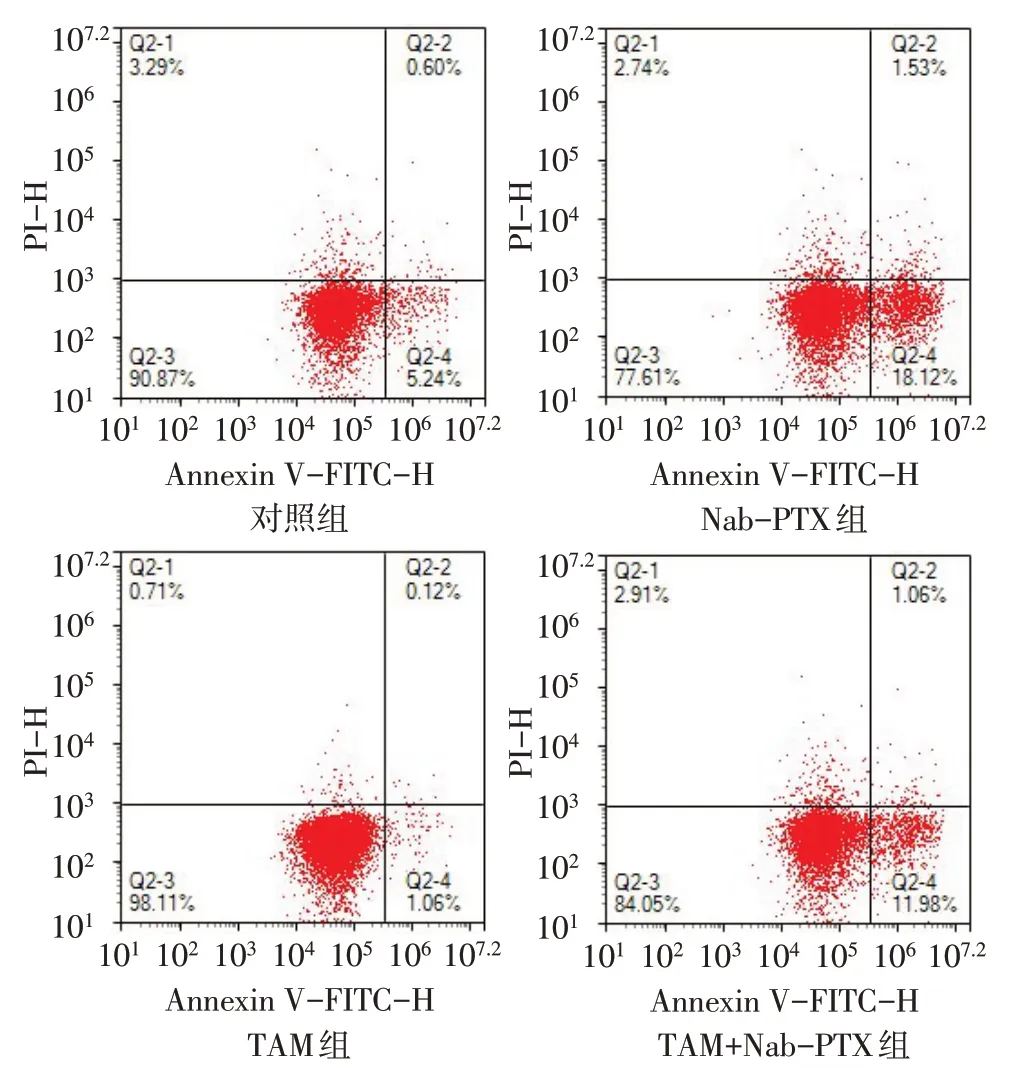
Fig.2 Effects of TAM on apoptosis of MDA-MB-231 cells induced by Nab-PTX图2 TAM对Nab-PTX干预MDA-MB-231细胞凋亡的影响
2.4 IGF-1R 抑制剂对TAM 诱导的MDA-MB-231细胞耐药的影响 CCK-8 结果显示,与TAM+Nab-PTX 组相比,IGF-1R 抑制剂组24、48 和72 h 细胞增殖水平均降低(P<0.01),见表2。流式细胞实验结果显示,与TAM+Nab-PTX 组相比,IGF-1R 抑制剂组MDA-MB-231 细胞凋亡率(%)增高(23.09±0.86vs.12.71±0.62,n=3,t=16.893,P<0.01),见图3。
Tab.2 Comparison of proliferation of MDA-MB-231 cells at different time points between two groups表2 2组MDA-MB-231细胞不同时间点增殖情况比较(n=3,OD490,)

Tab.2 Comparison of proliferation of MDA-MB-231 cells at different time points between two groups表2 2组MDA-MB-231细胞不同时间点增殖情况比较(n=3,OD490,)
**P<0.01。
组别TAM+Nab-PTX组IGF-1R抑制剂组t 24 h 0.460±0.002 0.420±0.001 19.290**48 h 0.610±0.003 0.500±0.003 42.832**72 h 0.760±0.006 0.560±0.003 45.987**

Fig.3 Effects of IGF-1R inhibitors on apoptosis of MDA-MB-231 cells co-cultured with TAM图3 IGF-1R抑制剂对TAM共培养MDA-MB-231细胞凋亡的影响
2.5 TAM 对Nab-PTX 干预MDA-MB-231 细胞中MDR1 和Caspase-3 mRNA 的表达影响 qPCR 结果显示,与对照组相比,Nab-PTX 组MDA-MB-231 细胞内MDR1 mRNA 水平降低,Caspase-3 mRNA 水平升高(P<0.01);与Nab-PTX组相比,TAM+Nab-PTX组MDR1 mRNA 水平升高,Caspase-3 mRNA 水平降低(P<0.05),见表3。
Tab.3 Comparison of MDR1 mRNA and Caspase-3 mRNA expression between four groups of MDA-MB-231 cells表3 4组MDA-MB-231细胞MDR1和Caspase-3 mRNA表达的比较(n=3,)
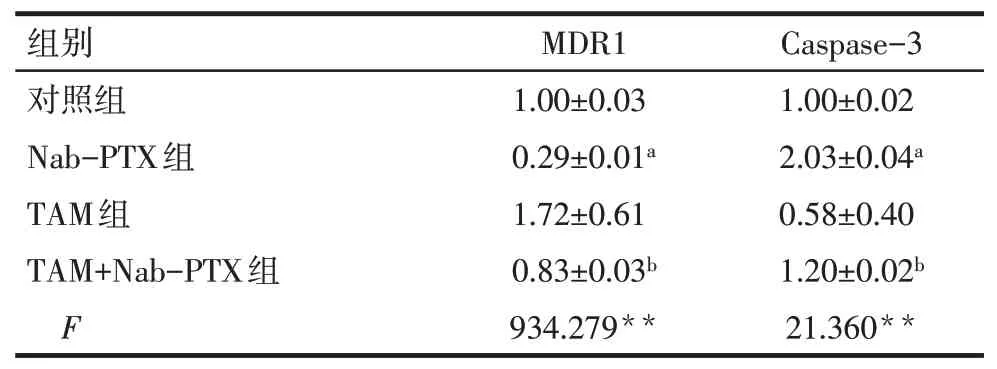
Tab.3 Comparison of MDR1 mRNA and Caspase-3 mRNA expression between four groups of MDA-MB-231 cells表3 4组MDA-MB-231细胞MDR1和Caspase-3 mRNA表达的比较(n=3,)
**P<0.01。
组别对照组Nab-PTX组TAM组TAM+Nab-PTX组F MDR1 1.00±0.03 0.29±0.01a 1.72±0.61 0.83±0.03b 934.279**Caspase-3 1.00±0.02 2.03±0.04a 0.58±0.40 1.20±0.02b 21.360**
2.6 TAM 对Nab-PTX 干预MDA-MB-231 细胞中IGF-1R 信号通路关键蛋白表达影响 Western blot结果显示,与对照组比较,Nab-PTX组p-IGF-1R、p-AKT及p-ERK均降低,TAM组p-IGF-1R、p-AKT及p-ERK 均升高(P<0.01);与Nab-PTX 组比较,TAM+Nab-PTX 组中p-IGF-1R、p-AKT 及p-ERK 均升高(P<0.01),见表4、图4。
Tab.4 Comparison of protein expression levels of p-IGF-1R,p-AKT and p-ERK between MDA-MB-231 cells of each group表4 各组MDA-MB-231细胞内p-IGF-1R、p-AKT、p-ERK蛋白表达水平比较 (n=6,)
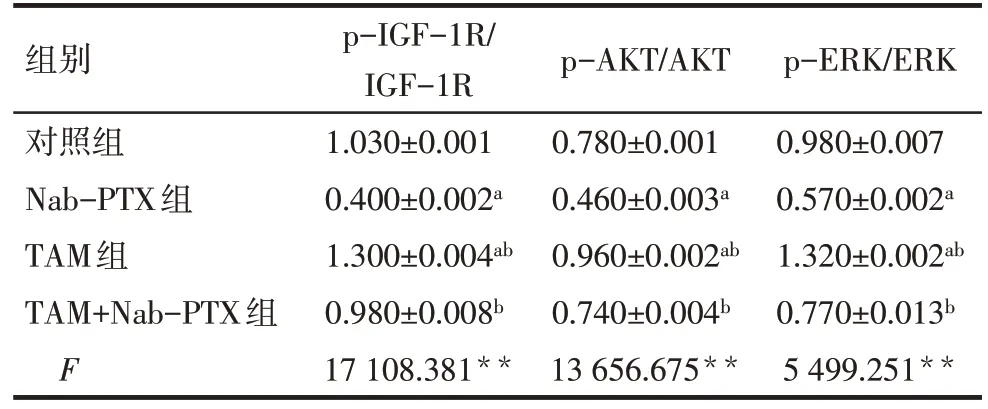
Tab.4 Comparison of protein expression levels of p-IGF-1R,p-AKT and p-ERK between MDA-MB-231 cells of each group表4 各组MDA-MB-231细胞内p-IGF-1R、p-AKT、p-ERK蛋白表达水平比较 (n=6,)
**P<0.01。
组别对照组Nab-PTX组TAM组TAM+Nab-PTX组F p-IGF-1R/IGF-1R 1.030±0.001 0.400±0.002a 1.300±0.004ab 0.980±0.008b 17 108.381**p-AKT/AKT 0.780±0.001 0.460±0.003a 0.960±0.002ab 0.740±0.004b 13 656.675**p-ERK/ERK 0.980±0.007 0.570±0.002a 1.320±0.002ab 0.770±0.013b 5 499.251**
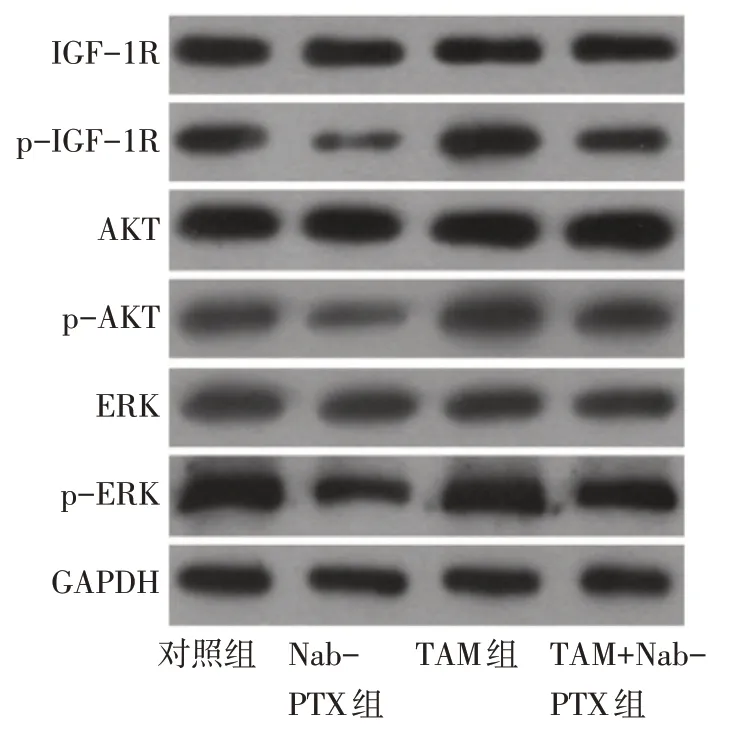
Fig.4 The protein expression levels of IGF-1R,p-IGF-1R,AKT,p-AKT,ERK and p-ERK in each group图4 Western blot检测各组MDA-MB-231细胞内IGF-1R、p-IGF-1R、AKT、p-AKT、ERK、p-ERK蛋白表达
2.7 IGF-1R 抑制剂对MDA-MB-231 细胞MDR1 mRNA 和Caspase-3 mRNA 的表达的影响 IGF-1R抑制剂组MDA-MB-231 细胞内MDR1 mRNA 水平(0.39±0.02)与TAM+Nab-PTX 组(1.00±0.04)相比降低(n=3,t=23.625,P<0.01),IGF-1R 抑制剂组Caspase-3 mRNA水平(3.05±0.08)与TAM+Nab-PTX组(1.00±0.03)相比升高(n=3,t=31.973,P<0.01)。
2.8 IGF-1R 抑制剂对MDA-MB-231 细胞IGF-1R信号通路关键蛋白的表达影响 与TAM+Nab-PTX组相比,IGF-1R 抑制剂组MDA-MB-231 细胞内p-IGF-1R、p-AKT、p-ERK 的表达明显降低(P<0.01),见表5、图5。
Tab.5 Comparison of p-IGF-1R,p-AKT and p-ERK rations between the two groups of cells表5 2组细胞内p-IGF-1R、p-AKT、p-ERK比较(n=6,)

Tab.5 Comparison of p-IGF-1R,p-AKT and p-ERK rations between the two groups of cells表5 2组细胞内p-IGF-1R、p-AKT、p-ERK比较(n=6,)
**P<0.01。
组别TAM+Nab-PTX组IGF-1R抑制剂组t p-IGF-1R/IGF-1R 1.280±0.014 0.500±0.009 77.249**p-AKT/AKT 1.120±0.020 0.450±0.002 57.151**p-ERK/ERK 0.860±0.006 0.420±0.001 119.965**
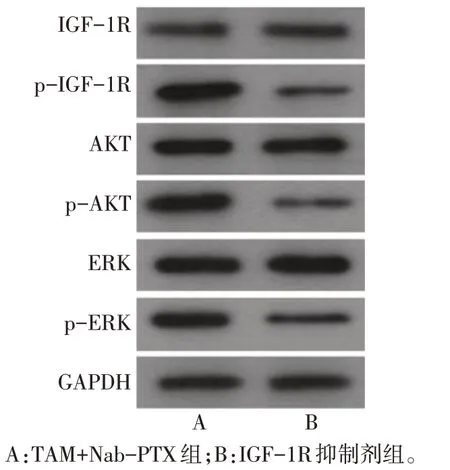
Fig.5 Western blot assay of the TAM+Nab-PTX group and the IGF-1R inhibitor group图5 TAM+Nab-PTX组和IGF-1R抑制剂组蛋白表达印迹图
3 讨论
Nab-PTX 是治疗TNBC 的常用药物之一,但易产生化疗耐药。目前研究聚焦于肿瘤微环境中各类细胞在耐药中的作用。在复杂的肿瘤微环境中,巨噬细胞可以被募集到肿瘤区域,并被极化为M1 或M2 型,然而TAM 主要表现出M2 样极化状态[12],具有免疫抑制作用,同时细胞内表达相对较高的IL-10、CCL2 水平[5,13]。研究发现,TAM 在体外和体内都能通过激活NF-κB信号减弱药物对TNBC细胞的杀伤作用,减少肿瘤细胞的凋亡[14]。本研究结果显示,与Nab-PTX 组相比,TAM+Nab-PTX 组细胞增殖率升高、凋亡率下降,与上述研究[14]结果相似,说明TAM 可降低MDA-MB-231 细胞对Nab-PTX 敏感性,具有保护肿瘤细胞的作用。因此,寻找TAM 保护肿瘤细胞的机制对逆转TNBC耐药至关重要。
MDR1 可将进入细胞内的药物泵出细胞外,降低药物在细胞内的生物利用度,进而引发细胞耐药[15]。本研究中,与Nab-PTX 组相比,TAM+Nab-PTX组MDA-MB-231细胞内MDR1 mRNA表达量均升高,凋亡相关因子Caspase-3 mRNA 表达均降低,提示TAM 可能通过MDR1 降低药物在细胞内的生物利用度和抑制细胞凋亡级联反应,进而降低MDA-MB-231 细胞对Nab-PTX 的化疗敏感性。IGF-1R 作为IGF 系统中重要的受体,与IGF1 和IGF2 结合后,触发其酪氨酸激酶结构域的转磷酸化,激活下游的AKT和ERK通路,诱导细胞增殖、抑制细胞凋亡[16]。Ireland等[17]对浸润性乳腺癌患者的活检组织进行免疫组织化学染色,结果显示,M2 型巨噬细胞包围的肿瘤细胞中p-IGF-R 水平增加,51例TNBC 患者中有45 例(88.2%)表现出IGF-1R 激活。Davison 等[18]发现IGF-1 通过激活AKT 和ERK通路增强体外TNBC细胞的增殖,IGF-1R/胰岛素受体(IR)酪氨酸激酶抑制剂可改善TNBC 细胞耐药。Liu等[19]发现,AKT和ERK通路参与MDR1表达的调控,AKT 及ERK 阻断剂能抑制TNBC 细胞内MDR1 mRNA 的上调。本研究中TAM 组和TAM+Nab-PTX组MDA-MB-231 细胞中的IGF-1R 及下游ERK 和AKT信号通路被激活,提示TAM可能通过激活IGF-1R及下游AKT和ERK信号通路提高MDR1的表达,下调Caspase-3 表达,降低MDA-MB-231 细胞对Nab-PTX 的化疗敏感性。本研究还发现IGF-1R 抑制剂可以提高Nab-PTX 对TAM 共培养MDA-MB-231细胞的杀伤作用,为进一步评估IGF-1R 抑制剂联合Nab-PTX治疗TNBC提供了理论依据。
综上所述,TAM 可引起TNBC 细胞对Nab-PTX耐药,其机制可能与TAM 激活肿瘤细胞内IGF-1R及下游AKT和ERK信号通路有关,提示靶向TAM或阻断肿瘤细胞中的IGF-1R 是一种有潜力的耐药治疗策略。该结论未在动物体内进行验证,是否还有其他信号通路参与,需后续深入研究。



