单 强,王 雪,朱要宏,王九峰
(中国农业大学动物医学院,北京 100193)
抗生素是目前防治家畜疾病的重要手段,随着抗生素的滥用,导致致病菌耐药性增加,畜禽产品中抗生素残留等问题,对食品安全和疾病防治带来了巨大挑战。中国农业农村部在2021年10月21日印发了《全国兽用抗菌药使用减量化行动方案(2021—2025年)》,因此寻找潜在的抗生素替代物防治致病菌的感染是迫切需要的。随着益生菌防治家畜疾病方面研究的深入,越来越多种类的益生菌被发现,而乳酸菌仍然是益生菌的主要群体。乳酸菌具有免疫活性,可用作饲料补充剂来预防奶牛乳房炎[1]。我国农业农村部发布的《饲料添加剂品种目录(2013)》中规定乳酸乳杆菌可以作为饲料添加剂添加在养殖动物的饲料中(附表1)。乳酸菌属细菌大多数是从人类肠道、口腔和泌尿生殖道中分离出来,其中鼠李糖乳杆菌可以抑制各种细菌病原体的生长并防止黏附[2]。本文就鼠李糖乳杆菌在动物疾病防治方面进行阐述,为开发鼠李糖乳杆菌作为抗生素替代物在家畜疾病防治和食品安全的应用中提供参考。
1 鼠李糖乳杆菌
鼠李糖乳杆菌(Lactobacillusrhamnosus)是革兰阳性菌,属于乳杆菌属鼠李糖亚种,兼性厌氧,耐酸,适合生长的pH在5.5~6.2,最适生长温度在30~40 ℃,培养在MRS培养基中。鼠李糖乳杆菌多见于人和动物的肠道内容物、粪便及生殖道内,也出现在牛奶及乳制品中,其中研究较多的益生菌菌株鼠李糖乳杆菌GR-1(LGR-1)和鼠李糖乳杆菌GG(LGG)分别分离自一名健康白人女性的远端尿道和一名健康志愿者粪便样本,两者在蛋白的分泌和编码基因有着一定的差别(表1)[2-3]。

表1 LGR-1与LGG的区别Table 1 Difference between LGR-1 and LGG
国内外大量研究证明鼠李糖乳杆菌具有黏附黏膜表面、抑制病原体生长、破坏生物膜、产生生物表面活性剂和调节免疫的能力[4-9]。而在研究中不仅鼠李糖乳杆菌单独使用有着良好的动物疾病防治效果,还在与其他益生菌联合使用中发挥很好的作用[10](表2)。鼠李糖乳杆菌GR-1是研究最多的女性阴道益生菌菌株,在家畜的应用研究方面,大多数集中在防治奶牛的疾病中。研究发现LGR-1可以保护紧密连接蛋白,调控线粒体自噬途径,介导MAPK信号通路,抑制NF-κB相关的通路蛋白的表达、K+外排、活性氧(reactive oxygen species, ROS)累积、炎症反应、细胞凋亡和细胞焦亡,进而有效防治多种致病菌引起的奶牛乳房炎和奶牛子宫内膜炎[11-19]。
从胃肠道分泌物中分离的LGG是目前研究最多的益生菌菌株,在奶牛、水牛和家猪上都有研究。当LGG单独饲喂给犊牛时,有利于犊牛瘤胃发育和早期断奶,使瘤胃中的细菌群落组成多样化并在肠道转运中存活下来,调节瘤胃和肠道微生物的平衡[20-22]。而用LGG进行体内乳房治疗具有由体细胞数(somatic cell count, SCC)评估的短暂的促炎活性,并且能够在接种6 d后改变牛奶的微生物群,但还需要更适宜的方法才能在体内使用[23]。当荷斯坦犊牛采食含有黄曲霉毒素B1的饲料时,用LGG可以促进粪便中毒素的排出,减少胃肠道对毒素的吸收,减轻了毒素的肝毒性作用[24]。LGG可以通过保护紧密连接蛋白、维持肠上皮屏障完整性,调节TLR表达,抑制MAPK和NF-κB信号通路,减弱NLRP6,降低炎性细胞因子表达,加速致病菌的清除,减少致病菌在空肠中定植和易位到肝脏、脾脏和血液中,改善肠道的组织病理学变化和肠道屏障功能,调节肠道菌群,增强肠道抗体防御来减轻家猪胃肠道的炎症损伤和致病菌感染[25-32]。在仔猪日粮中添加LGG后,可以改善生长性能,促进仔猪肠道固有层的早期B细胞分化和发育,调节肠道菌群,降低腹泻率,增强肠黏膜的生物、物理和免疫屏障[33-35]。当断奶仔猪被猪轮状病毒感染引起胃肠炎后,LGG可以抑制病毒增殖并改善空肠黏膜屏障功能[36]。而给用人类轮状病毒感染猪建立的肠胃炎模型饲喂LGG后,能够抑制不受控制的自噬和肠道损伤,并预防上皮损伤,对改善轮状病毒腹泻具有中等疗效[37-38]。LGG能够改善人轮状病毒感染的人源肠道菌群移植后的新生仔猪肠道微生物群,增强疫苗免疫原性和保护功效[39]。当日粮被脱氧雪腐镰刀菌烯醇污染后,LGG可以减轻毒素诱导断奶仔猪的肠道损伤,减轻毒素引起的不良反应和肾脏抗氧化系统的损害,缓解Sirt3表达的降低,改善线粒体超微结构异常和线粒体功能障碍[40-41],且鼠李糖乳杆菌RC007也能降低脱氧雪腐镰刀菌烯醇引起断奶仔猪组织学改变、促炎反应、MAP激酶的细胞旁通透性和磷酸化[42]。
在研究中发现鼠李糖乳杆菌LGG分泌的胞外多糖也有很好的益生作用,可通过Bax/Bcl-2和Keap1/Nrf2信号通路有效缓解H2O2引起猪肠上皮细胞的氧化损伤和细胞凋亡并上调细胞内紧密连接相关蛋白[43]。鼠李糖乳杆菌ATCC 7469能够保护被大肠杆菌破坏的猪肠上皮细胞间紧密连接蛋白[44]。鼠李糖乳杆菌LB1可以减少大肠杆菌引起的仔猪腹泻、氧化应激和死亡,调节血液细胞结构和生化指标,提高猪的免疫能力和抗氧化应激能力,恢复肠道完整性[45]。鼠李糖乳杆菌HN001可以通过增加分泌过敏原特异性IFN-γ的外周血单个核细胞的频率以及由过敏原特异性细胞的IL-10来有效缓解猪蛔虫过敏原引起的断奶仔猪过敏,且减轻早产仔猪坏死性小肠结肠炎严重程度[46-47]。
在很多的研究中,发现鼠李糖乳杆菌与其他的菌株或者添加剂配合也可以达到很好的治疗效果。日粮中添加LGG和植物乳杆菌JL01可以减少琥珀酸和棕榈酸的积累,增加TCDA和DHA的积累来调节细胞因子水平,增强断奶仔猪的免疫力来减轻断奶应激[48]。LGG和可可粉的组合对仔猪的粪便微生物群的组成和功能有影响[49]。鼠李糖乳杆菌32和丙酸杆菌P63可以增加瘤胃纤维素酶的活性,减少CH4的排放[50]。
由鼠李糖乳杆菌CECT278、乳酸片球菌CECT5915和罗伊乳杆菌DSM20016组成的乳酸菌组合能够调节阴道内的致病环境,减少子宫内膜中大肠杆菌的数量或无基底组织炎症,降低感染标志物B-防御素和MUC1表达来缓解大肠杆菌引起的奶牛子宫内膜上皮细胞炎性损伤和经产奶牛的炎症发生[51-52]。同样,由鼠李糖乳杆菌CECT278、乳酸片球菌CECT5915、罗伊乳杆菌DSM20016和清酒乳杆菌DSM20100组成的乳酸菌组合能够使促炎细胞因子IL-8和IL-1β的表达显着下降,缓解大肠杆菌引起的奶牛子宫内膜上皮细胞炎性损伤[53]。
2 鼠李糖乳杆菌的作用机理
2.1 调节微生物菌群平衡
所有哺乳动物体内都共生着对宿主的正常形态和功能至关重要的微生物菌群[54]。微生物群稳态可以保持肠道微生物群在宿主代谢和功能中的重要作用[55]。肠道中的微生态系统维持着微生物菌群与其宿主在不同发育阶段的动态生理性组合,在环境发生变化时,将引起肠道菌群失调症[10]。肠道微生物群组成的改变主要取决于各种遗传、营养和环境因素,而当其发生改变时会引起肠道通透性、消化和代谢以及免疫反应的改变[56]。
肠道微生物菌群平衡的改变会导致胃肠道和代谢疾病的发生[56]。LGR-1有助于重建健康阴道菌群,抑制大肠菌群的生长,从而预防复发性尿路感染[57]。其被多次证实可以维持阴道微生物群并干扰异常微生物群[2]。Zhang等[20]在断奶前向新生犊牛饲喂LGG使瘤胃中的细菌群落组成多样化,并调节瘤胃和肠道微生物的平衡。在乳房内注射灭活的LGG能够在接种6 d后轻微改变牛奶的微生物群[23]。LGG可以有效缓解大肠杆菌K88感染导致的仔猪腹泻,其可能与调节肠道菌群有关[29]。在试验第八天给灌服肠道型沙门菌4,[5],12:i:-后导致断奶仔猪肠道菌群紊乱,而LGG提前给药一周后使重组微生物-微生物相互作用,并改变回肠微生物群及其相关的特异性CD3-CD19-T-bet+IFNγ+/-细胞亚群稳态[31]。焦连国[35]研究发现沙门菌感染会使仔猪胃肠道菌群形成一个以普雷沃菌科NK3B31族群为中心的网络互作菌,而LGG会减弱沙门菌引起的普雷沃菌科NK3B31族群丰度的增加,并协同增加了梭杆菌属、动物乳杆菌及丙酸杆菌属的丰度。崔志文[3]在仔猪出生后灌服鼠李糖乳杆菌LR6001能够通过促进肠道微生态平衡,增强肠黏膜物理屏障、化学屏障以及免疫屏障功能来改善肠道健康促进仔猪断奶前后的生长并减少腹泻。鼠李糖乳杆菌可以有效调节微生物菌群平衡,从而抑制有害菌的生长,预防疾病的产生。

表2 鼠李糖乳杆菌的功能与应用

(转下页 Carried forward)(续表2 Continued)
2.2 维持上皮细胞完整性
肠道、阴道、子宫内膜和乳腺上皮细胞的完整性对维持健康至关重要。当上皮细胞被破坏或破裂时,外表面上的微生物会进入组织和血流,从而引发疾病[9]。上皮细胞顶端表面的黏液层为微生物提供了很大的障碍,而下一道防线就是上皮细胞之间的紧密连接,其将内膜的顶端和基底外侧隔开[58]。上皮细胞损伤后细菌穿透到下面的基质,往往会引起细胞损伤和细胞溶解并引发炎症反应(图1)[58]。紧密连接蛋白的上调可能有助于限制炎症过程或病原体对上皮造成的损伤[9]。有研究发现,益生菌的关键作用是通过调节上皮屏障功能、刺激上皮细胞之间的紧密连接、维持上皮细胞的完整性和诱导黏液产生来发挥作用的[59]。Shan等[11]研究发现LGR-1能够保护被蜡样芽胞杆菌破坏的奶牛乳腺上皮细胞间紧密连接的完整性和紧密连接蛋白ZO-1和Occludin的表达。Zhang等[44]用鼠李糖乳杆菌ATCC 7469增加了产肠毒素大肠杆菌感染猪肠上皮细胞破坏的ZO-1和Occludin蛋白的表达,从而增强屏障功能并限制病原体入侵。LGG预处理通过上调紧密连接蛋白的表达来显着增强LPS破坏的仔猪肠道屏障。同样,LGG胞外多糖也是通过上调细胞间紧密连接相关蛋白来缓解H2O2造成猪肠上皮细胞的损伤[43]。紧密连接结构对于维持细胞的完整性,防止炎症的产生起着重要的作用,鼠李糖乳杆菌及其分泌的多糖能够通过保护紧密连接结构缓解病原体引起的炎症及损伤。
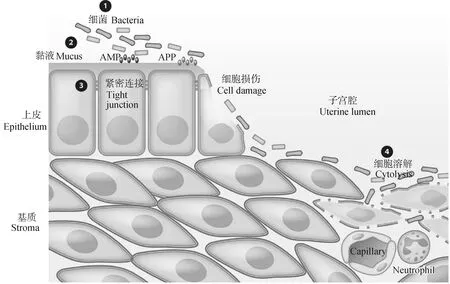
A.P.抗菌肽;APP.急性期蛋白 AMP.Antimicrobial peptides;APP.Acute phase proteins图1 炎症的发展(子宫内膜炎)[58]Fig.1 Development of inflammation(endometritis)[58]
2.3 增强免疫力,抑制炎症和凋亡发生
免疫系统失调是促进致病菌感染的重要因素之一,研究发现乳酸杆菌可以通过调节多个免疫系统信号通路抑制致病菌感染,但不会诱导炎症以保护宿主免受炎性损伤[60]。LGG能够诱导肿瘤坏死因子TNF-α的表达升高,而对IL-2、IL-12、IL-23和IL-27的表达没有影响[61]。LGR-1可以缓解致病菌引起奶牛乳腺上皮细胞的炎症反应、凋亡以及焦亡,从而起到保护作用[11-13]。而刘宁[16]也研究发现LGR-1可以缓解化脓隐秘杆菌引起奶牛子宫内膜上皮细胞的K+外排而引起的炎症反应和细胞凋亡。刘佳玮等[18]和Liu等[19]研究发现LGR-1通过介导MAPK信号通路,抑制NF-κB相关通路蛋白的表达调节,抑制奶牛子宫内膜上皮细胞炎性损伤的发生。用LPS刺激猪肠上皮细胞形成肠炎模型,LGG通过调节TLR表达,来抑制MAPK和NF-κB信号通路降低炎性细胞因子表达,进而抑制炎症的发生,具有免疫调节作用[25]。LGG还可以通过抑制NF-κB通路及减弱NLRP6,防止鼠伤寒沙门菌刺激仔猪肠道产生的过度炎症反应,并且减少有害菌在空肠中定植和易位到肝脏、脾脏和血液中,部分改善了肠道的组织病理学变化,降低了空肠和血浆中的IL-8水平以及空肠中的IL-12/23 p40[26,31]。鼠李糖乳杆菌HN001通过增加分泌过敏原特异性IFN-γ的外周血单个核细胞的频率以及由过敏原特异性细胞的IL-10来抑制猪蛔虫过敏原引起的断奶仔猪过敏[46]。使用复合益生菌鼠李糖乳杆菌CECT278、乳酸片球菌CECT5915、罗伊乳杆菌DSM20016和清酒乳杆菌DSM20100可抑制大肠杆菌引起的奶牛子宫内膜上皮细胞感染和炎症的发生,并调节促炎细胞因子IL-8和IL-1β的表达显着下降[53]。鼠李糖乳杆菌可以增强家畜机体免疫力,在预防致病菌感染引起的炎症反应和凋亡表现出良好的效果。
2.4 抑制病原体生长和黏附
鼠李糖乳杆菌的一个关键的益生作用是产生乳酸,所产生的乳酸可以使所处环境的pH降至4.5以下,从而产生了抑制细菌和病毒等病原体入侵及生长的作用[62]。LGR-1可产生L-乳酸、H2O2和细菌素类化合物,这些物质可以通过改善上皮的屏障功能,抑制泌尿生殖道和肠道病原体来抑制炎症的产生[6-7]。其产生的特有的乳酸异构体也被证明能够杀死病毒[2]。生物膜是黏附在表面以提供生理优势的生物群落,生物膜为细菌提供了抗微生物剂和宿主免疫系统的保护,此外还对一些乳酸杆菌产生的防御因子(如乳酸、H2O2和细菌素)具有抵抗力[63]。当病原体的生物膜形成后,很难用传统抗生素清除,且复发率高。而LGR-1是迄今为止唯一能在体外穿透这些生物膜的菌株,可能能够比抗生素更好地预防或破坏病原体相关生物膜,且不会增加耐药性[64]。LGR-1可以通过抑制生长、减少菌丝分化和抑制生物膜形成相关基因,抑制非生物表面上白色念珠菌菌株的生物膜形成[65-66]。研究发现LGR-1还有抑制和破坏阴道加德纳菌和阴道阿托波菌生物膜的能力[7]。
致病菌黏附于上皮细胞主要通过细胞膜表面的凝集素与细胞表面的糖结合受体的结合。乳酸杆菌能够竞争抑制多种致病菌的黏附,甚至在致病菌黏附后,其仍可以替换黏附,主要是通过凝集素样黏附素及蛋白质样细菌表面分子来发挥作用。凝集素样蛋白1(Llp1)作为LGR-1被研究的第一个细胞壁分子,其在LGR-1的黏附能力中具有潜在作用,还可抑制泌尿生殖道相关病原体的黏附和生物膜形成[67]。LGR-1 Llp1与一种鞘糖脂GQ1受体结合,存在于多种上皮细胞和重要的细菌凝集素受体上[68]。LGR-1 Llp1可以预防和破坏尿路中致病性大肠杆菌的生物膜结构,并干扰金黄色葡萄球菌菌株与阴道上皮细胞的黏附[69-70]。
3 鼠李糖乳杆菌在疾病预防应用
3.1 鼠李糖乳杆菌在奶牛乳房炎上的应用
乳房炎是一种影响奶牛健康和人类食品安全的疾病,被认为是乳制品行业发展的最大难题。多年来,抗生素一直是治疗乳房炎的主要办法,然而随着抗生素的滥用,导致了耐药菌株的出现和药物残留的存在,增加了乳房炎治疗的难度和食品安全隐患。乳酸菌可以通过形成保护性生物膜在乳腺中进行定植,从而抑制导致乳房炎的病原体生长来预防乳房炎的发生[71]。有研究发现,从牛乳中分离出的Lactococcuslactissubsp.lactisCRL 1655和LactobacillusperolensCRL 1724能够黏附在乳头管上皮细胞并抑制病原体[72]。LGR-1也可以保护蜡样芽胞杆菌引起奶牛乳腺上皮细胞紧密连接结构的损伤和炎症反应[11]。而Li等[12]和Wu等[13]研究发现LGR-1可以通过调控线粒体自噬途径,抑制ROS累积、炎症反应、细胞凋亡和焦亡来预防乳房炎的产生。
肠道菌群在宿主的健康中发挥着重要作用,其代谢产物包括脂多糖和短链脂肪酸。抗生素的过量使用会杀死消化道中的大部分微生物,导致肠道微生物群失衡,破坏肠道中通常存在的生态系统。肠道菌群失调后瘤胃中LPS的过量产生会导致瘤胃上皮损伤,从而LPS进入血液,一方面损伤了肝功能,另一方面会通过循环进入乳腺,增加血液屏障的通透性并导致乳房炎症的产生[73]。而由肠道菌群作为发酵产物产生的短链脂肪酸对乳房炎症反应具有保护作用,并有助于维持血乳屏障的功能[73]。在日粮中添加乳酸菌,可能会缓解肠道菌群的失衡,进而预防乳房炎,这为益生菌作为潜在的抗生素替代物提供了理论基础[20]。
3.2 鼠李糖乳杆菌在奶牛子宫内膜炎上的应用
健康奶牛在妊娠期间,子宫处于无菌状态。而当其生产后,外界细菌经松弛的阴门、阴道和扩张的子宫颈口进入子宫腔内,且产后子宫内营养物质丰富,温度适合细菌繁殖,进而细菌大量繁殖污染子宫内环境产生炎症[74]。在正常情况下,奶牛机体可以依靠自身清除病原体,进行修复,而如果奶牛机体无法进行及时完全的病原体清除后,病原菌进行大量繁殖,子宫内膜发生炎性损伤,导致子宫内膜炎的发生[74]。母畜生殖道的微生物感染是不育和死亡的重要原因。子宫内膜由一层单柱状上皮细胞组成,是母畜生殖道抵御病原体的第一层屏障,覆盖在含有血管和免疫细胞以及子宫内膜基质细胞基质上的黏膜层[75]。子宫内膜上皮细胞位于子宫内表面,可与子宫腔直接接触,是子宫先天性免疫的一部分,发挥着哨兵的作用[74]。Liu等[15]研究发现LGR-1可以通过减少由蜡状芽胞杆菌分泌的毒素在奶牛子宫内膜上皮细胞膜表面穿孔引起的K+流出到细胞外来抑制炎症反应和细胞凋亡。有研究发现,LGR-1可以有效介导MAPK信号通路调节细胞炎性损伤,抑制NF-κB和MAPK相关的通路蛋白的表达,减少大肠杆菌诱导的奶牛子宫内膜上皮细胞的细胞凋亡和炎症反应[17-19]。而多种益生菌的配合使用也能够达到一定的效果。鼠李糖乳杆菌CECT278、乳酸片球菌CECT5915和罗伊乳杆菌DSM20016能够调节阴道内的致病环境,减少子宫内膜中大肠杆菌的数量,降低感染标志物B-防御素和MUC1[51-52]。鼠李糖乳杆菌CECT278、乳酸片球菌CECT 5915、罗伊乳杆菌DSM 20016和清酒乳杆菌DSM 20100的益生菌组合能够调节大肠杆菌引起的奶牛子宫内膜感染和炎症,促炎细胞因子IL-8和IL-1β的表达显着下降[53]。
3.3 鼠李糖乳杆菌在仔猪肠胃炎上的作用
研究表明出生前的仔猪肠道处于无菌状态,而出生后由于接触到母猪的产道、粪便以及环境中的微生物后,出现了兼性厌氧菌[35]。随着仔猪生长中母猪的哺乳和胃肠道中环境的不同,导致其个体产生明显差异,体内胃肠道的菌群也存在差异,并且这种状态由于仔猪肠道形态结构发育的不成熟,在生长期间,仔猪的肠道菌群一直处于变化状态,直到育肥期[35,76]。Wang等[34]研究发现新生仔猪口服LGG通过改善肠黏膜的生物、物理和免疫屏障,来改善断奶前仔猪的肠道健康。给断奶仔猪饲喂LGG后,可以调节肠道菌群,改善生长性能,降低腹泻率[35]。鼠李糖乳杆菌不仅可以改善健康仔猪的胃肠道健康,还可以缓解感染病原体的仔猪炎症发生。LGG可以抑制NF-κB通路并减弱NLRP6,加速致病菌的清除,防止过度炎症反应来缓解沙门菌引起的仔猪肠道炎症的发生[27-28]。大肠杆菌引起的仔猪肠道炎症也能够通过LGG调节肠道菌群、增强肠道抗体防御和调节炎症细胞因子来缓解[29]。有研究应用LPS进行仔猪肠炎造模后,通过LGG的预防可以减轻肠道炎症,改善肠道屏障功能,并调节受到LPS刺激的仔猪代谢物谱[30]。在早产仔猪感染鼠伤寒沙门菌后,LGG可以通过减少有害菌在空肠中定植和易位到肝脏、脾脏和血液中,部分改善了肠道的组织病理学变化,降低了空肠和血浆中的IL-8水平以及空肠中的IL-12/23 p40来缓解炎症反应[32]。鼠李糖乳杆菌ATCC 7469可以通过保护紧密连接蛋白和抗炎作用来缓解大肠杆菌诱导猪肠上皮细胞产生的炎症[44]。鼠李糖乳杆菌LB1也可以减少大肠杆菌引起仔猪腹泻、氧化应激和死亡,调节血液细胞结构和生化指标,提高猪的免疫能力和抗氧化应激能力,恢复肠道完整性[45]。
3.4 鼠李糖乳杆菌在中毒病中的应用
急性或慢性接触环境毒素导致的疾病是一个全球性问题,食物被重金属和脱氧雪腐镰刀菌烯醇等污染是一个不容忽视的安全隐患。乳酸杆菌在一种被称为生物修复的过程中具有结合并去除某些重金属和其他毒素的能力,食用LGR-1可以缓解暴露在重金属环境的孕妇血液中铅和汞水平的升高[77]。研究发现,LGR-1 的吸收特性可以固定铅和镉,有效地减少它们在肠上皮的易位体外,从而减少毒素的吸收[78]。鼠李糖乳杆菌可以降低小肠上皮细胞Caco-2对有机磷农药的吸收[78]。LGG通过减轻毒素对仔猪肾脏抗氧化系统的损害,缓解Sirt3表达的降低,改善线粒体超微结构异常和线粒体功能障碍,改善毒素诱导的肠道损伤来减轻脱氧雪腐镰刀菌烯醇引起的断奶仔猪肠道损伤[40-41]。鼠李糖乳杆菌RC007可以降低脱氧雪腐镰刀菌烯醇引起断奶仔猪的组织学改变、促炎反应、MAP激酶的细胞旁通透性和磷酸化[42]。LGG也可以增加日粮被黄曲霉毒素B1污染的荷斯坦犊牛粪便中毒素的排除,减少胃肠道对毒素的吸收,减轻毒素的肝毒性作用[24]。这些研究有望为鼠李糖乳杆菌防治重金属和毒素在畜牧业应用提供理论支持。
4 小 结
近年来,随着对鼠李糖乳杆菌研究的深入,发现了越来越多适合于应用在家畜疾病防治的菌株。鼠李糖乳杆菌可以通过调节微生物菌群平衡、维持上皮细胞完整性、增强免疫力,抑制炎症和凋亡发生、抑制病原体生长和黏附等作用来预防或缓解疾病的发生和加重。鼠李糖乳杆菌目前在家畜中主要应用在乳房炎、子宫内膜炎和肠炎,这对于畜牧业养殖中是很重要的发现。其可以有效缓解致病菌对家畜机体的损伤,并且没有抗生素残留和致病菌耐药性的发生,这些发现对于鼠李糖乳杆菌未来作为潜在的替抗产品提供了可能。但目前对于鼠李糖乳杆菌在家畜体内中的应用研究还有待进一步的研究和探索。



