蔡佳炜,张 琛,靳荣帅,鲍志远,张希宇,王 璠,翟 频,赵博昊,陈 阳, 汤先伟,吴信生*
(1.扬州大学动物科学与技术学院,扬州 225009;2.江苏省农业科学院畜牧研究所,南京 210014; 3.江苏省邳州市东方养殖有限公司,邳州 221300)
近年来,随着气候的变暖,高温对畜牧业发展的影响已成为全球关注的热点[1]。适宜的温湿度、优良的饲养环境是家畜健康生长,高效生产的重要保障。热应激(heat stress,HS)指动物机体对生长环境温度升高产生的一系列非特异性防御应答的总和[2]。全球气候变暖,机体暴露在极高温度下会导致热应激的发生[3]。热应激会导致公畜精子数量、密度、畸形率等的改变,造成公畜繁殖性能的下降,甚至会出现不育的现象[4]。热应激对猪生长发育危害严重,导致种公猪睾丸退化、交配欲减退,甚至丧失生育能力[5-7],母猪初情期延迟,发情期变短,无法正常排卵,受胎率下降[8]。热应激状态下,奶牛免疫机能下降,身体能量处于负平衡状态,采食量下降、产奶量和乳制品产量均会下降[9-11]。热应激严重影响了家畜的健康、生长和繁殖性能。
家兔是恒温动物,功能性汗腺较少,在高温下,呼吸频率增加、采食量下降、体内代谢紊乱,导致生产性能下降[12]。高温条件下暴露3 h,公兔体内活性氧(ROS)、热休克蛋白(HSP)生成异常,睾丸微环境发生改变,染色质构像和DNA甲基化改变,阻碍了精子的生成,精子功能遭到破坏[13]。环境温度高于18 ℃,公兔不育发生率会显着增加[14]。研究发现,公兔精子在38~40 ℃下孵育3 h,受精率从98%下降至96%,胚胎存活率更是从59%下降到了34%[15]。热应激还会通过线粒体途径导致DNA损伤,导致DNA修复相关基因表达降低[16-18]。动物发生热应激时,体内线粒体凋亡、生殖细胞死亡-受体凋亡、AMPK等通路均会受到影响,进而影响精子的生成和发育[19-21]。
为了进一步了解家兔热应激发生的分子机制,本研究分析了种公兔在热应激和未热应激条件下的睾丸组织形态差异,并采用RNA-Seq技术筛选了不同状态下精子的差异表达基因,以探究热应激对种公兔精子发生的影响,为种公兔耐热性状的选育提供理论基础。
1 材料与方法
1.1 试验动物
课题组前期选取具有相同饲养水平,体况和体重相近的20只新西兰白兔种公兔作为试验对象。通过计算温湿度指数(THI),记录了5月和8月温湿度,将5月份定义为未热应激组(non-heat stressed, NHS),8月份定义为热应激组(heat stressed, HS)[22]。采精时间为2021年5月1~20日和8月1~20日。每组随机选取3只种公兔,将采集的精液用于转录组分析。此外,用丙泊酚加塞拉嗪麻醉后,剖开腹腔取出睾丸,用于后期组织切片的制作。
1.2 睾丸组织切片的制作及HE染色
种公兔睾丸组织在PBS中清洗3次,加入4%多聚甲醛溶液固定24 h,滤纸吸净多聚甲醛溶液,将组织依次放入由低到高浓度的酒精中脱水,然后通过二甲苯透明和石蜡包埋,将组织块固定在切片机上,切取5~7 μm的组织,温水展片,载玻片捞取,60 ℃烘箱烘干备用。
采用二甲苯去除睾丸切片中残存的石蜡,再将制作好的睾丸切片依次放入由高到低浓度的酒精中,轻轻甩掉切片上多余的水分,苏木素中浸染5 min,再用水漂洗数秒,1%盐酸乙醇处理组织切片10 s,蒸馏水下冲洗后,用0.6%氨水使组织切片返蓝,再用伊红染色液染色2 min,染色后切片经过无水乙醇脱水、二甲苯透明等过程,滴上树胶、盖上盖玻片封片,用显微镜观察卵巢形态结构。
1.3 转录组(RNA-Seq)测序分析
使用总RNA提取试剂盒(天根生化科技(北京)有限公司)提取6只新西兰种公兔精子总RNA。总RNA经纯化后检测其完整性和浓度。检测合格后,合成cDNA并构建文库。基于Illumina HiSeq 测序平台,对文库进行测序,回收测序数据。对原始下机数据进行过滤,将得到的Reads比对到参考基因组上,使用FPKM标准化对热应激组和未热应激组样本进行基因表达量分析。建库及测序委托上海派森诺生物科技股份有限公司完成。
1.4 差异表达基因的分析和筛选
根据基因表达量对各样品进行主成分分析(PCA),采用DESeq(http://wwwbioconductororg/packagcs/rclcascbioc/html/DEScq.html)对基因表达进行差异分析,筛选出符合表达差异倍数|log2FoldChange|>1,P-value<0.05的差异表达基因。使用R语言Pheatmap软件包对所有比较组差异基因的并集和样品进行双向聚类分析,并对筛选出的差异表达基因进行GO功能以及KEGG富集通路分析。
1.5 实时荧光定量验证
利用Primer Premier 5.0软件设计特异性引物,由擎科生物科技公司合成。使用ChamQTM SYBR qPCR Mster Mix(诺唯赞生物科技(南京)有限公司)试剂盒进行荧光定量验证。引物序列见表1。反应体系共20 μL:2×ChamQ SYBR qPCR Master Mix 10 μL,上、下游引物各0.4 μL,50×ROX Reference Dye 2 0.4 μL,cDNA 1 μL、ddH2O 7.8 μL。PCR扩增程序:预变性阶段为95 ℃ 30 s;循环反应为95 ℃ 10 s,56 ℃ 30 s,72 ℃ 60 s(40个循环);熔解曲线为95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。

表1 实时荧光定量PCR引物序列Table 1 Real-time PCR primer sequences
1.6 统计分析
采用SPSS 22.0软件比较不同样品间的均值与标准误,试验数据使用“平均数±标准差”表示。采用2-△△Ct法对数据进行定量分析,利用t检验分析数据的显着性,并利用GraphPad Prism 8软件进行绘图,以*P<0.05表示差异显着,**P<0.01表示差异极显着。
2 结 果
2.1 热应激下睾丸组织切片分析
种公兔睾丸组织切片HE染色表明,NHS组的睾丸曲细精管基膜清晰,生精上皮细胞排列紧密、整齐有序,各种排列相均清晰可辨,精原细胞、精母细胞和精子细胞在小管中排列紧密(图1A)。而HS组的睾丸生精上皮较薄,受损情况显着,中央出现明显的空泡化和撕裂,精子细胞数量减少,生殖细胞和基底膜之间存在分离,间质空间增加(图1B)。

A. 未热应激组;B. 热应激组A. Non-heat stress group; B. Heat stress group图1 睾丸切片图Fig.1 Testicular section
2.2 测序数据质量评估
采用Cutadapt去除3′端带接头的序列以及去除平均质量分数低于Q20的序列,可以发现Q20、Q30及纯净序列的占比都在85%以上(表2),表明测序质量好,完整性较高。此外,将过滤得到的纯净序列与兔参考基因组进行比对分析(表3),对比率均高于70%,表明得到的纯净序列对比率和可信度较高。同时,对样品间进行PCA主成分分析,结果见图2,PC1(84%),表明在受到热应激刺激后两组之间基因表达发生了明显的变化,可进行后续差异基因的分析。
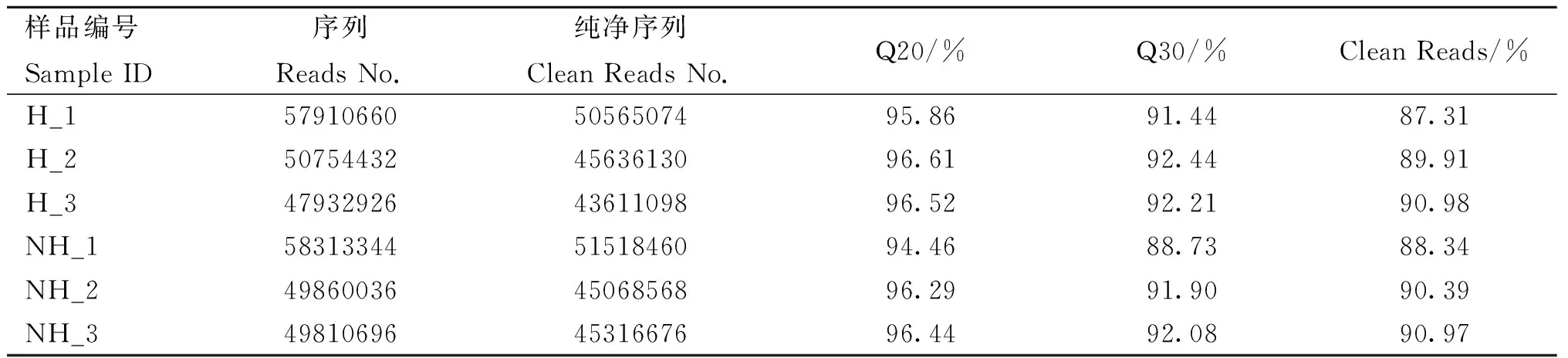
表2 测序数据过滤Table 2 Results of sequencing data filtering
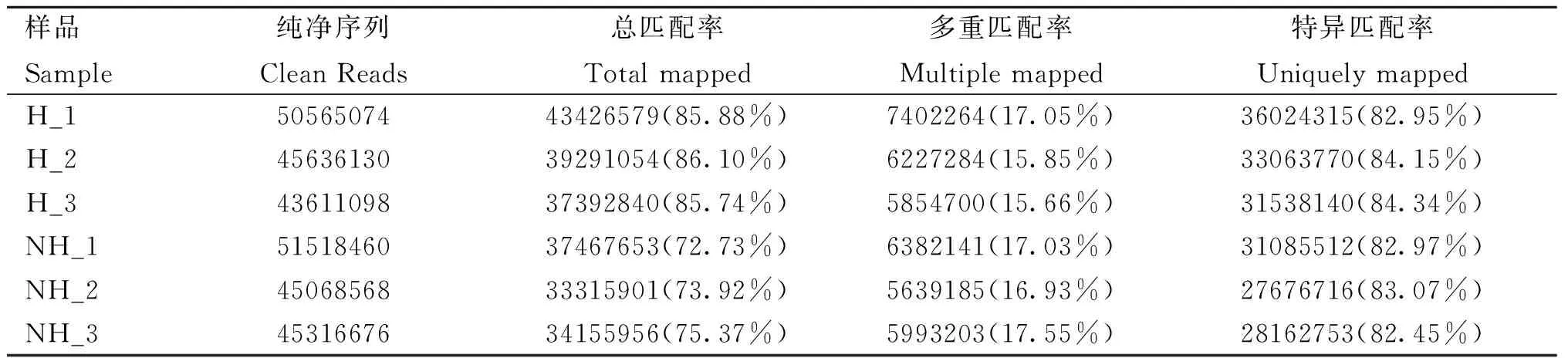
表3 测序数据对比分析Table 3 Comparison and analysis of sequencing data
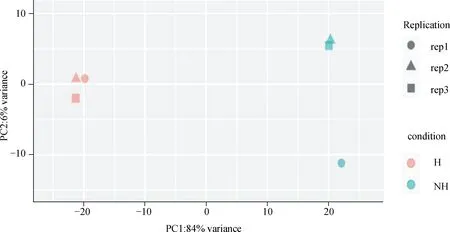
图2 PCA主成分分析结果图Fig.2 PCA principal component analysis result
2.3 差异表达基因分析
采用DESeq对基因表达进行差异分析,共检测到差异表达基因1 676个,其中上调基因894个,下调基因782个,包括ATP5MC1、MDH2、ALDH7A1、GAPDHS、PRPS1基因等。对筛选出的差异基因进行聚类分析,结果显示两组间的差异基因聚类效果较好(图3)。
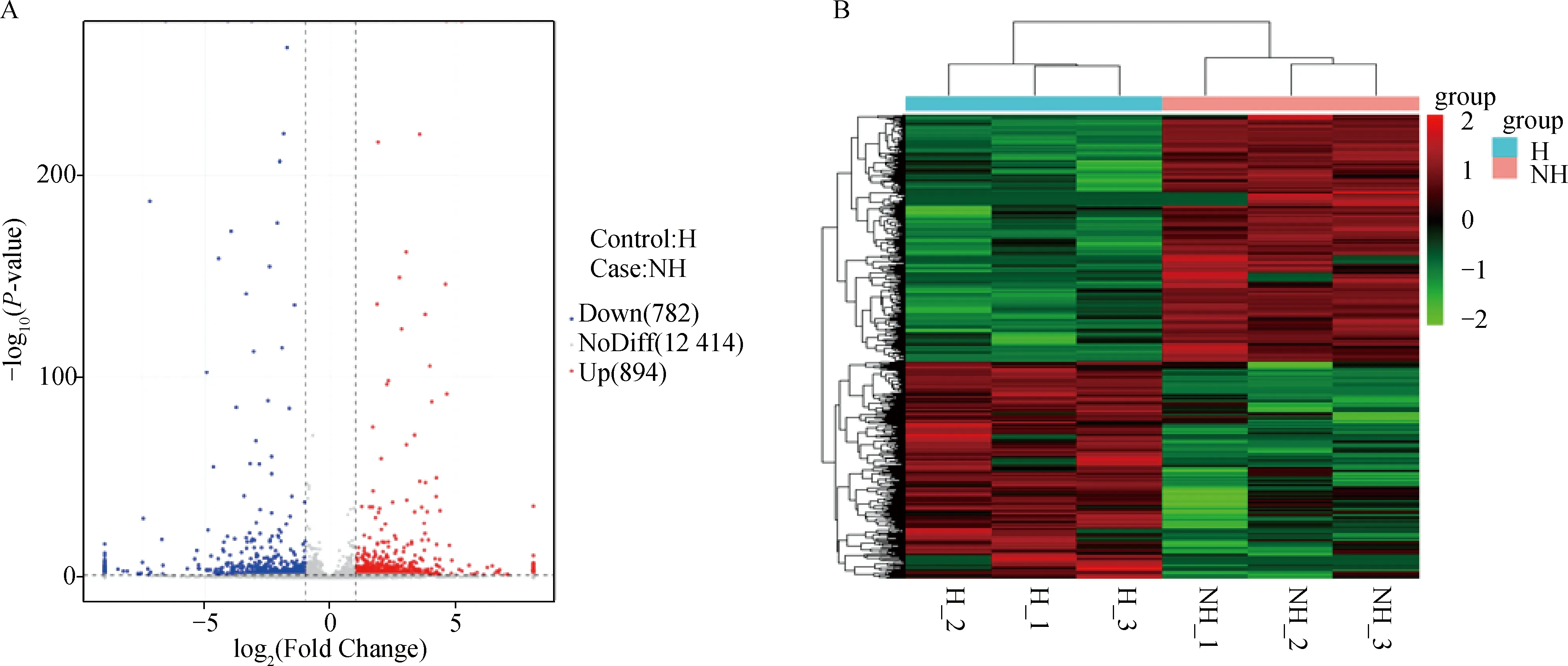
A.差异表达基因火山图;B.差异表达基因聚类分析A. Volcano plot of differentially expressed genes; B. Clustering analysis of differentially expressed genes图3 差异表达基因分析图Fig.3 Analysis of differentially expressed genes
2.4 差异表达基因的GO富集分析
按照生物学过程(biological process)、分子功能(molecular function)和细胞组分(cellular component)对差异表达基因进行GO富集分析,挑选每个GO分类中富集最显着的前10个GO 条目进行分析。差异上调基因主要富集在应激反应(response to stress)、细胞因子(response to cytokine)、蛋白质代谢过程(protein metabolic process)、有机物质运输(organic substance transport)等功能;差异下调基因主要富集在代谢过程(metabolic process)、免疫反应(immune response)、催化活性(catalytic activity)等功能(图4)。
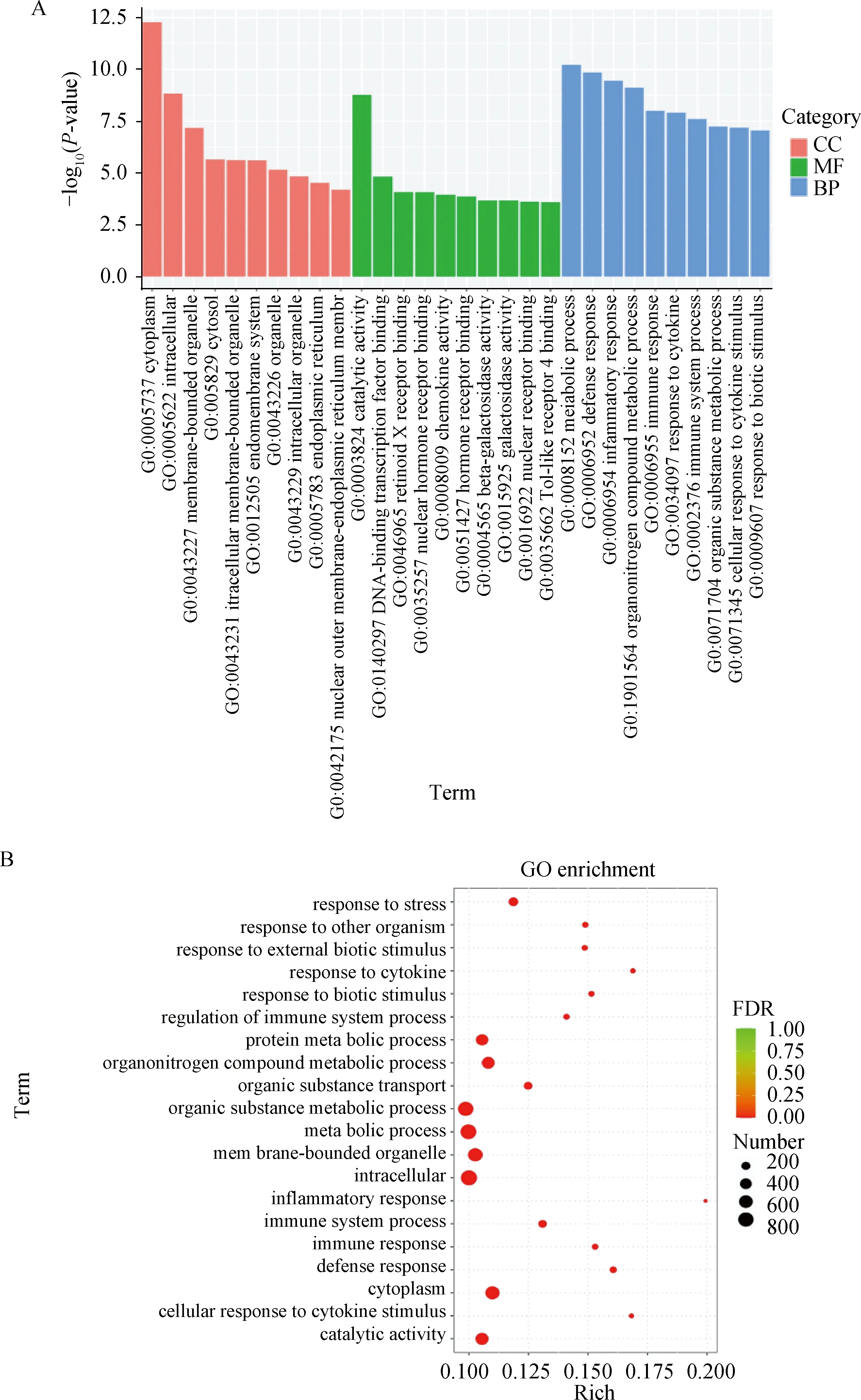
A.差异基因表达GO分类图;B.差异基因表达GO富集气泡图A. GO classification map of differential gene expression; B. GO enrichment bubble diagram of differential gene expression图4 差异基因表达的GO富集分析Fig.4 GO enrichment analysis of differential gene expression
2.5 差异表达基因的KEGG富集分析
在动物体内,基因间通过协同作用发挥各自的功能,对基因进行通路分析有助于确定相关基因行使的生物学功能。对差异表达基因进行KEGG富集分析,共涉及316条通路,其中,与热应激相关的主要有MAPK(MAPK signaling pathway)、PI3K-Akt(PI3K-Akt signaling pathway)、Toll样受体(Toll-like receptor signaling pathway)、Ras(Ras signaling pathway)等信号通路(图5)。
2.6 差异表达基因的RT-PCR验证
为了验证RNA-Seq测序结果的可靠性,随机选取5个差异表达基因(ATP5MC1、MDH2、PRPS1、ALDH7A1和GAPDHS)进行RT-qPCR验证,结果发现ATP5MC1、MDH2、ALDH7A1和GAPDHS基因在NHS种公兔精液中相对表达量高于HS种公兔(P<0.01),而PRPS1基因在NHS种公兔精液中相对表达量低于HS种公兔(P<0.01)(图6)。RT-PCR结果与RNA-Seq测序结果趋势一致,证明本次测序结果可靠。
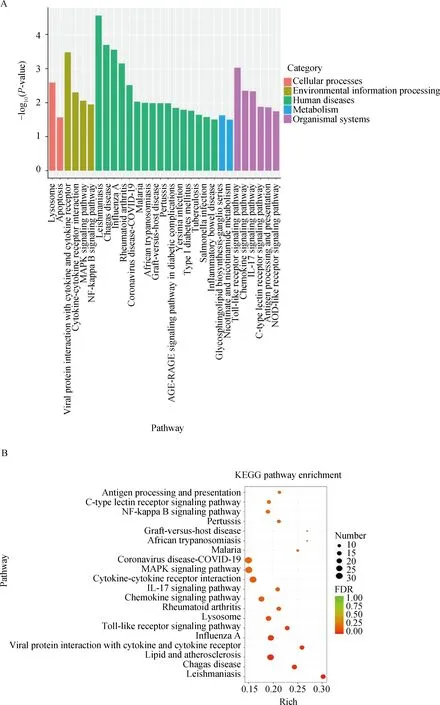
A.差异基因表达KEGG分类图;B.差异基因表达KEGG富集气泡图A. KEGG classification map of differentially expressed genes; B. Bubble diagram of KEGG enrichment of differential gene expression图5 差异基因表达的KEGG通路富集分析Fig.5 KEGG pathway enrichment analysis of differential gene expression
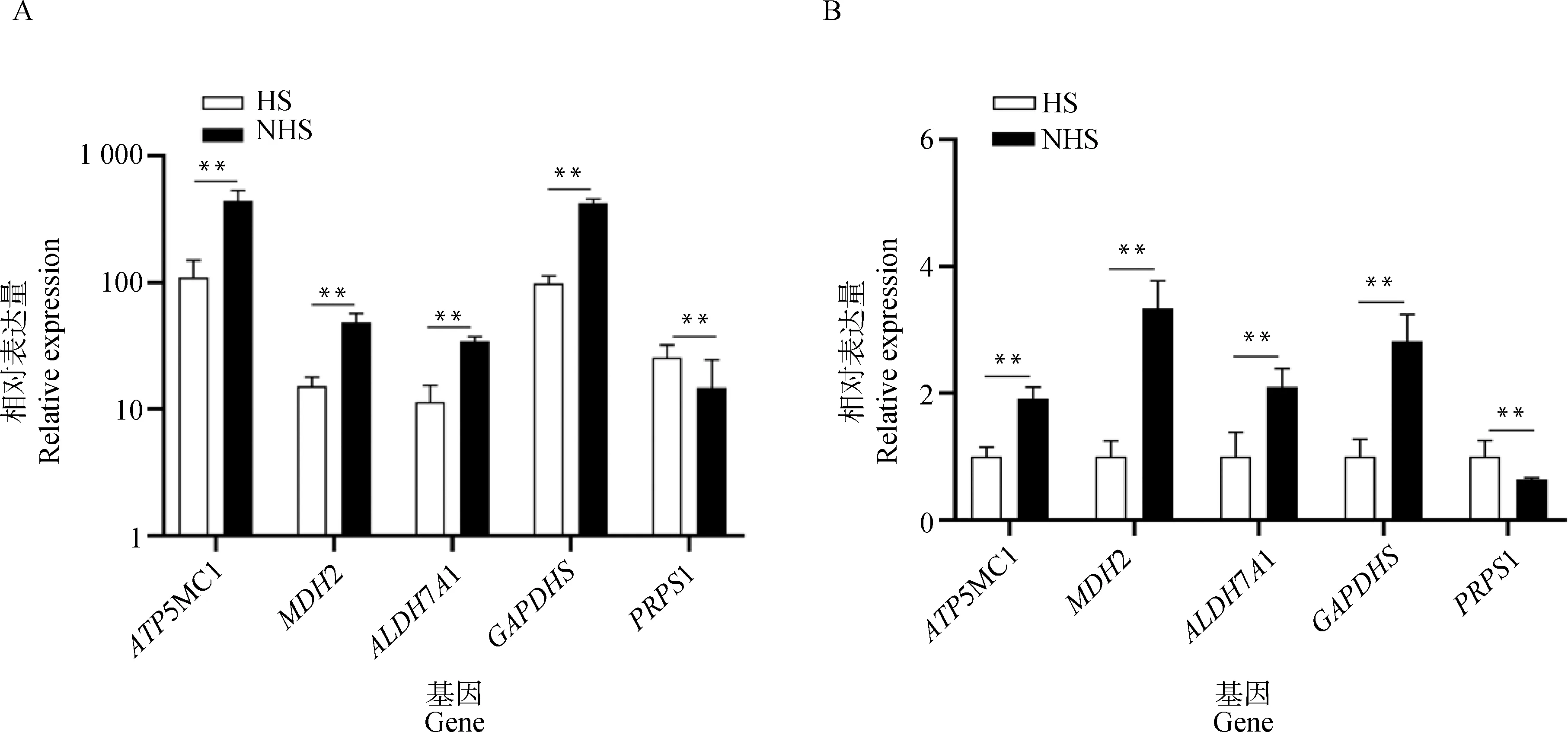
A.差异基因测序时的表达量;B.差异基因RT-PCR验证分析。**表示差异极显着(P<0.01)A.Expression of differential gene sequencing; B. RT-PCR verification analysis of differential genes.** represents P<0.01, with significant difference图6 差异基因的表达图Fig.6 Expression map of differential genes
3 讨 论
家兔汗腺不发达,大多通过呼吸和耳垂来进行散热。热应激会引起动物机体多种生理反应,对动物福利产生负面影响,并显着降低繁殖性能[23-25]。在热应激下,动物机体抗氧化能力下降,活性氧(ROS)增加,发生氧化应激反应,精子的DNA和运动能力均会受到影响,最终导致精液品质的下降[26-28]。热应激对睾丸功能有负面影响,能抑制睾丸激素的分泌,导致精子质量和生育能力的下降[29]。家兔的最佳环境温度范围为15~25 ℃,最佳湿度为55%~65%,当环境温度高于35 ℃时,家兔不能调节体温,易产生热应激[30]。种公兔比母兔对高温更加敏感,高温抑制了下丘脑促性腺激素释放激素(GnRH)的合成和分泌,显着影响睾丸的功能并导致精液品质的下降[31]。种公兔的繁殖效率在生产中极为重要[32],因此具有高品质的精液是实现高生育能力和提高经济效益所必需的。
本试验采集了HS组和NHS组新西兰种公兔睾丸和精液,通过HE染色,比较不同条件下睾丸组织结构的差异,并利用RNA-Seq技术分析了精子的转录组,通过分析比较共发现1 676个差异基因,其中差异上调基因894个,差异下调基因782个。进一步对差异基因进行筛选、功能注释和富集分析发现,GO富集分析在代谢过程中的差异基因有843个,其中包括ATP5MC1、MDH2、PRPS1、ALDH7A1和GAPDHS等。ALDH7A1蛋白也称遗蛋白,RNA-Seq分析方法鉴定经过急性热应激处理的黄羽肉鸡肝脏中的差异表达基因,发现ALDH7A1基因参与丙酮酸代谢,并且在赖氨酸的分解代谢中也发挥了重要作用[33],赖氨酸是一种必需氨基酸,其代谢对维持细胞氮库和酮体的形成具有重要意义[34]。据研究表明,ALDH7A1可通过甜菜碱醛生成渗透物甜菜碱来防止哺乳动物受到高渗应激方面的影响[35]。在哺乳动物中,GAPDHS是一种精子特异性糖酵解酶,是精子中唯一的GAPDH同工酶,可调节精子的运动,是精子活力和男性生育能力所必需的。研究表明,缺乏GAPDHS的小鼠无法生育,产生的精子ATP水平非常低且缺乏运动能力[36-38]。MDH2是一种柠檬酸循环酶,可催化苹果酸转化为草酰乙酸,并通过将草酰乙酸还原成苹果酸和苹果酸共同穿过线粒体内膜参加糖异生过程。MDH2位于精子线粒体内,为精子尾部运动提供所需的能量[39-41],MDH2的异常表达会破坏精子内部能量平衡,影响精子的活力、获能过程以及降低生育能力[42]。研究发现,MDH2的敲除显着降低了细胞的ATP水平,同时提高了ADP/ATP和NAD/NADH的水平以及细胞内ROS的浓度[43]。从GO富集分析看来,ALDH7A1、GAPDHS、MDH2等基因可能与热应激状态下公兔精液品质下降有关。
此外,通过对差异表达基因的KEGG富集分析发现,与热应激相关的主要有MAPK、PI3K-Akt、Toll样受体、Ras等信号通路。在热应激中,MAPK通路被激活,可防止HS诱导的细胞凋亡[44],MAPK通路参与调节细胞的生存、增殖和分化等过程,这在保护细胞免受热损伤中起着关键作用。PI3K-Akt通路是参与细胞生长、存活和代谢的重要通路之一,陈威[45]发现,抑制睾丸中PI3K/Akt/FoxO1信号通路,凋亡因子Caspase-3被激活,进而导致睾丸组织细胞凋亡。睾丸支持细胞(SCs)是促使睾丸产生正常精子的重要细胞之一,PI3K/Akt信号通路可以通过调节激素水平来调控精子发生[46]。因此,推测热应激与MAPK、PI3K-Akt等信号通路密切相关,影响种公兔精子的发生。
综上,HS的机制可能涉及ATP5MC1、MDH2、PRPS1、ALDH7A1和GAPDHS等多个基因,也可能通过MAPK、PI3K-Akt这些信号通路来调控细胞的生长、增殖和凋亡。通过了解热应激反应的分子机制,确定新的靶点,可以有效地预防热应激带来的疾病和危害。
4 结 论
本研究对新西兰种公兔精子热应激组和未热应激组进行转录组分析,检测差异表达基因及相关信号通路,共筛选出1 676个差异表达基因(上调基因894个,下调基因782个),发现SIRT1、PHGDH、MDH2、ATP5MC1、PRPS1、ALDH7A1等5个可能与热应激状态下公兔精液品质下降有关的潜在基因,本研究结果为高温环境下家兔的选育提供理论基础,对养兔业的持续健康发展具有重要意义。



