陈 诚,乔西波,孙 亿,康 丽,姜运良*
(1.山东农业大学 山东省动物生物工程与疾病防治重点实验室,泰安 271018; 2.山东纪华家禽育种股份有限公司,莒县 276800)
琅琊鸡俗称日照麻鸡,原产于胶南、日照等地;由于在历史上这些地区曾属于琅琊郡而得名。1977年被列入山东省畜禽地方良种,1978年被正式定名为琅琊鸡[1]。成年琅琊鸡的公鸡颈部羽毛为金黄色,尾羽为黑绿色,其余羽毛为红褐色,故有“火红大公鸡”的美誉。成年琅琊鸡的母鸡体型小巧,尾羽呈黑色,其余覆盖黄褐色麻羽。琅琊鸡体型小巧、运动量大、觅食能力强,具有较强的抗病能力。作为肉蛋兼用型品种,琅琊鸡的屠宰率较高,肉质鲜嫩可口;鸡蛋的蛋黄比率高,营养物质含量丰富且口感较好[2-3]。随着外来高产肉鸡和蛋鸡品种的引进、杂交及商业化,琅琊鸡因其生长速度慢、开产日龄较晚、产蛋率和产肉率较低等受到较大冲击,导致琅琊鸡的数量锐减。因此,提高琅琊鸡的开产日龄、产蛋量等产蛋性状,对于更好地保护和开发利用这一古老品种具有重要意义。
鸡等家禽的产蛋能力取决于卵巢及卵泡的发育,受下丘脑-垂体-性腺轴(HPG)的调节,其中垂体分泌的促卵泡素(FSH)、黄体生成素(LH)以及卵巢产生的类固醇激素(雄激素、雌激素、孕酮等)发挥了重要作用。FSH是促进卵泡发育的主要激素,能够促进卵泡膜上的血管生成,增加卵泡壁细胞处的氧气摄入量,使卵巢血液循环加快;还能减弱颗粒细胞之间的紧密连接,让卵母细胞更容易吸收卵黄,促进卵黄沉积而使卵泡体积及重量增加[4-6]。FSH需要与促卵泡素受体(FSHR)结合才能发挥作用。FSHR是G蛋白偶联受体家族中的一员[7],其 cDNA序列和全序列于2005年初步完成[8-9]。该基因位于鸡3号染色体上,全长77 664 bp,包含10个外显子和9个内含子[10]。
卵泡选择是影响鸡产蛋性能的关键步骤,涉及到卵泡颗粒细胞的分化和增殖。卵巢中卵泡的选择主要由FSH通过FSHR介导的环腺苷一磷酸(cAMP)途径实现。等级前卵泡的颗粒细胞处于未分化状态,当卵泡颗粒细胞开始分化时FSHRmRNA含量升高,垂体前叶释放的FSH增多,通过血液循环进入卵巢卵泡,小黄卵泡被选择进入等级卵泡序列[11]。另外,在家禽卵巢发育过程中,左侧卵巢比右侧卵巢的FSHR表达量高,从而使左侧卵巢优先发育,因此FSHR也对家禽卵巢的不对称发育产生影响[12-13]。已有的研究表明,FSHR启动子区的-868位点的一个200 bp的插入缺失突变与新杨褐鸡[14-15]的开产日龄有关。本研究对该位点在琅琊鸡群体中的多态性及其遗传效应进行分析,为琅琊鸡的保种和开发应用服务。
1 材料与方法
1.1 试验动物及其基因型检测
该研究所用382只琅琊鸡母鸡饲养于山东纪华家禽育种股份有限公司琅琊鸡原种鸡场,所用鸡只来自同一鸡舍,饲养条件一样,单笼饲养,自由采食,光照采用16D+8L。对每只鸡分别记录开产日龄(AFE)和每天的产蛋数,然后统计32周的产蛋数(E32)、47周的产蛋数(E47)、最大连续产蛋天数(MCS)和平均连续产蛋天数(ACL)。鸡FSHR基因-868位点的基因型检测参照文献[14]进行。具体步骤如下:取血样20 μL,采用天根血液基因组DNA提取试剂盒(DP348)提取鸡血液基因组DNA,用Eppendorf Bio-Photoeter plus分光光度计并结合1%的琼脂糖凝胶电泳检测DNA的纯度和浓度。参照文献[14]设计-868位点200 bp插入缺失多态性检测的引物-868F和-868R(表1)。PCR反应体系为20 μL:ddH2O 14.5 μL,10×Ex Taq Buffer 2 μL,dNTP mixture 1.6 μL,上、下游引物各0.4 μL,ExTaqDNA聚合酶0.1 μL和基因DNA模板1 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸1 min 10 s,40个循环;72 ℃延伸5 min。
1.2 组织样品采集
随机选取相同日龄、正常产蛋的FSHR基因-868位点3种基因型的琅琊鸡母鸡各3只,按照山东农业大学动物福利的要求屠宰(No.: SDAUA-2021-097),分别取卵巢、等级前卵泡和等级卵泡,冻存于液氮中,用于FSHR基因表达的分析。
1.3 组织总RNA的提取及实时荧光定量PCR
用RNA Easy Fast 动物组织/细胞总RNA提取试剂盒(DP451)提取琅琊鸡等级前卵泡、等级卵泡以及卵巢组织的总RNA,用Eppendorf Bio-Photoeter plus分光光度计并结合1%的琼脂糖凝胶电泳检测RNA的纯度和浓度。用Evo M-MLV反转录预混型试剂盒将总RNA反转录成cDNA。以cDNA为模板,利用特异性引物(表1)[14]进行实时荧光定量PCR反应,检测FSHR基因mRNA在等级前、等级卵泡及卵巢中的相对表达量。实时定量PCR体系包括2×SYBR Green ProTaqHS Premix 10 μL,上、下游引物各0.4 μL,cDNA 2 μL和ddH2O 7.2 μL。反应程序:95 ℃预变性 30 s;95 ℃ 5 s,55 ℃ 30 s,40个循环;熔解曲线条件为95 ℃ 1 s,57 ℃ 30 s,95 ℃ 1 s。
1.4 蛋白提取及Western Blotting
用碧云天生物技术公司的Western及IP细胞裂解液和蛋白酶抑制剂(每1 mL裂解液加入20 μL蛋白酶抑制剂)分别处理鸡等级前卵泡、等级卵泡及卵巢组织,提取总蛋白,用BCA蛋白浓度测定试剂盒(增强型)测定蛋白浓度。在进行Western Blotting之前,金属浴 100 ℃ 10 min对组织蛋白进行变性,蛋白上样量为30 μg。采用碧云天BeyoGelTMPLUS PAGE预制胶,110 V 约1.5 h进行电泳;利用新赛美的快速转膜液400 mA 20 min转膜,转膜完成后用快速封闭液在摇床下封闭10 min,再用PBS洗3次,每次10 min;用通用型抗体稀释液分别稀释目的一抗(FSHR Rabbit Polyclonal antibody,proteintech)和内参一抗(GAPDH抗体,小鼠单抗,碧云天);稀释比例1∶1 000,在摇床下分别孵育2 h,孵育完成后用PBS洗膜3次,每次10 min;二抗为辣根过氧化物酶标记山羊抗兔IgG(H+L);显影用超敏ECL化学发光试剂盒在C300凝胶成像系统下进行。根据凝胶成像系统下所显示出的蛋白条带,用分析软件Image J对条带灰度值分析FSHR蛋白的相对表达量。
1.5 数据分析
用EXCEL计算琅琊鸡群体在-868位点的等位基因频率和基因型频率,并进行Hardy-Weinberg遗传平衡分析。用SAS9.2统计软件包中的一般线性模型分析基因型与产蛋性状的关系。对于qRT-PCR和Western Blotting,每个样本的结果至少重复3次,数据用“平均数±标准误”表示,用单因素方差分析进行组间的差异显着性分析,P<0.05为差异显着。
2 结 果
2.1 琅琊鸡FSHR 5′调控区-868位点多态性
以检测符合要求的琅琊鸡基因组DNA进行PCR扩增,可以区分出3种基因型,即插入纯合型(I+I+)、缺失纯合型(I-I-)和杂合型(I+I-)(图1)。
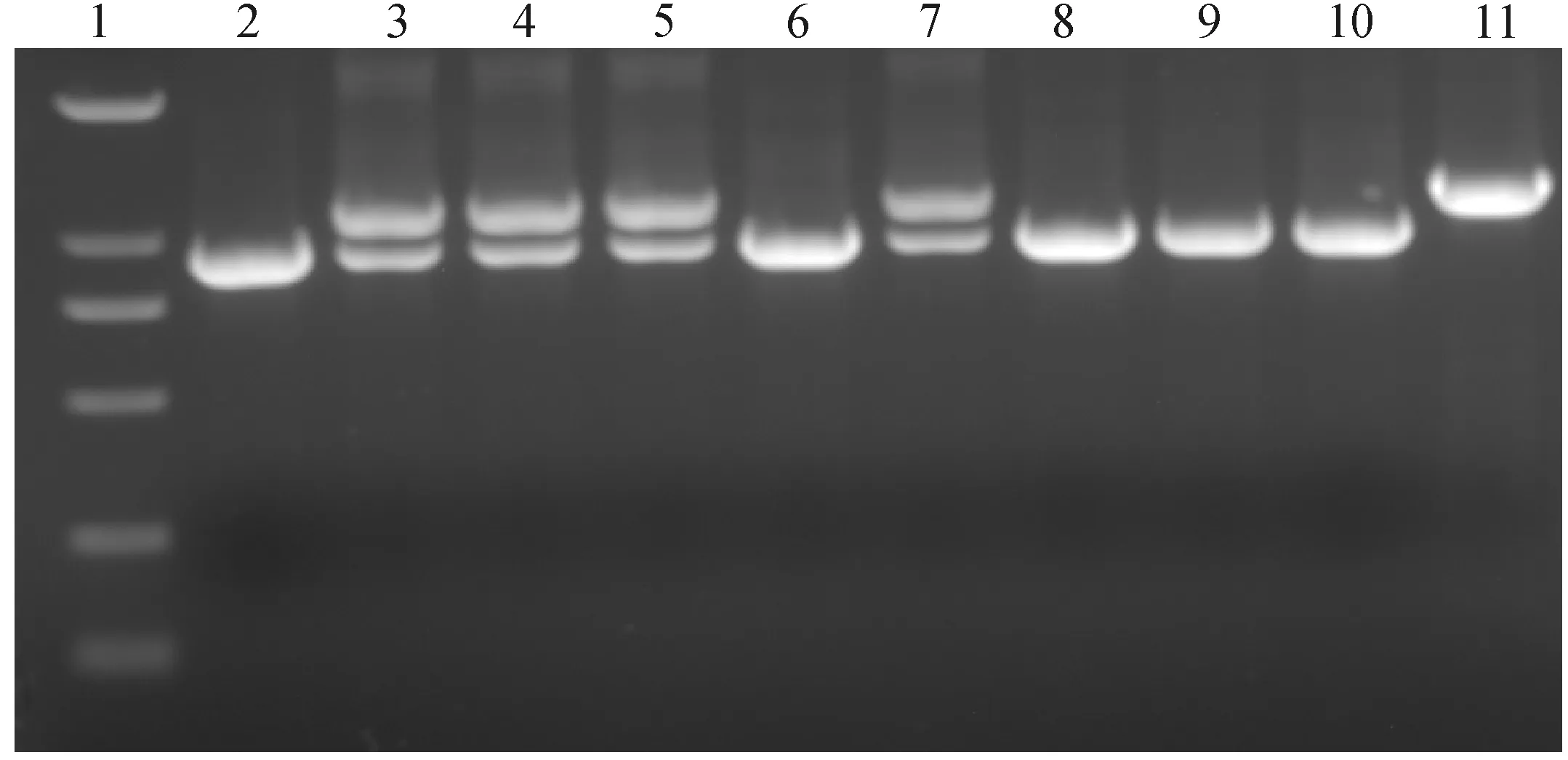
1.DNA相对分子质量标准,从上到下分别为2 000、1 000、750、500、250和100 bp;2、6、8、9、10. 基因型I-I-;11. 基因型I+I+;3、4、5、7.基因型I+I- 1. DNA marker, from up to down: 2 000, 1 000, 750, 500, 250 and 100 bp; 2, 6, 8, 9, 10. Genotype I-I- ; 11. Genotype I+I+; 3, 4, 5, 7. Genotype I+I-图1 琅琊鸡FSHR 5′调控区-868多态性位点的PCR扩增(1%琼脂糖凝胶)Fig.1 PCR amplification of the 5′-regulatory region at -868 polymorphic site of FSHR gene in Langya chicken (1% agarose)
对382只琅琊鸡群体FSHR5′调控区-868位点处的等位基因和基因型频率进行了统计分析,并进行Hardy-Weinberg群体遗传平衡学分析。由表2可见,此位点3种基因型个体均存在,I-为优势等位基因,群体显着偏离Hardy-Weinberg平衡(P<0.05)。

表2 FSHR 5′调控区-868位点在琅琊鸡群体中的基因型和等位基因频率分布Table 2 Genotype and allelic frequencies at the -868 polymorphic site in the 5′-regulatory region of FSHR gene in Langya chicken population
2.2 琅琊鸡FSHR 5′调控区-868位点多态性与产蛋性状的关联分析
对FSHR5′调控区-868位点多态性与382只具有产蛋记录的琅琊鸡进行的关联分析表明(表3):不同基因型个体的开产日龄(AFE)、32周产蛋数(E32)和平均连产天数(ACL)的差异不显着(P>0.05),但47周产蛋数(E47)的差异显着(P<0.05),I+I-基因型个体的E47显着高于I-I-基因型个体;最大连产天数(MCS)差异显着(P<0.01),I+I+和I+I-基因型个体的MCS显着高于I-I-基因型个体。
进一步分析了不同基因型琅琊鸡换羽后134天的产蛋量,结果表明(表4),-868位点对换羽后产蛋量的影响显着(P<0.05),I-I-基因型个体产蛋数在3种基因型中最低,I+I-基因型个体换羽后134天的产蛋数(134D)显着高于I-I-基因型个体(P<0.05)。
2.3 5′调控区-868位点不同基因型FSHR基因的表达对比
在等级前卵泡中,I+I+基因型个体的FSHRmRNA表达水平显着高于I-I-基因型个体(P<0.05),蛋白水平差异不显着(图2)。FSHR的mRNA和蛋白表达水平在3种基因型个体的等级卵泡中以I-I-基因型个体最低,但在3种基因型间差异不显着(P>0.05)(图3)。在除卵泡外的卵巢组织中,I-I-基因型个体的FSHRmRNA表达水平较低,但与其他基因型差异不显着(P> 0.05);I+I-基因型个体蛋白水平显着高于I-I-基因型个体(P<0.05)(图4)。
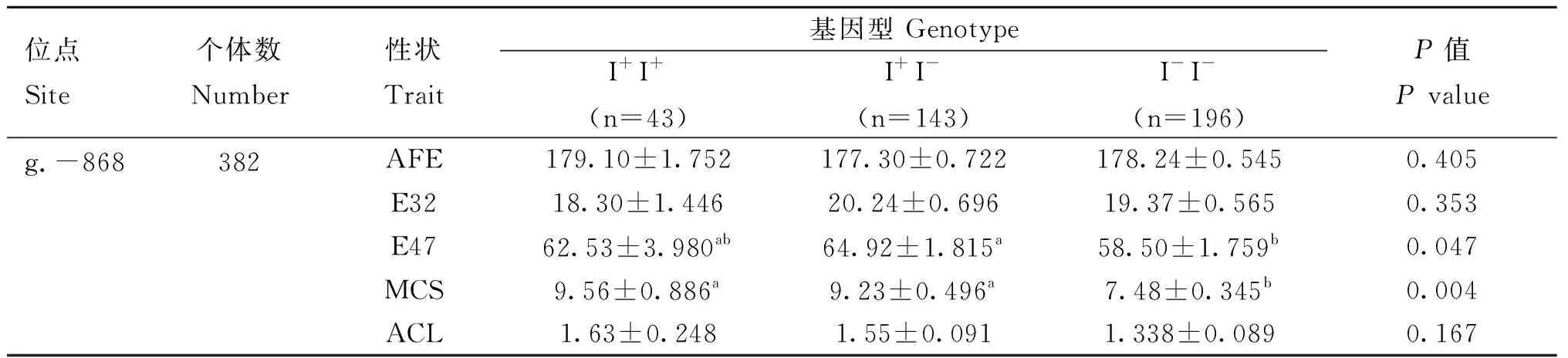
表3 FSHR 5′调控区-868位点多态性与琅琊鸡产蛋性状的关联分析Table 3 Association analysis of the -868 locus polymorphism in the 5′ regulatory region of FSHR with egg laying traits in Langya chickens

表4 FSHR 5′调控区-868位点多态性与琅琊鸡换羽后134天产蛋量的关联分析Table 4 Association analysis of the -868 locus polymorphism in the 5′ regulatory region of FSHR with egg number at 134 days after moulting in Langya chickens
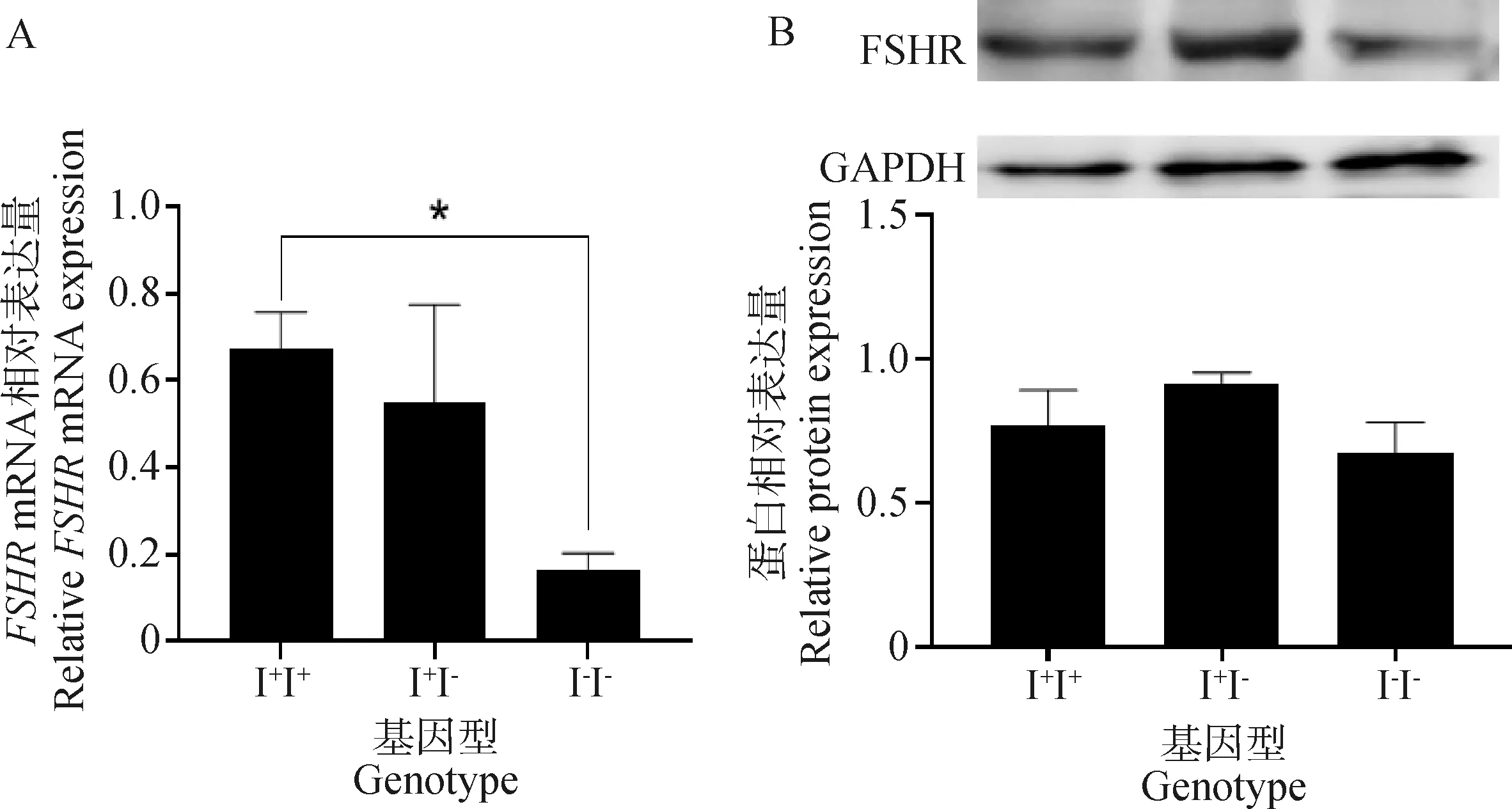
*.P<0.05,下同 *.P<0.05, the same as below图2 FSHR mRNA(A)和蛋白(B)在鸡等级前卵泡中的表达Fig.2 The expression of the FSHR mRNA (A) and protein (B) in chicken pre-hierarchical follicles
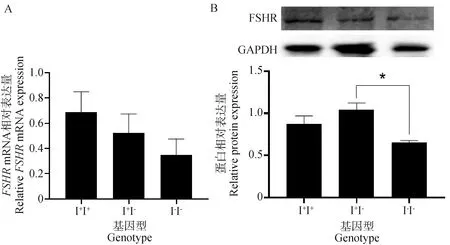
图4 FSHR mRNA(A)和蛋白(B)在鸡卵巢中的表达Fig.4 The expression of the FSHR mRNA (A) and protein (B) in chicken ovaries
3 讨 论
鉴于FSH在动物生殖中的重要作用,人们对其受体FSHR的多态性有广泛的研究,尤其在与人的不孕不育的关系方面,包括女性的多囊卵巢综合征、卵巢功能低下[16-25]以及男性的不育症[26]; 而在家畜FSHR多态性的研究相对较少。研究表明,FSHR外显子10的多态性影响皖南黑猪和巴克夏猪的产仔数[27], 外显子1的3个多态性位点影响小梅山猪的产仔数[28], 另外3个多态性位点(74、532 和1 166)影响猪的黄体数[29];绵羊FSHR的多态性影响其mRNA的降解和转录活性[30-31],也与其产羔数有关[32-33];牛FSHR5′侧翼区也存在一处多态性[34]。
在最初对鸡FSHR多态性的研究中,发现其5′调控区-868位点存在200 bp的插入/缺失突变,所分析的鲁禽鸡群体中插入型纯合子(I+I+)最少,不同基因型32周(E32)和42周(E42)产蛋数差异不显着,但I-I-基因型个体的产蛋量最低[15]。进一步对文昌鸡群体的研究显示,此位点对开产日龄(AFE)和39周产蛋数的效应未达到显着水平,I-I-基因型个体的产蛋量亦最低;又对新杨褐蛋鸡群体进行了分析,发现该位点对AFE有显着影响,I-I-基因型个体开产较早[14]。在另一项对苏垦鸡的研究中,I-为优势等位基因,I-I-基因型个体的开产日龄显着早于I+I+基因型个体[35]。本研究对382只琅琊鸡FSHR5′调控区-868位点处的多态性分析表明,I-I-基因型频率最高,I-为此位点的优势等位基因;对琅琊鸡AFE和E32的效应不显着,但对E47的效应显着,且I-I-基因型个体的产蛋量显着低于I+I-基因型个体;对最大连产天数(MCS)的效应达到极显着水平,且I-I-基因型显着低于其它基因型。综合上述结果,推测该位点处200 bp的插入通过影响MCS影响琅琊鸡的E47。为了分析强制换羽是否影响FSHR不同基因型的效应,进一步对-868位点与琅琊鸡换羽后的产蛋量进行了关联分析,结果也表明,I-I-基因型个体在换羽后134天的产蛋数显着低于I+I-基因型个体。
为了探讨该位点影响鸡产蛋性能的分子机制,进一步比较了琅琊鸡FSHR5′调控区-868位点不同基因型个体卵泡和卵巢中FSHR的表达水平。qRT-PCR的结果显示,在等级前卵泡中I+I+基因型个体的FSHRmRNA表达量最高,I-I-基因型个体最低且显着低于I+I+基因型个体,这与在新杨褐鸡群中FSHRmRNA在小白和小黄卵泡中的分析结果基本一致[14]。本研究又进一步在琅琊鸡等级卵泡及卵巢上进行了上述的比较,发现不同基因型间的差异虽未达到显着水平但是I-I-基因型个体的FSHRmRNA表达量仍最低。在蛋白水平上,Western Blotting的检测结果显示FSHR5′调控区-868位点不同基因型个体间的差异与mRNA的变化基本一致,I-I-基因型个体的FSHR蛋白表达量最低。有对北京油鸡FSHR基因多态性与其mRNA水平关系的研究[36],但没有涉及本研究报道的位点。
从以上对琅琊鸡-868位点多态性的分析能够看出,I+I+基因型个体所对应的后期产蛋量要比I-I-基因型个体多,I-I-基因型个体的开产日龄有早于I+I+基因型个体的趋势。本研究对琅琊鸡群体FSHR不同基因型个体产蛋性能分析的结果显示,I+I-基因型个体的47周产蛋数(E47,n=382)、换羽后134天产蛋数(134D,n=269)显着高于其它两种基因型个体。推测可能与等位基因间的互作有关,其机制有待于进一步研究。杂种优势的利用成为畜牧业生产和新品种培育的重要手段之一,一般是指利用不同品种或者同品种间的不同纯系亲本进行杂交得到杂种第一代,其表现出的特征要优于纯系亲本。在鸡产蛋性能方面,大骨鸡GDF9基因第二外显子SNP G1609T位点杂合型个体的产蛋量及蛋重方面较高[37];在京海黄鸡GDF9基因多态性中,g.2420T> C这个位点的杂合型C2T2在300日龄时平均蛋重显着高于T2T2纯合型[38]。与本研究结果相似。
在家禽中,除了鸡以外,也有对番鸭FSHR多态性的研究,共发现16个SNPs,其中位于编码区的两个多态性位点(A227G和C320T)分别与59周的产蛋数、开产日龄有关[39]。作为一个古老的地方鸡品种,琅琊鸡在产蛋性能方面需要进行选育提高。现有鸡群中I+I+和I+I-基因型的个体约占50%。通过基因型检测和定向选配,逐步淘汰I-I-基因型个体,群体中I+的频率会越来越高,从而能够提高琅琊鸡整体的产蛋性能。此外,在以琅琊鸡为亲本的优质鸡育种中,选择I+I+和I+I-基因型个体也可以提高父母代鸡的产蛋性能。
4 结 论
本研究分析了琅琊鸡FSHR基因-868位点的多态性及其遗传效应,发现FSHR5′调控区-868位点多态性对琅琊鸡E47和MCS效应显着,亦对换羽后134 d的产蛋量产生显着影响,I+I+基因型个体的FSHR表达量较高。通过基因型选择逐步降低I-等位基因频率,预期可以提高琅琊鸡的产蛋性能。



